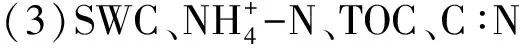鄱阳湖典型湿地土壤微生物活性对季节性水位变化的响应
邹 锋,武鑫鹏, 张万港, 马燕天, 2, 刘亚军, 吴 兰, 2,*
1 南昌大学生命科学学院,南昌 330031 2 鄱阳湖环境与资源利用教育部重点实验室,南昌 330031
鄱阳湖是我国最大的通江型淡水湖泊,受长江水位和江西省内五大水系的双重影响,具有“高水是湖、低水似河”的独特景观[1]。鄱阳湖高变幅的水位波动造就了大面积的湖泊湿地,在维持鄱阳湖生态系统稳定过程中发挥着极其重要的作用[2]。近年来受气候改变与人类活动的影响,鄱阳湖湿地面临江湖关系改变、植被演替加快、枯水时间延长、生物多样性下降等诸多不利因素的挑战[3]。尽管众多学者已经注意到这些问题,但现有的研究仍大多集中于植被沿水位分布情况、重金属污染、温室气体排放以及水质污染分析等方面;而对微观尺度上土壤微生物以及它对水文情势的响应关系和响应机理的研究却较少。
在湿地生态系统中土壤微生物不仅加速了植物凋落物和有机质的分解[4]、驱动着氮、磷等营养元素的循环转化[5]、推动了化学能量和信息的流动[6]、同时还参与了污染物降解与环境修复等过程[7],对维持湿地生态系统平衡与稳态起着重要的作用[8]。对于湖泊湿地微生物的研究,土壤微生物活性指标往往比微生物群落结构指标能够更加直观地反应湿地生态功能,因而更加受到人们的重视。已有研究表明,土壤酶活、微生物生物量、基础呼吸等活性指标能够准确的反映出土壤中的物质代谢情况,并对各种环境扰动做出快速响应[9-10]。湿地环境条件的改变,如营养物含量、水深、pH、植被等都会影响到湿地微生物的结构和功能[11-14]。截至目前对于淡水湖泊湿地土壤微生物如何响应水位波动的规律并不清楚,而鄱阳湖天然湿地面临的问题亟需我们彻底弄清这一规律,因此,深入分析鄱阳湖湿地土壤微生物对不同季节水位的响应关系显得十分必要。
本研究以鄱阳湖湿地为研究对象,通过对不同季节土壤的物理化学参数、土壤酶活性、微生物生物量及基础呼吸等微生物活性指标的研究,揭示不同高程湿地土壤微生物活性对季节性水位变化的响应过程和响应机制。本研究的结论可为鄱阳湖湿地的合理保护与科学管理提供微生物方面的视角,对鄱阳湖湿地土壤质量演变及评价、生态系统结构和功能稳定性的维持等方面也具有重要意义。
1 研究区域与研究方法
1.1 样地介绍与样品采集
研究地点位于鄱阳湖湿地国家自然保护区蚌湖(115°53′—116°01′E,29°08′—29°18′N)。受季节性水位波动的影响,区内洲滩湿地呈现典型的水陆交错现象,湿地地上植被沿不同的高程呈现环带状分布,优势植被带垂直分布明显(表1)。本研究由湖岸往湖心方向依次选取3个不同水位高程的样带依次编号为S1—S3,每个样带下设置间距为100 m的3个样方,共设置1 m×1 m的样方9个。首先对采样点进行GPS定位和地上植被调查并记录样带水淹情况,然后分别在2014年3月(未淹水)、6月(淹水时长:0、5、10 d)、10月(淹水时长:30、70、125 d)以及2015年1月(未淹水)进行采样,代表春夏秋冬4个季节的样品。清除地上枯落物后,以五点混合采样法用土钻采集表层土壤样品(0—20 cm)。最终得到3个样带、4个季节一共36份样品。将土壤样品低温运回去除根茎残体及石块后混匀分成3份。其中一份样品保存于-80℃冰箱用作酶活性的测定;第二份暂储存于4℃冷库中用于测定土壤基础呼吸及微生物生物量;最后一份样品风干处理后过100目筛用于理化分析。
1.2 样品分析及方法
1.2.1土壤理化性质
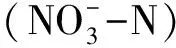
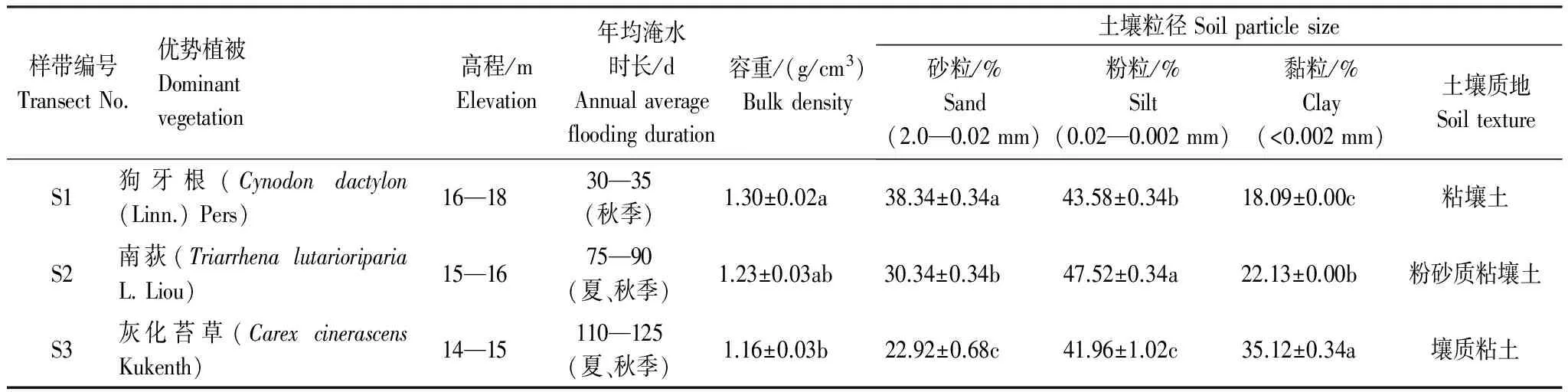
表1 研究区域基本概况
平均值±标准误,同一列不同字母表示样带间差异显著(P<0.05)
1.2.2微生物活性特征
土壤基础呼吸(basal respiration,BR)采用密闭碱液吸收滴定法测定[19]。采用氯仿熏蒸-K2SO4浸提法测定土壤微生物量碳(MBC)及微生物量氮(MBN)[20],换算系数K=0.45。代谢熵(qCO2) =BR/MBC。微生物碳熵(qMBC)%= MBC/TOC×100%;微生物氮熵(qMBN)%= MBN/ TN×100%。
土壤酶活方面,β-葡萄糖苷酶(Bglu)、β-木糖苷酶(Bxyl)、N-乙酰氨基葡萄糖苷酶(NAG)、磷酸酶(Phos)4种水解酶的活性运用微孔板荧光法测定[21]。2种氧化酶——酚氧化酶(Phox)和过氧化氢酶(Pero)分别以左旋多巴(DOPA)和加DOPA的过氧化氢(H2O2)作为底物,用比色法测定[22]。
1.2.3数据处理
采用Excel 2013和SPSS 20.0软件对数据进行统计整理与制图。采用单因素方差分析(ANOVA,Tukey test)对土壤理化参数和微生物特征进行多重检验;使用双因素方差分析(Two-way ANOVA)进行样带和季节对基本理化参数和微生物特征影响的统计分析;土壤理化和微生物活性特征间相关性分析则采用Pearson检验法。应用Canoco 5.0分别对土壤理化、微生物活性进行主成分分析(PCA)。
2 结果与分析
2.1 土壤基本理化因子比较
土壤是微生物赖以生存的基础,土壤环境决定了微生物的生存状况。土壤理化指标对不同季节和不同高程都有明显的响应。如表2所示SWC在32.60%—64.53%之间,夏季和秋季SWC显著高于其他季节(P<0.05);土壤pH春冬季总体显著高于夏季(P<0.05),高程越低的样带土壤平均含水量和pH也越高。在土壤养分元素中,仅从季节层面整体来看,TOC和C∶N在秋季总体较高,而TP夏季含量显著高于其他季节(P<0.05),AFDM冬季含量最高(P<0.05);在不同高程整体差异方面,TOC、TN、C∶N 以及AFDM也都有S2高于S1和S3的现象(P<0.05)。另外,值得注意的是高程最低的S3样带春季TOC和C∶N均为年内最低(P<0.05)(表2)。


表2 土壤理化性质与营养元素含量
平均值±标准差;大写字母表示样带内部季节间差异显著(P<0.05);小写字母表示同一季节样带间差异显著(P<0.05);SWC:soil water content;pH:pH value;AFDM:ash free dry mass;TOC:total organic carbon;TN:total nitrogen;TP:total phosphorus;C∶N:TOC/ TN
土壤DOC、DON占TOC、TN的比例范围分别为0.17%—0.50%和0.22%—1.16%(表3)。在整体季节层面,DOC/TOC和DON/TN的比例夏季显著高于其他季节(P<0.05);随着样带高程的降低,两者的分配比例也整体逐渐下降。
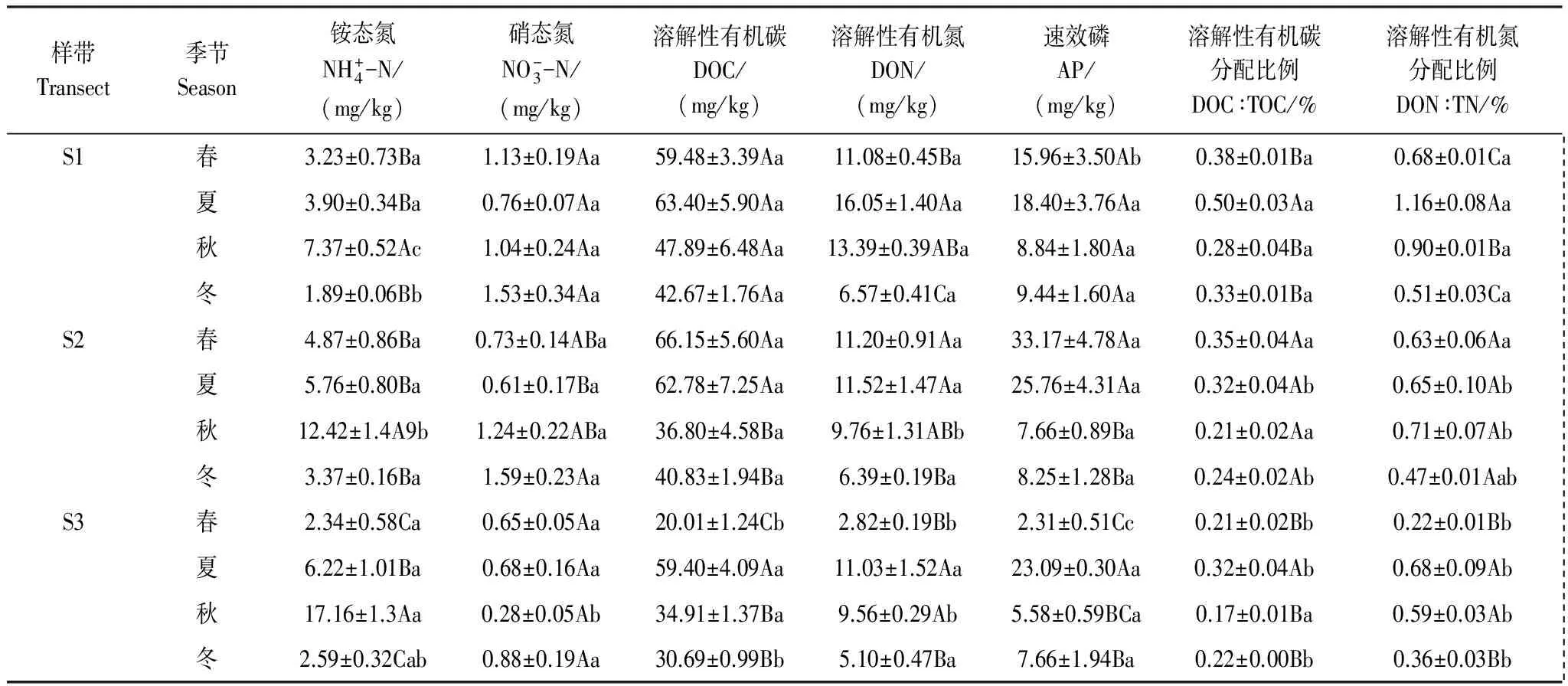
表3 土壤速效、溶解性物质含量
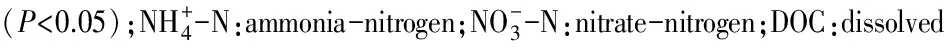
2.2 土壤微生物量碳氮与基础呼吸
土壤基础呼吸、微生物量和微生物熵值都是土壤质量的敏感性指标[23]。在总体季节上,除MBN外,MBC、qMBC、qMBN等指标大致都有夏季和冬季相对较高、春秋季较低的趋势,而qCO2却刚好相反;BR强度在春季显著高于其他季节(P<0.05)。在不同高程样带间,S2样带土壤微生物量、微生物呼吸及微生物熵值都高于S1和S3。值得注意的是,春季高程最低的S3样带MBC、MBN和BR都相对较低(表4)。
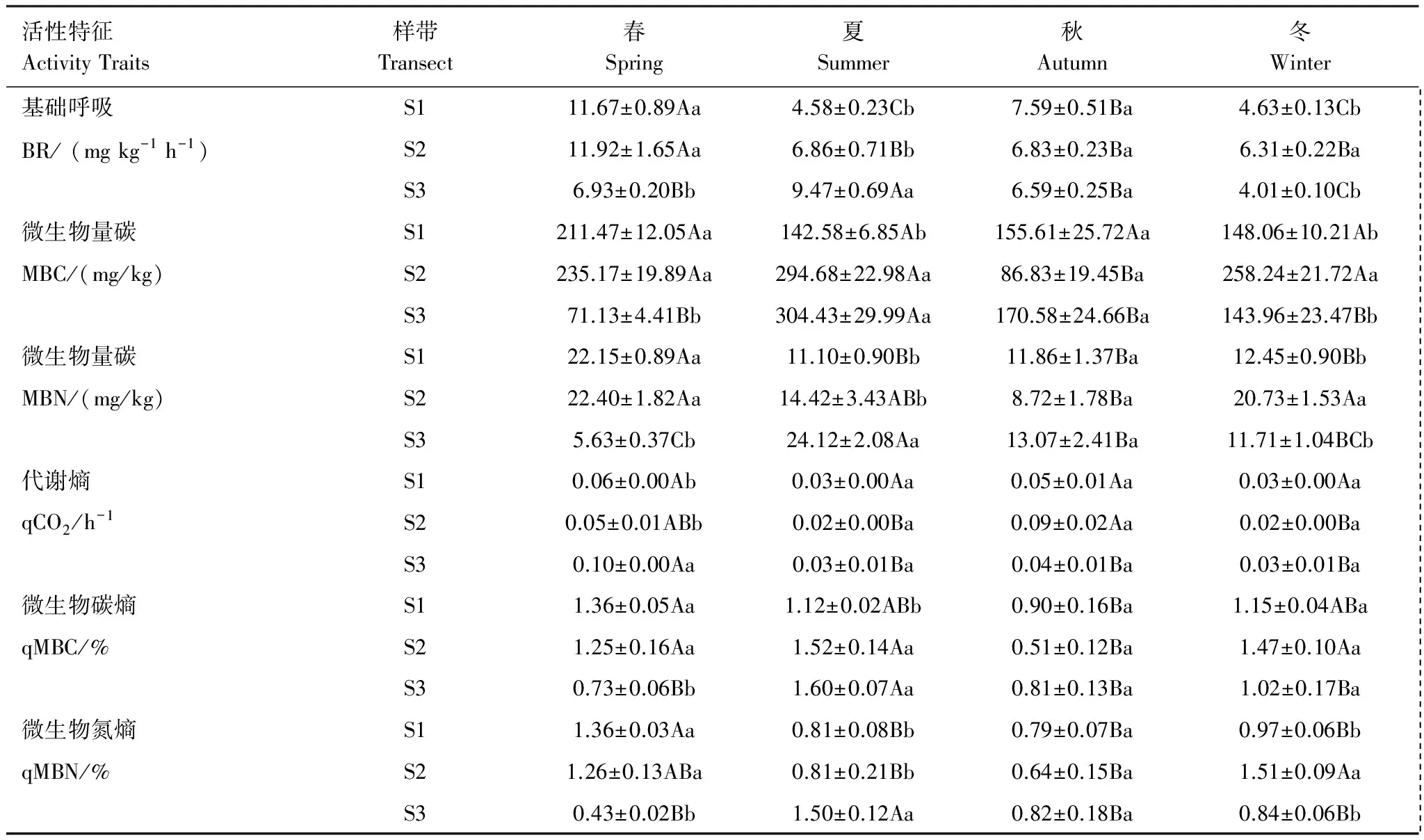
表4 微生物量碳氮和基础呼吸在各季节及样带中的分布
平均值±标准误;大写字母表示样带内部季节间差异显著(P<0.05);小写字母表示同一季节样带间差异显著(P<0.05);BR:microbial basal respiration;MBC:microbial biomass carbon;MBN:microbial biomass nitrogen;qCO2: microbial Metabolic quotient;qMBC:ratio of MBC to TOC;qMBN:ratio of MBN to TN
2.3 土壤酶活性
4种土壤水解酶中,除Bxyl外,其余3种酶活性在总体季节变化中均呈现出夏季或冬季较高、秋季显著最低的动态变化(P<0.05)。秋季3个高程样带均处于淹水环境,2种氧化酶Phox和Pero秋季活性显著高于其他季节(P<0.05)。而在总体样带高程间,除Bglu外,其他3种水解酶活性在样带间都有S2>S1>S3的排序。另外,春季和冬季S2样带4种水解酶和2种氧化酶的活性均显著高于S1和S3(P<0.05)(图1)。

图1 土壤胞外酶活性Fig.1 Soil extracellular enzyme activities 大写字母表示样带内部季节间差异显著(P<0.05);小写字母表示同一季节样带间差异显著(P<0.05);由湖岸往湖心方向依次选取3个不同水位高程的样带依次编号为S1—S3
2.4 微生物活性与环境变量之间的关系
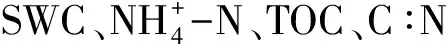
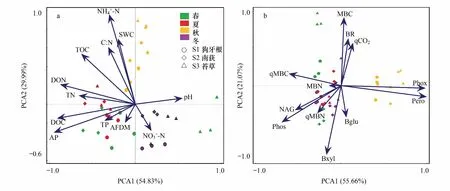
图2 土壤理化因子(a)及微生物活性特征(b)主成分分析Fig.2 Principal component analysis of soil environmental factors(a) and microbial activity characteristics(b)Bglu:β-葡萄糖苷酶,β-glucosidase;Bxyl:β-木糖苷酶,β-xylanase;NAG:N-乙酰氨基葡萄糖苷酶,N-acetylglucosaminidase;Phos:磷酸酶,phosphatase;Phox:酚氧化酶,phenoxidase;Pero:过氧化氢酶,peroxidase;BR:microbial basal respiration;MBC:microbial biomass carbon;MBN:microbial biomass nitrogen;qCO2: microbial Metabolic quotient;qMBC:ratio of MBC to TOC;qMBN:ratio of MBN to TN;SWC:soil water content;pH:pH value;AFDM:ash free dry mass;TOC:total organic carbon;TN:total nitrogen;TP:total phosphorus;C∶N:TOC/ TN
3 讨论
3.1 土壤理化因子对季节性水位变化的响应


表5 土壤微生物活性特征与理化因子相关性分析
*显著相关(P<0.05);**极显著相关(P<0.01);ns相关性不显著;样品总数n=36;Bglu:β-葡萄糖苷酶,β-glucosidase;Bxyl:β-木糖苷酶,β-xylanase;NAG:N-乙酰氨基葡萄糖苷酶,N-acetylglucosaminidase;Phos:磷酸酶,phosphatase;Phox:酚氧化酶,phenoxidase;Pero:过氧化氢酶,peroxidase
3.2 微生物活性特征对季节性水位变化的响应
土壤水分含量是影响MBC、MBN的显著因素[32]。秋季长时间的水淹降低了土壤微生物量,这也与万忠梅等人的结果相一致[13]。影响微生物活性的因素都可能会间接影响到基础呼吸的强度[33],春季干旱土壤受降雨作用再湿润后引起的“birch效应”也可能是春季呼吸作用增强的原因之一[34],夏季和秋季淹水不利于好养微生物的代谢使得BR相对较低,冬季低温和缺水条件也可以显著降低呼吸作用的进行[35]。由此可见过高和过低的水分都不利于土壤微生物的呼吸作用[20](表4)。qCO2将微生物可矿化碳和MBC结合在一起,当土壤受到胁迫时qCO2将变大,此时微生物需要付出更多的能量来抵御不良环境[20];本研究中经历了长时间干旱的春季和淹水胁迫的秋季qCO2都较高。秋季长时间淹水条件降低了3个样带的qMBC和 qMBN,表明长期淹水环境抑制了物质循环的速率(表4)。

表6 土壤理化因子与微生物活性特征方差分析
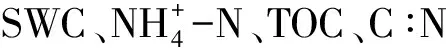
3.3 不同高程和植被对于土壤理化及微生物特征的影响
尽管本实验结果表明湿地土壤理化性质和微生物功能活性主要受到季节性水位变化的影响,但不同高程的样带间也存在一定的差异。而造成这种差异的根本原因同样是水位变化,鄱阳湖年内季节水位平均变幅超过10 m,本研究中3个样带天然高程差仅在2—3 m间,故而季节性水位波动的幅度大于样带高程差异。本实验中S2样带土壤表现出整体营养元素含量高于其他两个样带的规律,这与样带高程变化趋势不一致。吴建东[39]和谢东明[40]等人对蚌湖优势植被群落的研究也发现了相似的现象,可能原因为南荻群落地上生物量高于狗牙根和苔草群落,植物枯落分解后可为土壤提供更多的养分[41-42]。另外,鄱阳湖近年来枯水期提前、枯水时间延长,地势较高的样带水淹不足、水分缺乏且生境逐步趋于草甸化,这可能也是高程最高的S1样带枯水期土壤养分低于S2的原因之一[43]。PCA结果也表明淹水使得样带土壤理化和微生物趋于相同,而长期干旱则产生较大分异。
本研究中微生物活性特征在水位高程上都有S2样带活性高于S1和S3的现象。前人的研究结果也表明营养物的差异显著影响着微生物的活性[11,33]。湿地不同高程样带的营养物主要来源于地上植被分解与植物根系分泌,较高的凋落物和碳氮水平可刺激微生物的活动并激发分解纤维素、木质素等酶的活性[44];另外,养分的供应差别也影响着分泌酶的微生物的种类进而影响酶的活性[45],较高的酶活性也可以控制更多的养分释放和加快微生物的生长[37]。因此S2样带微生物特征活性较高可能是由土壤营养物质较丰富而引起的,表3相关性分析也进一步证明营养资源对微生物功能活性的显著影响。
4 结论
本实验的主要结论如下:
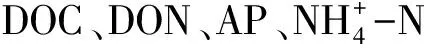
(2)不同高程样带间存在的水位差异和植被类型的不同,导致南荻样带中土壤营养元素含量和微生物活性显著高于狗牙根及苔草样带。