右美托咪定通过Toll样受体4减轻小鼠肺缺血/再灌注损伤
梁 磊,邓 林,谢 冕,郭 波
(重庆市中医院 麻醉科, 重庆 400020)
肺缺血/再灌注损伤 (lung ischemia/reperfusion injury, LIRI)是指短暂缺血肺组织在恢复血液再灌注后,功能代谢障碍及结构功能破坏加重的现象,是影响其移植术后早期功能恢复的关键性因素[1]。局部和全身的炎性反应是肺缺血/再灌注损伤的主要特征,其相关机制尚待进一步深入研究[2]。随着LIRI研究逐步发展到分子领域,从分子水平研究缺血/再灌注后损伤的病理生理机制,从而降低组织损伤,已成为当前的热点。
右美托咪定(dexmedetomidine, Dex)是高选择性ɑ2受体激动药,其在镇静、镇痛方面的研究已有诸多报道,对器官缺血/再灌注损伤有保护作用,但其作用机制尚未完全明确[3- 4]。进年来研究显示,Dex可作用多种固有模式识别受体(pattern recognition receptor, PRRs),实现对于缺血/再灌注损伤的保护,但是对于作用机制尚需进一步深入[5- 6]。本研究即深入探讨Dex是如何通过作用PRRs中的Toll样受体4(Toll-like receptor 4,TLR4),达到肺组织缺血/再灌注损伤的保护作用。
1 材料与方法
1.1 材料
1.1.1实验动物:7~8周龄,SPF级野生型 (WT) C57BL/6和TLR4基因敲除(TLR4-/-) C57BL/6雌性小鼠,体质量18~20 g[北京华阜康,No.11401300054426,饲养于重庆医科大学实验动物中心,SYXK(渝)2017-0023]。
1.1.2主要试剂:Dex注射液(2 mL∶200 μg,江苏恒瑞医药公司);T-per组织裂解液(Thermo Fisher公司);4%多聚甲醛(武汉博士德生物工程公司);SYBR Premix EXTaq RT-PCR 试剂盒(TaKaRa公司);RSDS-PAGE凝胶试剂盒、彩色蛋白分子预染Marker、Tublin抗体、HRP-羊抗小鼠和HRP-羊抗大鼠(碧云天生物技术公司);荧光定量PCR仪ICYCLERIQ和凝胶成像系统ChemiDoc XRS+(BIO-RAD公司);小鼠TNF-α、IL- 6和IL- β ELISA试剂盒(eBioscience公司);小鼠NLRP3一抗(RD公司)。
1.2 方法
1.2.1小鼠分组及处理:采用随机数字表法将小鼠分为4组(n=10):假手术组(S组)、肺缺血/再灌注组(I/R组)、0.9% NaCl溶液对照组(NS组)和Dex组(D组)。腹腔注射水合氯醛(4.5 mg/10 g)麻醉,行倒T型气管切开术,连接小动物呼吸机行机械通气。沿小鼠左胸骨2、3肋间打开胸腔,暴露左肺,找到肺门后用微型动脉夹夹闭30 min,然后松开动脉夹恢复灌注3 h。S组仅开胸不夹闭左肺门;D组和NS组于肺缺血前30 min时分别腹腔注射Dex 30 μg/kg和等体积0.9% NaCl溶液。
1.2.2肺组织HE染色:取小鼠肺组织,用0.9% NaCl溶液洗净,固定于4%多聚甲醛48 h后,制作石蜡切片,进行HE染色。
1.2.3RT-qPCR检测:取实验小鼠肺组织,用冰0.9% NaCl溶液洗净,放入含液氮的研钵中,磨至粉末,按每100 mg组织加入1 mL Trizol,对总RNA抽提纯化。将提取的RNA反转录为cDNA,配制20 μL RT-qPCR体系,设置PCR反应条件:95 ℃ 3 min; 95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸15 s,循环40次;熔解曲线测定,95 ℃变性15 s,60 ℃退火60 s。引物设计见表1。
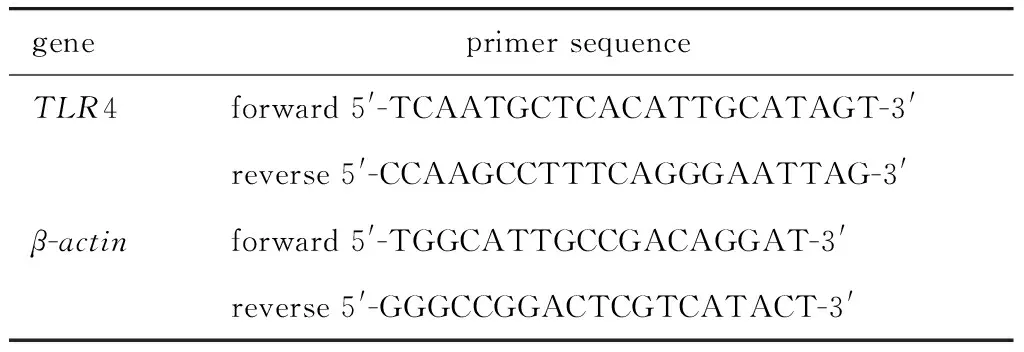
表1 各组基因引物序列Table 1 Primer sequences of amplication fragments
1.2.4肺组织裂解液的制备:配制组织蛋白裂解液,分别加入10%蛋白酶抑制剂和10%磷酸酶抑制剂。每一份组织加入400 μL左右冰浴的组织蛋白提取液,剪刀剪碎后加入无菌研磨瓷珠10粒,机械研磨均匀。4 ℃,12 000×g10 min,收集上清液,用于ELISA和蛋白免疫印迹检测。
1.2.5ELISA检测TNF-α、IL- 6和IL- 1β水平:采用双抗夹心法,按ELISA试剂盒说明书分别检测肺组织裂解液中TNF-α、IL- 6和IL- 1β的含量。使用多功能读数仪检测450 nm下吸光度值。根据吸光度值绘制标准品曲线,计算样品的实际浓度。
1.2.6Western blot检测NLRP3表达量:使用BCA法测定组织样品蛋白浓度,确定上样量为40 μg,配制12%下层胶和5%上层胶电泳,最后在凝胶成像仪上采集图片,用Image Lab软件分析。
1.3 统计学分析
2 结果
2.1 Dex减轻LIRI
与S组相比,I/R组肺间质水肿,中性粒细胞大量浸润,肺泡壁显著增厚,肺泡腔内出血明显。而Dex组较I/R组和NS组炎性细胞浸润减少,肺泡腔内出血和肺间质水肿得到明显改善(图1)。

图1 肺组织HE染色Fig 1 Lung morphology with HE staining(×20)
2.2 Dex抑制肺组织TLR4 mRNA的表达
与S组相比,I/R组TLR4 mRNA表达显著上调,说明缺血/再灌注可诱导肺组织TLR4基因的大量转录。但通过对比发现D组显著低于I/R组和NS组TLR4 mRNA水平(图2)。
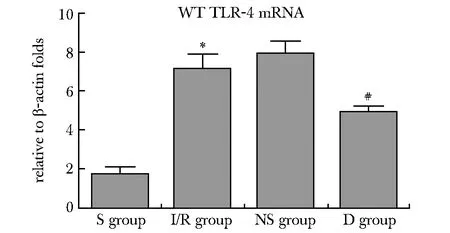
*P<0.01 compared with S group; #P<0.01 compared with I/R group图2 4组肺组织TLR4 mRNA的表达Fig 2 TLR4 mRNA in lung tissue of each group
2.3 Dex抑制WT小鼠肺组织前炎性因子的产生
在WT小鼠中,与S组相比,I/R组TNF-α和IL- 6水平显著上调,说明肺缺血/再灌注可诱导该部位组织产生大量前炎性因子。通过对比发现D组显著低于I/R组和NS组炎性因子水平(图3A,B)。然而,在TLR4-/-小鼠中发现,与S组相比,I/R组TNF-α和IL- 6显著上调,但D组与I/R组和NS组无差异(图3C,D)。
2.4 Dex抑制WT小鼠肺组织中NLRP3炎性小体产生
NLRP3做为NLRs蛋白家族成员,广泛表达于DCs和巨噬细胞,由NLRP3、ASC和无活性的caspase- 1前体组成的复合体称为NLRP3炎性小体[7]。本实验发现,与S组相比,I/R组NLRP3和IL- 1β表达显著上调,说明缺血/再灌注可诱导肺组织炎性小体的形成和活化。通过对比发现D组两者水平显著低于I/R组和NS组(图4)。
2.5 Dex对TLR4-/-小鼠肺组织中NLRP3产生无影响
Dex显著抑制肺组织TLR4转录和NLRP3炎性小体的形成和活化。有研究报道,NLRP3可通过TLR4产生,故本研究进一步观察Dex对于NLRP3的抑制是否通过TLR4介导[8]。使用TLR4-/-小鼠发现,与S组相比,I/R组NLRP3和IL- 1β表达显著上调,但D组与I/R组和NS组无明显差异(图5)。

WT andTLR4-/-C57BL/6 mice veceied LIRI surgery; the levels of TNF-α and IL-6 from lung tissue in WT mice(A and B) andTLR4-/-mice(C and D) were measured ELISA 3 hours after LIRI;*P<0.01 compared with S group;#P<0.01 compared with I/R group
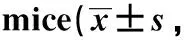

the levels of NLRP3 and IL- 1β(A and B) from lung tissue in WT mice were measured by WB and ELISA 3 hours after LIRI;*P<0.01 compared with S group;#P<0.01 compared with I/R group

3 讨论
LIRI常发生在肺移植、心肺联合移植、肺切除术、肺动脉血栓切除术、体外循环等临床工作中。其发生可造成肺组织功能代谢障碍及结构功能破坏,严重影响其移植术后早期功能恢复[9]。目前认为炎性反应是LIRI的主要机制之一, 炎性反应引起多种细胞因子及中性粒细胞所介导的肺毛细血管内皮细胞损伤等[10- 11]。
炎性因子的产生通常由固有免疫系统PRRs的活化激活相关信号通路,导致一系列免疫反应[12]。重要的PRRs有Toll样受体(Toll-like receptors, TLRs)和NOD样受体(NOD-like receptors, NLRs)。TLRs是一类天然免疫受体,可以识别某些病原体或其产物所共有的特定结构[13]。NLRs做为另一类重要的PRRs,参与识别宿主来源和微生物的损伤相关分子。NLRP3作为NLRs蛋白家族成员,广泛表达于固有免疫细胞和内皮细胞,由NLRP3、ASC和无活性的caspase- 1前体组成的复合体称为NLRP3炎性小体,是内源性或外源性危险信号的胞质内感受器,活化caspase- 1,调控IL- 1β和IL- 18等促炎细胞因子的成熟和分泌[14]。TLR4活化可诱导大量前炎性因子释放,尤其是TNF-α和IL- 6,最新研究证实其也可介导NLRP3炎性小体的形成和活化。
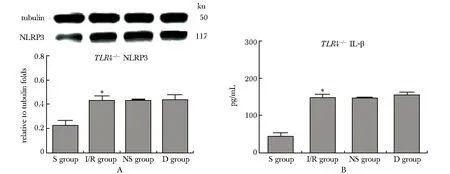
*P<0.01 compared with S group图5 TLR4-/-肺组织NLRP3和IL- 1β的表达水平Fig 5 NLRP3 and IL- 1β in TLR4-/- lung n=10)
Dex是高选择性ɑ2受体激动药,其在镇静、镇痛方面的研究已经有诸多的报道。本研究建立LIRI模型,使用WT和TLR4-/-小鼠,通过腹腔注射Dex研究其作用机制。本实验发现在WT小鼠中,Dex可减轻肺缺血/再灌注损伤,阻止肺组织中TLR4基因的转录,降低前炎性因子的产生,阻断NLRP3炎性小体的形成和活化。但是在TLR4-/-小鼠中发现Dex对于一系列炎性因子的产生没有影响。说明Dex依赖于TLR4阻断缺血/再灌注肺组织中前炎性因子的产生和NLRP3炎性小体的形成与活化,从而达到保护作用。
炎性反应对于LIRI损伤起重要作用,而炎性反应的产生主要通过PRRs[15]。已报道有多种TLRs受体活化参与该病理过程[6]。但是本研究证明Dex在缺血初期可显著抑制TLR4的转录,阻断了下游信号通路的传递,控制多种前炎性因子的释放与NLRP3炎性小体的产生,有效保护了肺组织。
综上表明,Dex在LIRI中通过降低TLR4表达,抑制炎性反应,减轻病理损伤,研究结果为临床应用提供了理论基础。

