营养风险筛查及个体化膳食干预改善阿尔茨海默病患者认知能力的临床观察
于楠楠,赵琛,唐家明,潘巍巍,玛黎清
(1.青岛大学附属青岛市市立医院干部保健科,青岛 266000;2.青岛大学附属医院麻醉科)
最新流行病学调查显示:全球痴呆症患病率高达2400万,预计到2050年将翻两番[1]。阿尔茨海默病(AD)是最常见的痴呆症[2]。AD的主要特征为逐渐加重的认知功能障碍及伴发的各类精神行为异常,AD的病因尚不十分清楚,但可能是遗传和环境因素共同作用的结果。AD患者常常伴有营养不良,与认知健康的人相比,痴呆患者更常见有体质量下降,体质量下降也被认为是痴呆症的显著临床特征[3-4]。营养是影响AD易感性的一个重要潜在因素,营养因素能通过多种途径来干预AD的发生和发展,在AD的发病过程中起着重要的作用。本研究应用营养风险筛查2002(NRS2002)方法[5],对AD患者进行营养筛查,并对有营养风险者给予个体化膳食干预,观察患者认知功能的改变,探索通过个体化膳食干预改善AD患者病情的方法。
1 对象与方法
1.1研究对象选取2015年1月至2017年9月在青岛市市立医院干部保健科住院治疗的122例AD患者,其中男性72例,女性50例;年龄(78.2±6.4)岁;发病年龄(71.5±5.9)岁。
1.2纳入与排除标准纳入标准:(1)采用美国精神病学会的精神障碍诊断和统计手册第四册修订版(DSM-IV)标准。首先采用简易精神状态量表(MMSE) 评分,与受教育程度有关,文盲<17分、小学<20分、中学以上<24分;然后对可疑痴呆患者进行详细的精神心理量表检查。包括Hachinski缺血指数量表(HIS)评分<4分;汉密尔顿抑郁量表评分≤7分。日常生活能力量表(ADL)>20分;(2)AD的诊断标准采用美国国立神经病学、语言障碍和卒中研究所-阿尔茨海默病及相关疾病协会(NINCDS-ADRDA)制定的临床诊断标准[6]。包括临床检查、医师检查记录、神经心理学测验和实验室检查。表现为起病隐匿,进展缓慢,病程并非数小时或数天,通常为数月至数年,并具有以遗忘为表现的认知功能障碍,病史及体格检查发现早期显著的认知障碍达到痴呆程度的核心标准,并且排除其他躯体疾病所导致[6]。排除标准:(1)有遗传家族史的患者。(2)有严重的抑郁症状(汉密尔顿抑郁量表评分>17分)、精神分裂症、双向障碍、精神发育迟缓者。(3)病史:突然发病;早期出现下列症状,如步态障碍,癫痫发作,行为改变,因头部外伤或中毒等致使产生认知功能障碍,脑炎或脑膜炎,恶性肿瘤病史;其他内科疾病,严重到足以引起记忆和认知障碍相关症状,如非AD痴呆、脑血管疾病、中毒和代谢异常。(4)合并恶性肿瘤、肝肾衰竭的患者。(5)依从性差、试验期间发生严重不良反应或其他意外事件等不能完成规律治疗的患者。
1.3研究方法
1.3.1一般资料搜集年龄、性别、文化程度、婚姻状况等。
1.3.2营养风险筛查122例患者均行欧洲肠外肠内营养学会(ESPEN)推荐使用的NRS2002方法评分,体质指数(BMI)计算公式为:BMI=体质量(kg)/身高(m)2。BMI<18.5 kg/m2,计3分,其中对不能站立、有严重水肿、胸腔积液和腹腔积液无法获得准确BMI者,采用血清清蛋白<30 g/L,计3分,总分评分≥3分表明患者有营养不良或有营养风险。
1.3.3营养支持方法采用随机、对照设计,存在营养风险者采用随机数字表,按 1∶1 的比例随机分为营养支持组和对照组,每组均为32例。两组均给予常规内科治疗。营养支持患者组结合患者具体进食情况计算需额外补充的热量,卧床患者按照理想体质量计算热量,估算公式为:男性理想体质量(kg)=身高(cm)-105;女性理想体质量(kg)=身高(cm)-110。按20~25 kcal/kg给予,电解质及维生素按生理需要量给予。在本院营养师指导下,给予自制匀浆膳或医用肠内营养液500~1000 mL,糖尿病患者应用糖尿病专用肠内营养制剂,强化膳食纤维,肠内营养的途径有口服和经鼻胃管输,其中不能口服者经鼻胃管输入。对照组除常规药物治疗外给予普通饮食,允许患者有部分口服营养来源。干预组患者均签署知情同意书,干预方法经青岛市市立医院伦理委员会批准。
1.3.4实验室指标分别于营养支持前、营养支持3个月后采集患者清晨空腹(>8 h)静脉血共10 mL,由我院检验科测定各项实验室指标,包括血清总蛋白(TP) 、血清清蛋白(ALB)、前清蛋白(PA)、总胆固醇(TC)、三酰甘油(TG)、血红蛋白(Hb)。
1.3.5认知功能评估方法分别于治疗前与治疗3个月后使用简易智能状态量表 (MMSE)和日常生活能力量表(ADL)进行认知功能测定。其中MMSE 评分包括7个方面的内容:时间定向力、地点定向力、即刻记忆力、延迟记忆力、注意和计算力、语言能力和视空间觉,量表总分范围0~30分[7]。轻度认知功能障碍:MMSE 评分>20 分;中度认知功能障碍:MMSE 评分 15~20分;重度认知功能障碍:MMSE 评分<15分。测验成绩和文化水平有关,正常划界值为文盲≥17分,小学≥20分,初中及以上≥24分。ADL评分包括10个项目,主要对患者进餐、洗澡、修饰、穿衣、控制大便、控制小便、如厕、床椅转移、行走、上下楼梯等日常生活情况进行评分。总分范围:0~100分。100分为日常生活完全独立,不需要依赖他人,>60分且<100分为轻度依赖,41~60分为中度依赖,20~40分为重度依赖,<20分为完全依赖[7]。

2 结果
2.1营养风险评估所有122例研究对象中有64例患者在入院时存在营养不良或营养风险,总发生比例为52.5% (64/122) 。随着年龄的增长、文化程度的降低,营养不良风险性增大(P<0.05)。营养不良的风险性在性别、婚姻状况方面差异无统计学意义(P>0.05)。见表1。
2.2日常生活能力、认知功能与AD患者营养状况的关系随着日常生活能力的降低,营养不良及危险的发生率显著升高(χ2=6.931,P=0.031)。认知功能正常者营养不良及危险发生率,与认知功能障碍者,差异有统计学意义(χ2=7.448,P=0.024)。见表2。
2.3两组治疗前后各项实验室指标的比较两组受试者治疗前实验室指标TP、ALB、PA、TC、TG、Hb比较,差异无统计学意义(P>0.05),具有可比性。治疗3个月后,对照组治疗后与治疗前比较,各指标无明显变化(P>0.05),而营养支持组各指标治疗后与治疗前比较均有显著改变,差异有统计学意义(P<0.05)。治疗3个月后,营养支持组各指标较对照组均有显著改变,差异有统计学意义(P<0.05)。见表3。

表1 122例阿尔茨海默病患者经不同分类后营养风险比较(例)

表2 122例阿尔茨海默病患者经不同分类后营养状况比较(例)
2.4两组治疗前后认知功能比较营养支持组治疗后MMSE评分、ADL评分均较治疗前提高,差异有统计学意义(P<0.05)。对照组治疗前后MMSE评分、ADL评分差异无统计学意义(P>0.05)。见表4。
3 讨论
AD是一种神经系统退行性疾病,呈进行性发展,AD早期干预不仅能减慢疾病的进展,还可以提高患者的生存质量,减轻患者家庭及整个社会负担,具有非常重要的临床意义。痴呆患者易出现体质量减轻[8-9],其机制目前尚不十分明确,受多诸因素影响。有研究发现,特定大脑区域的神经退行性变、遗传因素和炎症过程与AD患者营养状态的改变存在相关性。痴呆相关脑萎缩可能涉及影响食欲、进食的大脑功能区域,内侧颞叶萎缩与低体质指数有关[10]。此外,嗅觉系统的病理变化可能发生在AD认知衰退发作的几年前,可导致营养摄入减少及体质量下降[11]。体质量下降意味着肌肉质量的损失,伴随着全身功能衰退和虚弱,并能增加AD患者的死亡率[12-14]。体质量减轻可以作为一个独立的AD患者死亡预测指标[15]。营养是影响 AD 易感性的一个重要潜在因素,多个研究已经证明体质量减轻[9]和营养不良[16]与疾病进展和认知衰退有关。营养不良是影响患者生活质量和增加病死率的重要因素[17]。深入研究营养因素与AD的关系,对AD患者的治疗具有重要意义。
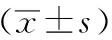
表3 两组治疗前后各项实验室指标的比较
注:TP为血清总蛋白;ALB为血清清蛋白;PA为前清蛋白;TC为总胆固醇;TG为三酰甘油;Hb为血红蛋白

表4 两组治疗前后认知功能比较分)
注:MMSE为简易精神状态量表,ADL为日常生活能力量表
国外最近的一项研究显示,在社区居住的85岁以上的居民中,大约有34.5%的社区居民存在营养风险[18]。Allen等[19]调查发现,营养不良是AD患者最普遍的营养状态。我国很多老人也存在营养不良,我国老年痴呆患者中营养不良及危险的发生率大约为65%[20]。在本次研究中,AD患者营养不良及危险的发生率为52.5%,该比例低于既往研究人群,这可能与本次入组患者均来自干部病房,其经济条件、日常护理水平较高有关。在本研究中,AD患者发生营养不良的危险性与年龄的增长、文化程度的降低有显著相关性。随着年龄的增长,AD 患者营养不良及危险的发生率明显增加,文化水平越高的AD患者,获取营养知识的途径越多,对自身营养状况越关注,营养补充更丰富,营养不良及危险的发生率明显降低。
AD患者是发生营养不良的高风险人群。目前有研究表明,充足、优质的饮食营养干预可改善AD患者认知功能[21]。本研究发现,在常规内科治疗基础上增加个体化营养支持治疗3个月后,测得MMSE、ADL 评分升高,患者认知功能开始出现改善趋势,提示通过营养干预治疗能改善 AD 患者的认知功能。同时,患者血TP、ALB、PA、Hb、TC、TG水平亦有明显改善。营养作为影响AD的潜在因素,可以作为药物治疗靶点进一步研究。而在临床治疗中,在 AD患者入院后应尽早应用营养筛查工具对其进行营养评估,在认知功能衰退的早期对存在营养不良或营养风险的AD患者给予个体化营养支持治疗,打破营养不良和认知能力下降的恶性循环,减慢疾病进展,改善AD患者的临床预后,提高患者生存质量。

