四倍体果桑嘉陵30号再生植株的研究*
植 爽 任艳红 唐 星 徐凤翔 王茜龄 赵爱春
(西南大学生物技术学院,重庆 400715)
传统蚕桑产业是以栽桑叶养蚕为主要目的,桑树不结桑果或者果粒小而少。随着蚕桑产业的转型升级,转变发展观念,主动融入大农业,立桑为业,多元发展,建立现代蚕桑产业体系将是蚕桑产业转型升级的方向。自古以来,干桑椹都列入了中药材,桑果又以其独特的口味和丰富的营养成为一种新兴的水果品种和保健品[1-2],且果桑具有观光价值和采摘乐趣,因此果桑产业呈现出良好的发展势头,生产上对果桑品种的需求日益强烈。嘉陵30号(MorusatropupureaRoxb.)是2009年通过多倍体育种育成的四倍体果桑品种,果粒大、叶片厚,且属于果叶兼用型,并通过重庆市蚕桑品种审定委员会审定[3],目前正以嫁接的繁殖方式在全国推广。但嫁接繁殖存在繁殖系数低,受季节影响大,容易传染病害,优良种质难以延续等缺点,很大程度上限制了优良果桑的推广和利用。而建立嘉陵30号的快速繁殖体系,可以克服上述嫁接繁殖缺点,不受季节影响,繁殖速度快,保持品种优良特性,对工厂化育苗,加快优良品种的繁殖推广具有重要意义。因此本研究以嘉陵30号的春芽和冬芽为外植体,建立嘉陵30号的快速繁殖体系。
桑树为多年生木本植物,离体再生较为困难,主要表现在污染严重、易褐化、不增殖、不分化、不生根等[4]。不同桑种质材料对植物激素的敏感性以及植株的再生能力存在很大的差异[5]。冬芽是桑树组织培养较为理想的外植体,易消毒,操作方便,但冬芽休眠,取材时间短,且内生菌丰富,而春芽带菌少生长快。因此本研究拟通过以四倍体果桑品种嘉陵30号春芽和冬芽为外植体建立高频再生体系,有利于桑资源的合理利用,为快速繁殖优良果桑,丰富果桑种质资源,分子改良果桑品种奠定基础。
1 材料与方法
1.1 材料
嘉陵30号是西南大学育成的四倍体果桑品种,于2009年通过重庆市品种审定委员会审定;2016年4月中旬晴天采集取健康无病虫害的嘉陵30号萌发的春芽为外植体。2016年12月中旬,选取健康无病虫害的嘉陵30号一年生枝条上的冬芽为外植体。
1.2 春芽组织培养
将桑树春芽先用洗洁精浸泡3min,自来水冲洗1h,75%乙醇消毒30s,无菌水洗6次,0.1% HgCl2处理9min,无菌水洗6次。切去基部,接种至培养基。培养基成分为MS+3.0mg/L 6-BA+0.2 mg/L NAA+0.6g/L MES +7g/L琼脂+30g/L蔗糖,pH 5.8,在培养基中加入不同浓度氨苄青霉素钠(Amp,Ampicillin sodium salt)和多菌灵(Car,Carbendazim),暗处理3d后移至光照强度为8000Lx,14 h/d, 温度25 ±2℃下培养。
1.3 冬芽解除休眠
将嘉陵30号一年生枝条随机分为4组,分别用以下4种方式解除休眠:①4℃下冷藏5 d后常温下0.5mg/L GA3溶液浸5d;②4℃下冷藏10d;③常温 GA30.5mg/L 浸10d;④30℃下去离子H2O浸10d。
1.4 冬芽消毒
嘉陵30号0.1% HgCl2消毒时间分别为5min、8min、10min、12min、15min、20min,对照为0.1% HgCl2消毒10min。桑冬芽解除休眠后,剥去外面2-4层带有褐色的鳞片,洗洁精浸泡3min,自来水冲洗15min,75%乙醇消毒30s,无菌水洗6次,0.1% HgCl2中滴加2滴吐温80处理,无菌水洗6次。再剥至剩约3层鳞片,接种在培养基中萌发。培养基同春芽培养基。以上实验中,每个处理接6瓶,每瓶接5个,共30个冬芽。
1.5 继代增殖培养
嘉陵30号冬芽萌发获得无根苗和不定芽后,在无菌条件下把茎段切成一节一叶,顶芽带1-2片叶子,接种在增殖培养基中,另外切下不定芽直接接种在增殖培养基中。根据前人研究结果[6],稍加修改,嘉陵30号增殖培养基为(1)MS+3.0mg/L 6-BA+0.2mg/L NAA+0.6g/L MES +7g/L琼脂+30g/L蔗糖,pH5.8;(2)MS+3.0mg/L KT+0.2mg/L NAA+0.6g/L MES +7g/L琼脂+30g/L蔗糖,pH5.8。每瓶5个茎段,共5瓶。30d后观察生长情况,并统计增殖系数。
1.6 不定根的诱导及移栽
选取嘉陵30号生长健壮的幼苗,分别接种于生根培养基如表1 A-D进行生长素种类的筛选,30d后观察生根情况并统计生根率。根据筛选的最适生长素种类再进行浓度筛选,培养基如表1E-H,25d后观察生根情况并统计生根率。生根实验中,每瓶接4株,每个重复4瓶,培养基中附加琼脂7g/L,蔗糖30g/L,pH 5.8。待生根以后将组培瓶从温室移出至自然条件下开盖放置3d进行驯化移栽。流水洗净植株培养基后,浸泡于浓度为0.1%(w/v)的多菌灵中3min后移栽至营养土中(腐殖质与土3∶1),20d后观察其生长情况。
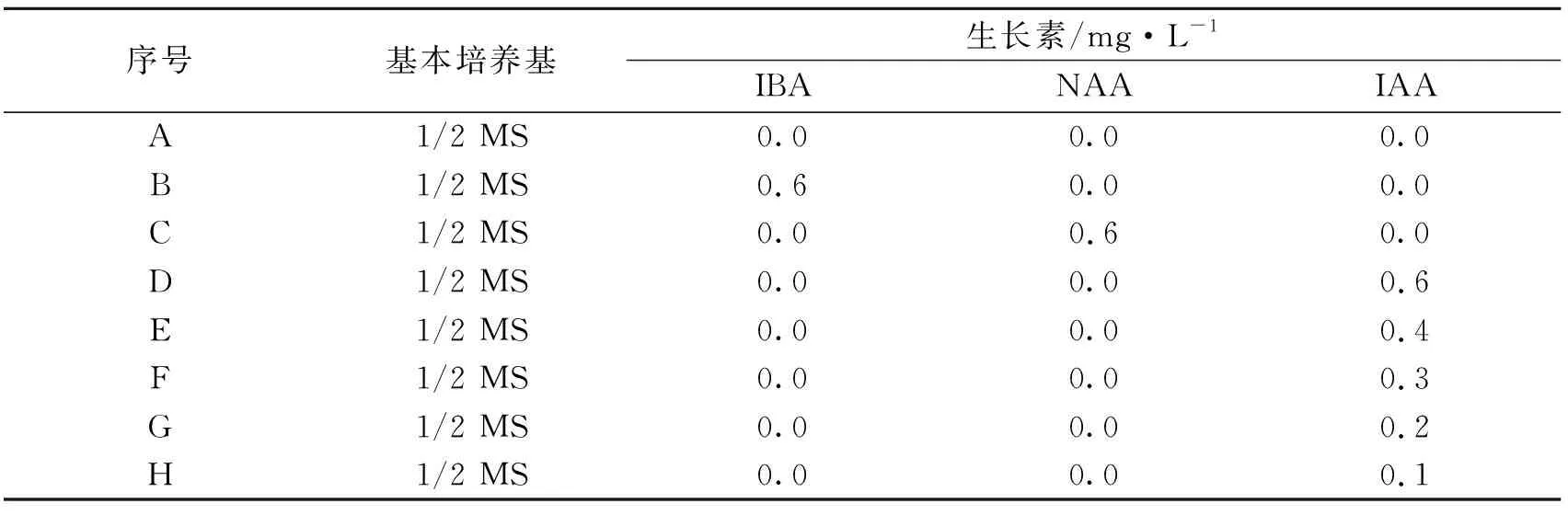
表1 嘉陵30号不定根的诱导培养基
2 结果与分析
2.1 桑春芽组织培养
嘉陵30号春芽接种第3d未见污染,此后在芽的基部逐渐出现污染。接种第7d,如表2,嘉陵30号出现大量污染,污染率为73.33%,在培养基中添加Amp能有效控制污染,但与此同时也会抑制春芽的萌发。多菌灵控制污染效果不显著。接种14d时,未添加抗生素时嘉陵30号污染率高达96.67%,添加100mg/L Amp或者Car虽能控制污染,但污染率仍然较高,且部分芽体褐化死亡(图1)。第20d,各处理中嘉陵30号污染率均达到100%。表明,以嘉陵30号萌发春芽为外植体污染严重,抗生素只能短期控制污染,因此不能以春芽进行离体快速繁殖。
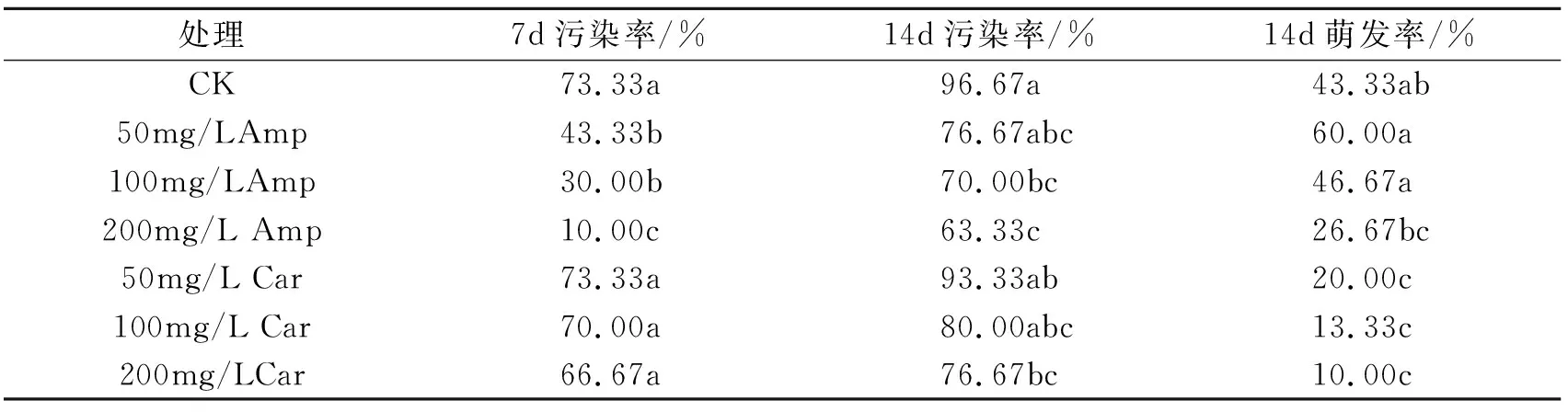
表2 Amp和 Car对嘉陵30号春芽组织培养的影响
注:同列不同小写字母表示差异显著( P<0. 05),下同。

图1 嘉陵30号春芽培养14d生长情况
2.2 不同催芽方式对冬芽萌动的影响
以桑冬芽为外植体,催芽10d后,状态如表3所述,直接用0.5mg/L GA3处理10d的冬芽伸展快,膨大,能明显看见绿色鳞片,4℃处理5d后GA30.5mg/L处理5d和常温下ddH2O处理效果次之,芽略微膨大,剥2-3层鳞片后能见绿色鳞片。只用低温4℃下处理的冬芽变化不明显,多层鳞片仍为褐色。将冬芽接种在萌发培养基中无菌培养14d后观察冬芽萌动状态如图2所示。4℃处理5d后GA30.5mg/L处理5d效果最好,生长速度最快,形态最好,新叶长出最多;去离子水H2O处理10d效果次之,生长较快,鳞片卷曲; 常温下GA30.5mg/L处理10d虽然催芽效果好,但对于后期无菌培养时生长缓慢,萌芽数较少,个别芽褐化死亡,且后期逐渐出现玻璃化。综上,4℃处理5d后GA30.5mg/L处理5d适合桑冬芽解除休眠。嘉陵30号培养30d生长情况如图3所示,冬芽萌发后直接长成幼苗。

A.4℃下冷藏5 d后0.5mg/L GA3 溶液浸5d;B.4℃下冷藏10d; C.常温 GA3 0.5mg/L浸10d; D.30℃下去离子水H2O浸 10d

图3 嘉陵30号的冬芽初代培养

处理方式发芽状态生长速度A冬芽略微膨大,剥2-3层鳞片后能见绿色鳞片生长最快,脱苞芽最多,长出新叶最多,形态最好B冬芽变化不明显,多层鳞片仍为褐色生长较慢,脱苞芽较少,部分长出绿色叶片,形态较差C冬芽膨大,长出绿色鳞片生长缓慢,萌芽数最少,形态最差,稍有褐化现象D冬芽略微膨大,剥2-3层鳞片后能见绿色鳞片生长较快,脱苞芽较多,有绿色叶片长出,较小,鳞片卷曲,形态较好
2.2 桑冬芽污染控制
嘉陵30号桑冬芽接种10d后,其污染及萌动状况如表4所示,0.1% HgCl2不同消毒时间处理外植体的效果存在差异。消毒5-10min,污染率均为100%,芽体四周菌生长旺盛,芽死亡较多,因此导致萌发率较低。HgCl2处理时间在12-20min时,HgCl2浸泡时间越长,冬芽污染率越低,但HgCl2消毒20min时,部分冬芽死亡,其萌发率明显降低,仅为16.67%。综合考虑,以0.1% HgCl2消毒时间15min为最佳,其污染率和萌发率均为60%。在培养基中添加300mg/ml Cef后,其污染率明显降低,芽萌发率也略微降低。
2.3 增殖培养
将嘉陵30号冬芽萌发的无根苗切下带一个腋芽的茎段接种在含细胞分裂素6-BA的培养基中增殖培养30d,无根苗长势好,茎粗,节间短。经统计,嘉陵30号的茎段继代增殖系数为6.84(表5,图4B);在含有细胞分裂素KT的培养基中增殖时,植株细长,节间距大,嘉陵30号的增殖系数为4.24(表5,图4A);以嘉陵30号冬芽萌发以后的不定芽增殖培养,幼苗健壮,增殖系数为7.03(表5,图4C)。

表4 消毒时间和Cef对冬芽染菌和萌发的影响

表5 嘉陵30号的茎段增殖

表6 嘉陵30号的不定芽增殖

A.茎段在KT培养基上增殖;B.茎段在6-BA培养基上增殖;C.丛生芽在6-BA号培养基上的诱导 图4 嘉陵30号冬芽的继代培养
2.4 生根
为探究适合嘉陵30号生根的培养基,以1/2MS培养基为对照,比较NAA、IBA和IAA对其生根的影响,结果如图5和表7所示,1/2MS培养基上根系较少,生长素IAA能促进嘉陵30号不定芽生根,愈伤组织少,根系较多,生根率为43.75%。生长素NAA诱导无根苗切口处形成愈伤组织,根系较少。生长素IBA最差,幼苗切口处形成大量的黄褐色愈伤组织,生长受抑制,严重发黄致死,生根率低且根系短。对照(无生长素),幼苗叶片更绿。结果显示IAA能促进根系诱导。因此为进一步优化嘉陵30号幼苗生根的培养基,降低IAA浓度至0.1-0.4mg/L,筛选最适IAA浓度。分别将幼苗接种培养25d以后。结果如图6和表8可知,IAA浓度为0.1mg/L和0.2mg/L时,幼苗生长状况相似,叶片绿色,健壮,根系发达。IAA浓度为0.3mg/L和0.4mg/L时,幼苗长势相似,略微发黄。IAA浓度为0.2mg/L时生根率最高,主根最长,须根最多;IAA浓度为0.1次之,而IAA浓度为0.4mg/L时,幼苗最为矮小,即1/2MS+0.2mg/L IAA为嘉陵30号的最适生根培养基。

A.1/2MS B.1/2MS+IBA C. 1/2MS+NAA D. 1/2MS+IAA

培养基类型生根率/%总主根数生长情况1/2MS37.50ab14b+++1/2MS+IBA0.06c4bc+1/2MS+NAA25.00bc12bc++1/2MS+IAA43.75a37a++
注:+++表示植株葱绿,形态好;++表示植株略微发黄;+表示植株矮小,叶片较黄。下同。

A.0.1mg/L IAA B. 0.2 mg/L IAA C. 0.3 mg/L IAA D. 0.4 mg/L IAA

IAA浓度(mg/L)主根总数生根率/%平均根长/cm生长情况0.148a75.00a1.26b+++0.255a87.50a1.63a+++0.364a81.25a0.87c++0.467a75.00a0.71c+

图7 嘉陵30号移栽后生长情况
2.5 炼苗与移栽
嘉陵30号移栽20d(图7)存活率均为100%,长势良好,平均株高为5.07cm。
3 讨论
谭志一等(1985)研究认为GA3能促进毛白杨(PopulustomentosaCarrière)的冬芽解除休眠[7]。本次试验表明,低温4℃下处理10d的冬芽变化不明显,这与八寻正树和罗国庆的研究结果一致,他们认为,进入最深休眠期的枝条,需冷藏15d后才能解除休眠。GA3促进桑树冬芽休眠解除,高温(30℃)下10d能解除休眠[8],因此30℃下GA3处理10d最适桑冬芽解除休眠。王海波等研究认为45℃和50℃高温分别处理对油桃(Prunuspersicavar.nectarina)芽自然休眠呈正调控效应,推测对于解除桑冬芽休眠,还可以提高温度促进休眠解除[9]。在培养过程发现,低温(4℃)冷藏5d以后再用赤霉素GA3处理5d的冬芽生长速度更快,形态更好,新叶长出更多,30℃下GA3处理10d的冬芽产生褐化且伴有玻璃化现象,这可能是低温能促进冬芽的生长,也可能是赤霉素处理时间过长,导致了冬芽细胞的过度生长[10]。
桑树是多年生木本植物,杂菌多,外植体表面不光滑,含有内生菌,消毒困难,污染率高。常采用灭菌方式是自来水下冲洗15-20min,在超净工作台上用75%乙醇振荡消毒15s,倒去乙醇后随即加入0.1% HgCl2消毒5-15min[11-13]。果桑嘉陵30号芽内生菌污染严重,冬芽比春芽能能耐受HgCl2消毒,0.1%HgCl2消毒15min可以用于嘉陵30号冬芽离体再生,但污染率仍然很高,0.1% HgCl2不能除掉内生菌,需要结合抗生素才能有效控制污染,在培养基中加入300mg/ml Cef后,能有效控制污染。而春芽消毒时,抗生素Amp和杀菌剂Car对嘉陵30号污染控制没有效果。秦宇等研究了不同抗生素对南方红豆杉(TaxusmaireiSYHu)内生菌抑制研究,认为抗生素能有效抑制组织材料中内生菌,并且不同抗生素对内生菌抑制效果不一致[14]。因此嘉陵30号污染除了内生细菌外还存在内生真菌,需要进一步研究真菌类抗生素对嘉陵30号污染控制的影响。
桑树组织培养过程中器官发生受材料,生长激素,培养条件等诸多因素的影响,桑树在合适的条件下可以通过直接器官发生途径或间接器官发生途径进行再生[15]。本次实验发现嘉陵30号再生过程中不产生愈伤组织,属于典型的直接器官发生途径再生。Chattopadhyay曾报道三倍体桑相比二倍体桑树的生根需要更多激素[16],四倍体的嘉陵30号需要添加一定的生长素才能较好地生根,不同生长素效应不同,其中以IAA最好,NAA次之,IBA最差。高浓度的IAA虽能诱导出大量的不定根,但抑制了根的伸长。但在前人研究研究中,桑树生根培养最常用的生长素为IBA,NAA次之[17-19]。较少报道IAA诱导桑树生根。推测可能因为四倍体果桑嘉陵30号是通过杂交育种与人工诱导多倍体相结合育成的,基因型复杂的遗传特异性所致。
4 结论
本研究成功建立了嘉陵30号桑的快繁体系,四倍体果桑嘉陵30号内生菌污染严重,春芽不适合作外植体,冬芽可通过低温和赤霉素结合解除休眠以后作为外植体,培养基加入300 mg/L Cef可有效控制污染,激素6-BA比KT更适合嘉陵30号的增殖培养,生长素IAA能有效促进生根,其再生途径属于直接器官发生途径,经过驯化移栽至土后,嘉陵30号存活率高达100%。

