KLF5在脱氧胆酸诱导胃黏膜肠上皮化生中的作用*
孙杰,付立芳
(1.山东医学高等专科学校 中医学教研室 山东 临沂 276000;2.山东省临沂市中医医院 呼吸内科,山东 临沂 276002)
胃癌的发生、发展是一个渐进过程,从正常胃黏膜、肠上皮化生、异型增生向胃癌的发生、发展进程中有多种基因的参与[1]。含有胆汁酸的胃十二指肠反流引起的胃黏膜慢性炎症,进而发生胃黏膜肠上皮化生[2]。目前有研究表明,Krüppel样因子5(Krüppellike factor 5,KLF5)在慢性胃炎和肠上皮化生的表达与正常对照组相比,呈上升趋势[3-4]。因此,本文通过脱氧胆酸(deoxycholic acid,DCA)诱导胃黏膜上皮细胞,探究KLF5是否参与DCA诱导的肠上皮化生的发生及其可能的作用机制。
1 材料与方法
1.1 材料与试剂
胃黏膜上皮细胞GES-1(中国科学院上海细胞库)。选取山东省临沂市中医医院2012~2015年的56例胃黏膜标本,其中30例正常胃黏膜,26例肠上皮化生。本研究经本院医学伦理委员会批准,并与患者签署知情同意书。鼠抗KLF5、TFF2、VIL1、CDX2、Wnt3a、β-catenin、多克隆抗体、β-actin鼠抗单克隆抗体、羊抗鼠二抗(HRP)购自英国Abcam公司,MTT、二甲基亚砜、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒、Annexin V-FITC/PI凋亡试剂盒购自上海碧云天生物技术有限公司,流式细胞仪(美国BD公司)。
1.2 方法
1.2.1正常胃黏膜和肠上皮化生组织的选取正常胃黏膜30例,其中,男性13例,女性17例;肠上皮化生26例,其中,男性16例,女性10例。以上组织均置于-80℃中保存,用于提取蛋白和mRNA。
1.2.2胃黏膜上皮细胞的培养和转染GES-1细胞在含10%胎牛血清、100μ/ml青霉素、100μg/ml链霉素的RPMI 1640培养基中培养,置于37℃、5%二氧化碳CO2孵箱中生长。将细胞分为两组,应用1 mol/L氯化氢调定培养基pH值至7.2,采用不同浓度(100、200和500μmol/L)的DCA处理细胞12 h,置于37℃、5% CO2孵箱中孵育。空白对照组为不含DCA的RPMI 1640培养液,继续培养12 h。
1.2.3细胞转染将GES-1细胞分为空白对照组、DCA组、阴性对照组及KLF5沉默组。细胞长至50%~60%密度时,分别将KLF5 siRNA和阴性序列对照按50 nmol/L浓度转染GES-1细胞,24 h后更换为不含双抗的RPMI 1640培养液,并加入500μmol/L DCA或者溶剂对照(Veh)处理细胞,置于37℃、5%CO2培养箱中继续培养24 h,观察细胞感染情况。用Western blot检测验证KLF5沉默的效率。
1.2.4MTT法MTT法检测细胞增殖。按分组收集转染48 h后的GES-1细胞,磷酸盐缓冲溶液(phosphate buffer saline,PBS)清洗后加入MTT,37℃温育4 h,加入二甲基亚砜150μl/孔,将培养板置于微孔板振荡器上振荡10 min,使结晶物溶解,用酶标仪在570 nm处测吸光度值。
1.2.5流式细胞术按分组收集转染48 h后的GES-1细胞,PBS清洗,参照Annexin V-FITC/PI凋亡检测试剂盒说明书,在流式细胞仪上检测细胞凋亡。
1.2.6Western blot检测分别取正常胃黏膜、肠上皮化生组织,以及DCA处理GES-1细胞样品,提取总蛋白。采用BCA法测定蛋白浓度,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳、转膜,5%脱脂奶粉封闭,4℃条件下用抗KLF5、Wnt3a和β-actin(均为1∶300)的一抗孵育过夜,PBST洗膜3次,二抗室温孵育1 h,PBST洗膜3次,最后用增强化学发光法发光液在暗室曝光并压片。将GES-1细胞分为空白对照组、DCA组、阴性对照组及KLF5沉默组,按分组收集转染48 h后的GES-1细胞,按照上述方法检测TFF2、VIL1和CDX2蛋白的表达。将GES-1细胞分为空白对照组、DCA组、阴性对照组、KLF5沉默组、氯化锂LiCl(Wnt通路激活剂)组及LiCl+KLF5沉默组,按分组收集转染48 h后的GES-1细胞,按照上述方法检测Wnt3a、β-catenin和CDX2蛋白的表达。
1.2.7实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)分别取正常胃黏膜、肠上皮化生组织,以及DCA处理GES-1细胞样品。采用Trizol法分别提取总RNA,并检测其纯度及完整性。按照逆转录试剂盒说明书生成cDNA,扩增cDNA,基因扩增成功后,采用2-△△Ct法,对KLF5和Wnt3a的含量进行分析。将GES-1细胞分为空白对照组、DCA组、阴性对照组及KLF5沉默组,按分组收集转染48 h后的GES-1细胞,按照上述方法检测TFF2、VIL1和CDX2 mRNA的表达。将GES-1细胞分为空白对照组、DCA组、阴性对照组、KLF5沉默组、LiCl组及LiCl+KLF5沉默组,按分组收集转染48 h后的GES-1细胞,按照上述方法检测Wnt3a、β-catenin和CDX2 mRNA的表达。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验或单因素方差分析,两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 KLF5和Wnt3a在肠上皮化生组织中异常表达
2.1.1KLF5和Wnt3a蛋白肠上皮化生组织中KLF5和Wnt3a蛋白相对表达量分别为(2.37±0.06)和(2.32±0.07);正常胃黏膜中KLF5和Wnt3a蛋白相对表达量分别为(1.02±0.08)和(1.00±0.07)。两组KLF5和Wnt3a蛋白表达水平比较,经t检验,差异有统计学意义(t=80.350和98.002,均P=0.000),肠上皮化生组织中KLF5和Wnt3a蛋白表达升高。见图1。

图1 正常胃黏膜和肠上皮化生组织中KLF5、Wnt3a蛋白的表达(±s)
2.1.2KLF5和Wnt3a mRNA肠上皮化生组织中KLF5和Wnt3a mRNA相对表达量分别为(2.14±0.06)和(2.22±0.07);正常胃黏膜中KLF5和Wnt3a mRNA相对表达量分别为(1.00±0.06)和(1.00±0.08)。两组KLF5和Wnt3a mRNA表达水平比较,经t检验,差异有统计学意义(t=70.910和70.817,均P=0.000),肠上皮化生组织中KLF5和Wnt3a mRNA表达升高。见图2。
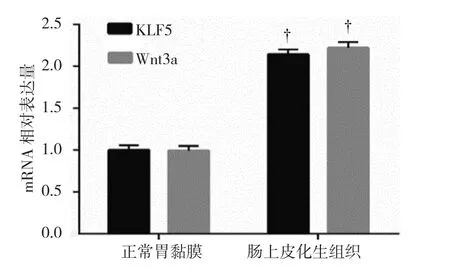
图2 正常胃黏膜和肠上皮化生组织中KLF5和Wnt3a mRNA表达水平比较(±s)
2.2 DCA诱导GES-1细胞中KLF5和Wnt3a的表达
2.2.1KLF5和Wnt3a蛋白100、200和500μmol/L DCA组,以及空白对照组的KLF5蛋白相对表达量分别 为(1.26±0.07)、(1.63±0.06)、(2.47±0.06) 和(1.00±0.06);100、200和 500μmol/L DCA 组,以及空白对照组的Wnt3a蛋白相对表达量分别为(1.20±0.07)、(1.59±0.09)、(2.34±0.08)和(1.00±0.07)。各组细胞中KLF5和Wnt3a蛋白表达水平比较,经方差分析,差异有统计学意义(F=268.043和143.273,均P=0.000),随着DCA浓度增加,GES-1细胞中KLF5和Wnt3a的表达水平逐渐升高。见图3。
2.2.2KLF5和 Wnt3a mRNA100、200和 500μmol/L DCA组,以及空白对照组的KLF5 mRNA相对表达量分别为(1.24±0.08)、(1.74±0.06)、(2.21±0.06)和(1.00±0.05);100、200 和 500μmol/L DCA 组,以及空白对照组的Wnt3a mRNA相对表达量分别为(1.20±0.05)、(1.73±0.08)、(2.28±0.07)和(1.00±0.06)。各组细胞中KLF5和Wnt3a mRNA表达水平比较,经方差分析,差异有统计学意义(F=179.614和209.881,均P=0.000),KLF5和Wnt3a mRNA表达水平呈剂量依赖效应。KLF5和Wnt通路可能在胃黏膜肠上皮化生中发挥重要作用。见图4。

图3 不同浓度DCA对GES-1细胞中KLF5和Wnt3a蛋白表达的影响(±s)

图4 不同浓度DCA对GES-1细胞中KLF5和Wnt3a mRNA 表达的影响(±s)
2.3 KLF5沉默抑制DCA诱导的GES-1细胞增殖并促进凋亡
2.3.1KLF5蛋白空白对照组、DCA组、阴性对照组、KLF5沉默组的KLF5蛋白相对表达量分别为(1.00±0.06)、(2.45±0.08)、(2.36±0.06)和(0.11±0.06),经方差分析,差异有统计学意义(F=822.422,P=0.000),si-KLF5转染后,细胞中KLF5蛋白表达降低。见图5。
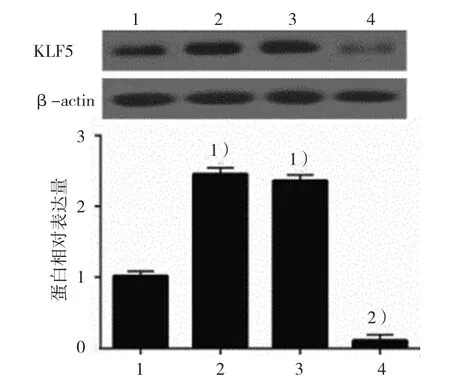
图5 各组GES-1细胞中KLF5蛋白的表达(±s)
2.3.2增殖率空白对照组、DCA组、阴性对照组、KLF5沉默组GES-1细胞增殖率分别为(100.00±3.46)%、(125.00±3.60)%、(123.00±3.60)% 和(102.00±4.58)%,经方差分析,差异有统计学意义(F=36.136,P=0.000),DCA促进GES-1细胞增殖,而将KLF5沉默后,DCA的促增殖作用被抑制。见图6。

图6 各组GES-1细胞增殖率比较(±s)
2.3.3凋亡率空白对照组、DCA组、阴性对照组、KLF5沉默组GES-1细胞凋亡率分别为(18.70±0.72)%、(10.30±0.70)%、(9.80±0.79)%和(17.80±0.79)%,经方差分析,差异有统计学意义(F=119.419,P=0.000),DCA 抑制GES-1细胞凋亡,而KLF5沉默后,DCA的抑制凋亡作用被抑制。DCA可能通过KLF5影响GES-1细胞的增殖和凋亡。见图 7、8。

图7 各组GES-1细胞凋亡情况
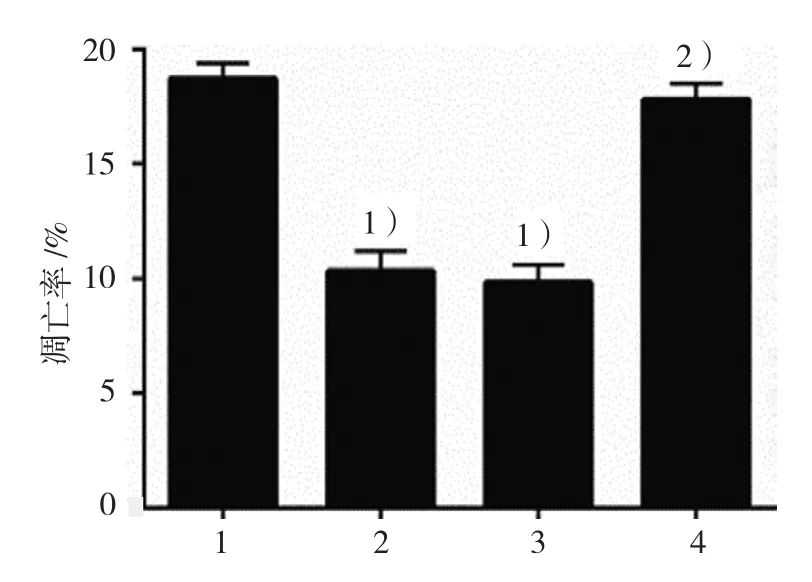
图8 各组GES-1细胞凋亡率比较(±s)
2.4 KLF5沉默抑制DCA诱导的GES-1细胞肠上皮化生
2.4.1TFF2、VIL1和CDX2蛋白空白对照组、DCA组、阴性对照组、KLF5沉默组的TFF2蛋白相对表达量分别为(1.00±0.05)、(2.46±0.08)、(2.38±0.09)和(1.09±0.08),经方差分析,差异有统计学意义(F=301.250,P=0.000);空白对照组、DCA组、阴性对照组、KLF5沉默组的VIL1蛋白相对表达量分别为(1.00±0.05)、(2.39±0.09)、(2.37±0.07)和(1.11±0.05),经方差分析,差异有统计学意义(F=385.109,P=0.000);空白对照组、DCA组、阴性对照组、KLF5沉默组的CDX2蛋白相对表达量分别为(1.00±0.06)、(2.52±0.08)、(2.51±0.09)和(1.02±0.05),经方差分析,差异有统计学意义(F=413.707,P=0.000)。DCA升高TFF2、VIL1和CDX2蛋白表达水平,而KLF5沉默后DCA的作用被抑制。见图9。
2.4.2TFF2、VIL1和CDX2 mRNA空白对照组、DCA组、阴性对照组、KLF5沉默组的TFF2 mRNA相对表达量分别为(1.00±0.05)、(2.35±0.05)、(2.37±0.06)和(1.11±0.08),经方差分析,差异有统计学意义(F=418.568,P=0.000);空白对照组、DCA组、阴性对照组、KLF5沉默组的VIL1 mRNA相对表达量分别为(1.02±0.03)、(2.32±0.05)、(2.29±0.05)和(1.10±0.07),经方差分析,差异有统计学意义(531.171,P=0.000);空白对照组、DCA组、阴性对照组、KLF5沉默组的CDX2 mRNA相对表达量分别为(1.00±0.04)、(2.41±0.08)、(2.43±0.05)和(1.05±0.08),经方差分析,差异有统计学意义(F=452.901,P=0.000)。DCA 升 高 TFF2、VIL1和CDX2 mRNA表达水平,而KLF5沉默后DCA的作用被抑制。DCA可能通过KLF5诱导胃黏膜肠上皮化生。见图10。

图9 各组GES-1细胞中TFF2、VIL1和CDX2 蛋白的表达(±s)

图10 各组GES-1细胞中TFF2、VIL1和CDX2 mRNA表达水平比较(±s)
2.5 KLF5促进DCA诱导的GES-1细胞肠上皮化生
2.5.1Wnt3a、β-catenin和CDX2蛋白空白对照组、DCA组、阴性对照组、KLF5沉默组、LiCl组及LiCl+KLF5沉默组的Wnt3a蛋白相对表达量分别为(1.01±0.06)、(2.38±0.06)、(2.26±0.05)、(1.02±0.05)、(2.36±0.08) 和(2.32±0.08), 经 方差分析,差异有统计学意义(F=320.400,P=0.000);空白对照组、DCA组、阴性对照组、KLF5沉默组、LiCl组及LiCl+KLF5沉默组的β-catenin蛋白相对表达量分别为(0.98±0.06)、(2.32±0.07)、(2.31±0.07)、(1.08±0.07)、(2.33±0.08) 和(2.40±0.07), 经 方差分析,差异有统计学意义(F=266.022,P=0.000);空白对照组、DCA组、阴性对照组、KLF5沉默组、LiCl组及LiCl+KLF5沉默组的CDX2蛋白相对表达量分 别 为(1.02±0.06)、(2.48±0.06)、(2.34±0.08)、(1.02±0.08)、(2.37±0.05) 和(2.38±0.06), 经 方差分析,差异有统计学意义(F=312.093,P=0.000)。DCA激活Wnt通路Wnt3a、β-catenin,以及肠上皮化生标志蛋白CDX2蛋白的表达,将KLF5沉默后,Wnt通路蛋白和肠上皮化生标志蛋白表达下降,而Wnt激活剂则使抵消了si-KLF5的作用,激活Wnt通路并升高CDX2的表达。见图11。
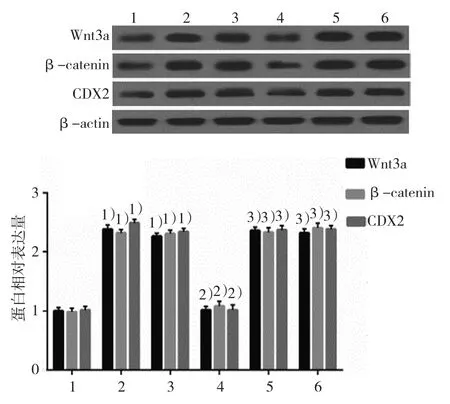
图11 Wnt激动剂对si-KLF5调节GES-1细胞中Wnt3a、β-catenin和CDX2蛋白表达的影响(±s)
2.5.2Wnt3a、β-catenin 和 CDX2 mRNA空白对照组、DCA组、阴性对照组、KLF5沉默组、LiCl组及LiCl+KLF5沉默组的Wnt3a mRNA相对表达量分别为(1.00±0.06)、(2.32±0.07)、(2.28±0.06)、(1.09±0.06)、(2.26±0.06)和(2.23±0.06),经方差分析,差异有统计学意义(F=310.259,P=0.000);空白对照组、DCA组、阴性对照组、KLF5沉默组、LiCl组及LiCl+KLF5沉默组的β-catenin mRNA相对表达量分别为(1.00±0.05)、(2.29±0.06)、(2.25±0.08)、(1.11±0.09)、(2.21±0.08)和(2.20±0.08),经方差分析,差异有统计学意义(F=190.732,P=0.000);空白对照组、DCA组、阴性对照组、KLF5沉默组、LiCl组及LiCl+KLF5沉默组的CDX2 mRNA相对表达量分别为(1.00±0.03)、(2.31±0.06)、(2.26±0.06)、(1.05±0.04)、(2.27±0.06)和(2.25±0.06),经方差分析,差异有统计学意义(F=400.107,P=0.000)。DCA激活Wnt通路Wnt3a、β-catenin,以及CDX2 mRNA的表达,将KLF5沉默后,Wnt3a、β-catenin和CDX2 mRNA表达下降,而Wnt激活剂则使抵消了si-KLF5的作用,激活Wnt通路并升高CDX2 mRNA的表达。KLF5可能通过激活Wnt/β-catenin通路促进DCA诱导的胃黏膜肠上皮化生。见图12。

图12 Wnt激动剂对si-KLF5调节GES-1细胞中Wnt3a、β-catenin和CDX2 mRNA表达的影响(±s)
3 讨论
我国是胃癌高发国家,每年新发病例占全世界发病人数的绝大多数。决定胃癌患者预后的关键在于早期发现、诊断和治疗。慢性萎缩性胃炎伴肠上皮化生及异型增生是重要的胃黏膜癌前病变[5-6]。因此,胃黏膜肠上皮化生发病机制的研究,可为胃黏膜异型增生甚至癌变的治疗提供新思路。
Krüppel样基因家族(Krüppel like factor,KLFs)为哺乳类动物的转求调节因子,属于锌指蛋白转录因子家族。其中KLF5又称为BTEB2和IKLF,属于KLF家族[7]。KLF5在不同组织不同层次中有广泛的表达。作为一个基本的转录因子,KLF5在细胞周期调控、细胞凋亡、迁移和分化中发挥必不可少的作用。另外,KLF家族成员KLF2、KLF4、KLF5及KLF8均证实作为致癌因子,促进各种癌症的发生、发展[8-10]。有研究证明,KLF5协同其他转录因子促进胃癌的发展[11],而其在癌前病变中的作用并无相关报道。有研究表明,DCA可以诱导食管癌的癌前病变[2]。因此,本文用DCA诱导胃黏膜细胞,观察KLF5沉默对胃黏膜肠上皮化生的作用。本实验结果证明,与正常胃黏膜相比,KLF5在肠上皮化生中的表达升高,提示KLF5可能在胃黏膜肠上皮化生中发挥重要作用。进一步实验结果表明,与正常胃黏膜上皮细胞相比,DCA诱导胃黏膜肠上皮化生细胞模型中KLF5的表达升高。
细胞增殖和凋亡是保持机体平衡和修复损伤的重要因素。胃黏膜上皮细胞更新非常迅速,研究认为肠上皮化生的发生是细胞异常增生逐渐积聚的结果[12]。有研究表明,抑制KLF5能够减轻口腔黏膜癌前病变[13]。KLF5能够促进乳腺癌细胞的增殖、迁移和侵袭,从而促进癌症的发展[14]。本实验结果表明,DCA促进GES-1细胞的增殖,并抑制凋亡,而KLF5沉默后抑制DCA对细胞增殖、凋亡的影响。
同源异形盒基因CDX2是一种肠上皮特异性转录因子,可控制肠上皮细胞的分化和成熟,在肠上皮化生黏膜中呈高表达[15]。三叶因子家族(trefoil factor family,TFF)是胃肠道黏液细胞分泌的具有≥1个三叶结构域的小分子蛋白质多肽,主要功能是保护黏膜、促进损伤黏膜修复。研究发现,在TFF2缺陷小鼠模型实验中,小鼠的胃黏膜增生降低,提示TFF2可能有刺激胃黏膜增殖的作用,增加胃癌发生的危险性[16]。绒毛蛋白(Villin,VIL)是一种重要的细胞支架蛋白,在刷状缘上皮细胞分化过程中发挥重要作用。近年来研究表明,VIL1是肠上皮细胞分化和转移性肠腺癌的标志物,可以辅助明确转移性肿瘤的来源[17]。因此,TFF2、VIL1和CDX2作为肠上皮化生的标志蛋白,在肠上皮化生过程中发挥重要作用。越来越多的研究表明,Wnt信号通路除参与调控发育过程外,在癌症的发展中也发挥重要作用。Wnt途径激活后,相关的细胞周期和凋亡相关基因、生长因子和黏附分子等开始转录,参与癌症的发生、发展[18]。有研究表明,KLF5敲除的小鼠中Wnt通路被抑制,肠上皮稳态被破坏[19]。本实验结果表明,KLF5沉默抑制DCA对TFF2、VIL1和CDX2的上调作用;另外,在Wnt通路干预后,si-KLF5的作用又被抑制,表明KLF5可能通过Wnt/β-catenin通路促进DCA诱导的肠上皮化生。
综上所述,本文通过DCA诱导胃黏膜上皮细胞,发现KLF5沉默明显抑制DCA诱导的胃黏膜上皮细胞肠上皮化生,表明KLF5可能促进DCA诱导的肠上皮化生,其机制可能是通过激活Wnt/β-catenin通路来实现的。本研究指出KLF5参与DCA诱导的胃黏膜肠上皮化生的发生,为预防胃癌提供新的靶点。

