草鱼呼肠孤病毒873株逆转录环介导等温扩增(RT-LAMP)检测方法研究
张 旻,王 娜,景宏丽,吴绍强
(中国检验检疫科学研究院,北京 100029)
草鱼呼肠孤病毒(grass carp reovirus,GCRV),又称草鱼出血病病毒(grass carp hemorrhagic virus,GCHV),属呼肠孤病毒科(reoviridae)水生呼肠孤病毒属[1]。目前已报道了GCRV的14种分离株,并在全基因测序的基础上确立了2种基因型:以GCRV-873株为代表的Ⅰ型和以GCRV-108株为代表的Ⅱ型,二者核酸序列同源性只有50%左右[2]。GCRV-873株分离自湖南[3],该病毒为双链RNA病毒,基因组由11条dsRNA片段组成[4],对草鱼肾脏细胞系[5](grass carp kidney cell line,CIK)和草鱼卵巢细胞系(grass carp ovarian cell line,CO)细胞系敏感[6,7]。已建立了针对GCRV-873株的病原分离[8]、ELISA[9]和RT-PCR检测方法,并形成了技术规范[10],应用于疫病监测。
为提高检测效率,建立了一种GCRV-873株特异性的逆转录环介导等温扩增(reverse transcription loop-mediated isothermal amplification ,RT-LAMP)检测方法。该方法检测限可达10个拷贝数的目的基因,且不与鲤春病毒、传染性造血器官坏死病病毒、传染性胰脏坏死病毒和病毒性出血性败血症病毒RNA产生交叉反应。在反应体系中加入染料后,反应结果肉眼直接可见,不需电泳即可判断结果,避免了LAMP技术常见的气溶胶污染。该方法是一种便捷高效、安全可靠的检测方法,适合大批量样品的现场初筛和实验室检测。
1 材料与方法
1.1 病毒株及病毒RNA
GCRV-873株由中国科学院武汉病毒研究所提供。GCRV-873株接种于CIK细胞,25 ℃恒温培养。待出现细胞病变效应(cytopathic effect,CPE),细胞大部分脱落后,反复冻融细胞液3次,再使用Trizol(Promega,USA)提取总RNA。
鲤春病毒(spring viraemia of carp virus,SVCV)RNA、传染性造血器官坏死病毒(IHNV)RNA、传染性胰脏坏死病毒(IPNV)RNA、病毒性出血性败血症病毒(viral haemorrhagic septicaemia virus,VHSV)RNA均由深圳出入境检验检疫局水生动物病重点实验室提供。
1.2 引物的设计
以GCRV VP5(Genbank No:AF239175.1)基因序列保守片段(218 bp)为模板,使用在线软件http://primerexplorer.jp/elamp4.0.0/index.html和DNastar primer select 设计出2对引物(表1)。引物由上海生工有限公司合成。
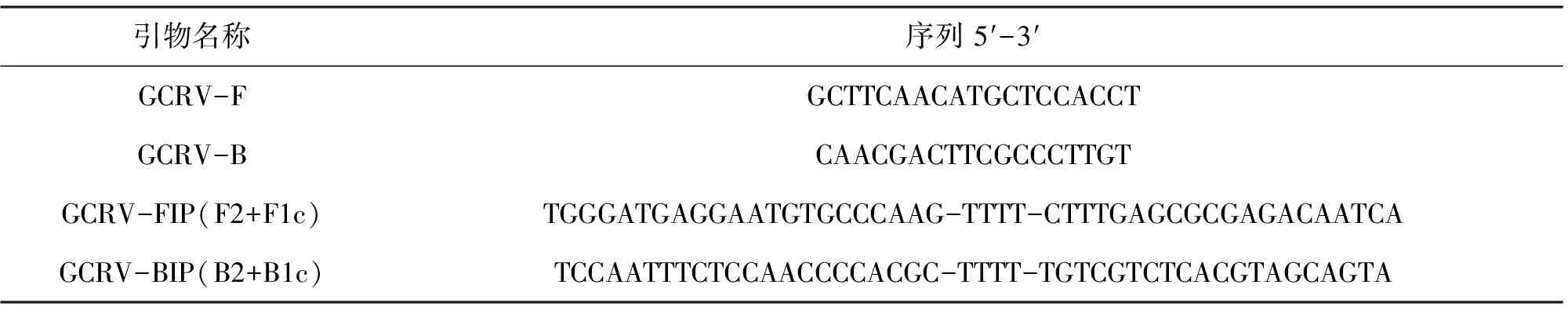
表1 根据GCRV VP5基因片段设计的RT-LAMP引物Tab.1 RT-LAMP primers used to amplify GCRV VP5 gene
1.3 RT-LAMP反应体系
使用蓝谱核糖核酸扩增试剂盒(Lanpu Bio-tech,China)中的试剂配置反应体系,体系为25 μL:RNA模板1 μL,2×反应缓冲液(含MgSQ416 mmol/L,和dNTPs 2.8 mmol/ L each)12.5 μL,引物GCRV-FIP和GCRV-BIP (20 pmol/μL)各2 μL,引物GCRV-F和GCRV-B (10 pmol/μL)各0.5 μL,酶溶液(Bst DNA聚合酶和AMV逆转录酶混合液)1 μL,去离子水5.5 μL。
1.4 RT-LAMP反应温度的优化
以GCRV-873 RNA为模板,分别在58、60、62和65 ℃下进行RT-LAMP反应。使用浊度仪LA-320C(Lanpu Bio-tech,China)读取扩展结果。
1.5 RT-LAMP反应产物的克隆及阳性对照制备
使用TIANgel Midi Purification Kit (TIANGEN,China)胶回收试剂盒,回收纯化引物GCRV-F和GCRV-B的PCR扩增片段,再将片段连接入pGem-T-Esay 载体(Novigen),连接产物转化入DH5α中进行蓝白斑筛选。挑选白色菌落测序,若目的基因正确连接入重组质粒,则提取阳性重组质粒pGem-T-GCRV做为RT-LAMP检测用阳性对照。使用微量紫外分光光度计对重组质粒溶液进行定量,并按照以下公式将重组质粒的质量浓度换算为拷贝数浓度:
(6.02×1023)×(浓度g/mL)/(MW g/moL)=copies/mL
1.6 RT-LAMP检测方法的检测限
根据测量和换算的浓度,将重组质粒pGem-T-GCRV溶液稀释为1011copies/μL的溶液,再将该溶液以10倍梯度稀释至100、101、102、103、104、106、107copies/μL,每稀释度各取1 μL分别进行RT-LAMP反应,使用1.3的反应体系和1.4确认的反应温度。
1.7 RT-LAMP检测方法与RT-PCR检测方法的检测限对比
根据现行的出入境检验检疫行业标准《草鱼出血病检疫技术规范》(SN/T 3584-2013),GCRV-873株RT-PCR检测方法的目的基因为VP7基因片段,而本LAMP检测VP5基因片段,因此无法使用同一种标准品进行检测限比对,只能使用病毒RNA。将1.1提纯的接种细胞总RNA(约100 ng/μL)10倍梯度稀释,每个稀释梯度各取1 μL作为模板,分别进行RT-LAMP(反应体系条件同1.6)和RT-PCR检测(反应体系和条件参照标准SN/T 3584-2013),对比检测限。
1.8 RT-LAMP检测方法的交叉反应
以GCRV-873株、SVCV、IHNV、IPNV和VHSV RNA为模板,各取1 μL分别进行RT-LAMP检测(反应体系和温度同1.6)。
1.9 RT-LAMP检测结果的可视化
在1.3反应体系的基础上,加入0.5 μL calcein 染料,体系仍为25 μL。将PCR管放置于烘箱中,反应温度为1.4确认的温度,反应时间为60 min。
1.10 病毒样品检测
本实验室根据《草鱼出血病检疫技术规范》(SN/T 3584-2013)推荐的病原分离和RT-PCR方法,检测并保存了10份GCRV-873株阳性样品和12份GCRV阴性样品,利用建立的荧光RT-LAMP检测方法进行检测,统计符合率。
2 结果与分析
2.1 RT-LAMP反应温度的优化
62 ℃和65 ℃组反应20 min出现扩增曲线,58 ℃和60 ℃组反应26 min出现扩增曲线,反应时间超过60 min,阴性对照会出现扩增曲线。为提高引物与模板结合的特异性,RT-LAMP的反应条件确定为65 ℃恒温反应60 min(图1)。
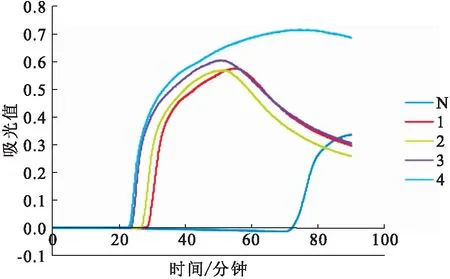
图1 GCRV RT-LAMP反应条件优化Fig.1 The optimization of the reaction condition of RT-LAMP for GCRV N:阴性对照;1:58 ℃;2:60 ℃;3:62 ℃;4:65 ℃
2.2 RT-LAMP检测方法的检测限
反应条件为65 ℃恒温反应60 min,随着样品模板量的递减,RT-LAMP扩增曲线出现的时间也逐渐延长,模板稀释到10个拷贝数,PCR 扩增结果仍为阳性,模板稀释到100,即1拷贝数时扩增结果则为阴性。由此可得出RT-LAMP检测限为10个拷贝数的目的基因核酸片段(图2)。
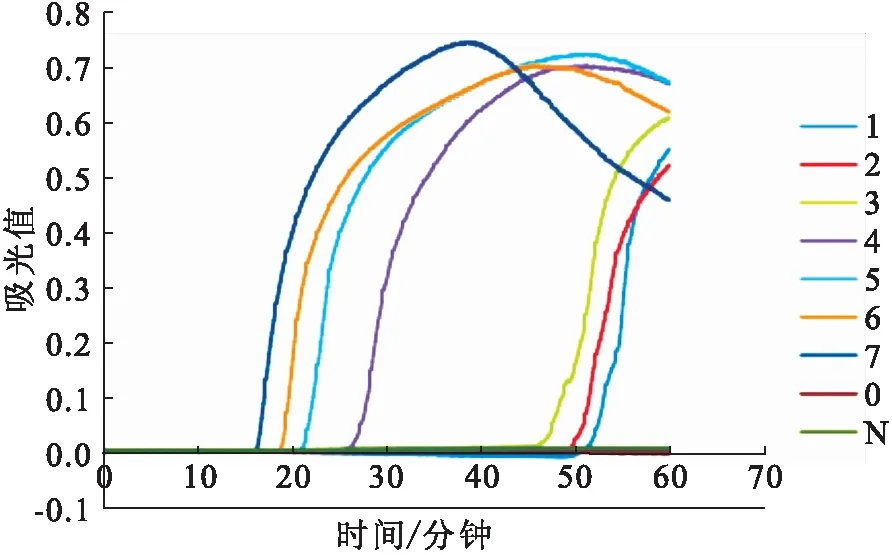
图2 RT-LAMP检测限(拷贝数)Fig.2 The detection limit of RT-LAMP (copies)N:阴性对照;0~7:重组质粒标准品的模板量分别为100 ~107 copies
2.3 RT-LAMP与RT-PCR的检测限对比
原液稀释104倍,总RNA量约10 pg,RT-LAMP结果仍为阳性;相比之下,RT-PCR只能检测到稀释103倍,总RNA量约1 pg的3号样品(图4),而且条带很浅。RT-LAMP检测限比RT-PCR高10倍(图3)。
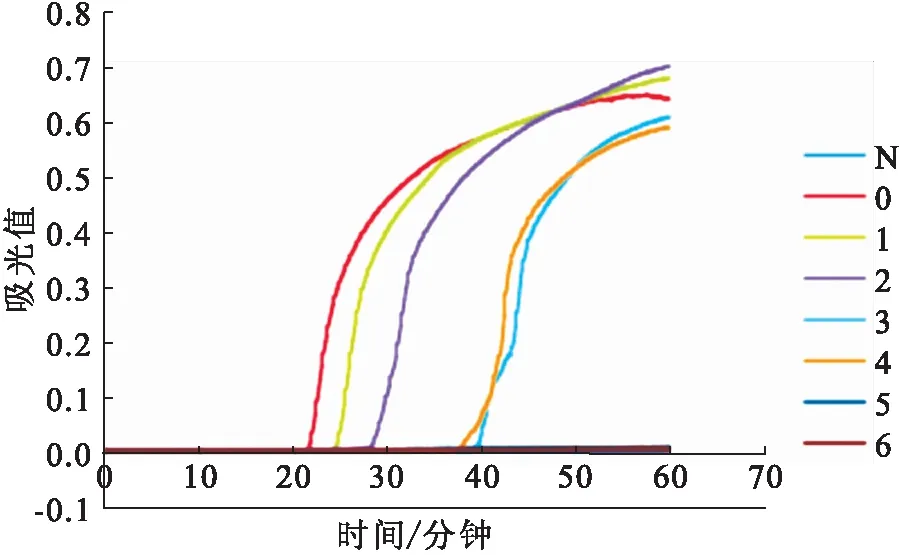
图3 RT-LAMP检测限(RNA浓度)Fig.3 The detection limit of RT-LAMP (RNA concentration)
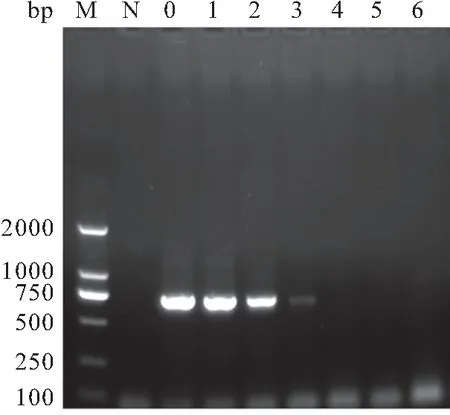
图4 RT-PCR检测限(RNA浓度)Fig.4 The detection limit of RT-PCR (RNA concentration)N:阴性对照;0:RNA原液;1~6:原液稀释倍数分别为101~106 倍
2.4 RT-LAMP检测方法的交叉反应
交叉反应只有 GCRV 873株呈阳性,而其他病毒则为阴性。建立的RT-LAMP检测方法特异性良好(图5)。

图5 RT-LAMP交叉反应检测结果Fig.5 Cross reaction results of RT-LAMPN:阴性对照;1:GCRV-873株;2:SVCV;3:IHNV;4:IPNV;5:VHSV
2.5 RT-LAMP检测结果的可视化
检测结果显示GCRV-873株呈绿色,其他样品未变色(图6)。
2.6 病毒样品检测
利用建立的RT-LAMP检测方法对本实验室保存的10份GCRV阳性样品和12份GCRV阴性样品的检测结果与按照《草鱼出血病检疫技术规范》(SN/T 3584-2013)检测的结果一致,符合率100%。
3 讨论
由于我国草鱼养殖面积很大,在针对GCRV的检测工作中,样品量也非常大,有时一批样品包括150尾鱼。这导致检测任务的工作量非常繁重。为减轻工作量、提高检测效率,需要在保证检测限和特异性的基础上,建立比传统的ELISA和RT-PCR方法更方便快捷的检测方法。

图6 荧光RT-LAMP检测GCRV-873株Fig.6 Fluorescence RT-LAMP for detection of GCRV-873N:阴性对照;1:SVCV;2:IHNV;3:VHSV;4:GCRV-873株
LAMP技术的原理是针对靶基因的6个区域设计4条特异引物,利用Bst DNA polymerase在恒温条件下完成核酸扩增反应[11]。LAMP技术的检测限通常高于PCR方法,与荧光定量PCR方法相当[12]。作为新型核酸扩增技术,近年来国内外陆续建立了多种针对水产病毒的LAMP检测方法,如疱疹病毒Ⅱ型[13]、传染性造血组织坏死病毒[14]、真鲷虹彩病毒(RSIV)[15]等。
本研究建立的特异性检测GCRV-873株的RT-LAMP检测方法,将病原RNA的反转录与LAMP扩增反应集中于同一反应体系,恒温条件下一次性完成扩增,相对于传统的RT-PCR方法和ELISA方法,主要有以下两点优势:1.耗时短:RT-PCR方法检测GCRV,需要3 h左右,ELISA方法也需要5 h左右,该RT-LAMP方法省去了制备琼脂糖凝胶、电泳等过程,反应只需要60 min;2.检测限比RT-PCR方法高10倍,因此该方法非常适合病原的临床检测。
目前国内外也建立了其他几种针对GCRV的RT-LAMP检测方法,与本研究建立的RT-LAMP检测方法的区别如下:(1)2013年,建立了针对GCRV-HZ08株(GCRV Ⅱ型)的RT-LAMP检测方法[16],而本研究建立的RT-LAMP方法是特异性检测GCRV-873株(CCRV I型)的,两种基因型的基因同源性只有50%,该方法能否检测GCRV-873株的基因,尚未有报道;(2)2012年-2013年,先后报道了4种检测GCRV VP6基因片段的RT-LAMP检测方法,除其中1种未报道详细数据外[17],其他3种检测限分别达到7 copies[18]、10 copies[19]和33 pg[20]的病毒RNA。但这3种方法主要利用电泳检测扩增产物,作为一种高效的核酸扩增技术,LAMP产物的目的基因含量极高,打开反应管取样的过程中有一定气溶胶污染风险[21],容易导致检测结果出现假阳性。本研究建立的RT-LAMP检测技术,不需要打开反应管,在封闭的环境中使用浊度仪或染料判断检测结果,极大降低了气溶胶扩散的风险,可以有效避免核酸扩增结果出现假阳性[22]。
综上所述,本研究建立的GCRV-873株RT-LAMP检测方法,具备特异性强、检测限高、耗时短、假阳性风险低等优点,适合大批量样品的现场初筛和实验室检测。

