哮喘、慢性阻塞性肺疾病、ACOS患者气道重塑及气道上皮屏障的对比
郭伟洪 张丹丹 缪卓峰 梁剑平 袁小玲
广东省中山市人民医院呼吸内科,广东中山 528400
2014年全球慢性阻塞性肺疾病防治创议(GOLD)及哮喘防治创议(GINA)首次对哮喘-慢性阻塞性肺疾病重叠综合征(ACOS)的临床特征进行全面综述,并对其诊断及治疗提出建议[1-2]。但目前在临床上识别及明确诊断ACOS仍有一定的难度。近年来关于其流行病学、病因、临床特征、病理生理特征、治疗方案等研究全面开展[3]。但尚未见到关于ACOS患者气道重塑及气道上皮屏障功能等方面的研究。
气道重塑在气道慢性炎症性疾病发展中起关键作用,可导致气道反应性增高、肺功能下降、激素抵抗、病情加剧及造成不可逆气流受限[4]。既往研究发现,哮喘及COPD患者均存在气道重塑,但两者气道重塑发生的部位、程度及具体结构变异却不完全一致[5]。气道上皮屏障功能主要由气道上皮细胞、上皮细胞间连接蛋白及上皮细胞与基质间连接组成。其功能的破坏直接导致气道炎症的发生。但目前尚未有关于ACOS及COPD患者气道屏障功能的报道[6-7]。
本研究拟通过对比哮喘、COPD及ACOS患者气道黏膜基底膜厚度、上皮细胞间E钙粘蛋白及B-环连蛋白的分布,初步研究三种疾病状态下气道重塑情况及气道上皮屏障功能,从病理角度识别三种疾病的异同,为更好的认识及区分三种疾病提供进一步依据。
1 资料与方法
1.1 一般资料
收集2014年3月 ~ 2016年3月中山市人民医院呼吸科就诊的正常组15例、哮喘14例、慢阻肺16例及重叠综合征14例 。ACOS诊断参考2014年GINA及GOLD联合推荐指南[8],慢阻肺及哮喘的诊断按照2014年版GOLD和GINA指南标准[9]。正常组的纳入标准:(1)来院进行健康体检的志愿者;(2)年龄>20岁;(3)检查资料齐全。其他三组的纳入标准:(1)所有患者均处于疾病稳定期;(2)3个月内未使用吸入及全身激素;(3)近4周无急性呼吸道感染;(4)所有受试者均签署知情同意书。
1.2 主要试剂和仪器
免疫组化试剂盒(购自深圳的晶美工程公司)、兔抗人E-cadherin多克隆抗体、兔抗人B-catenin多克隆抗体、抗兔二抗(均购自武汉的博士德生物公司)、肺功能仪(购自日本美能公司的AS-407型)、光学显微镜(购自日本奥林巴斯公司的CX23型)等。
1.3 研究方法
1.3.1 基本资料采集 收集所有受试者的一般资料,包括年龄、吸烟史、过敏史、近6个月用药史及行mMRC、CAT等问卷调查。
1.3.2 肺功能检查及分组 所有患者完善肺通气功能、支气管激发实验或支气管舒张实验检查。主要检查指标:FEV1,FVC、FEV1%预计值。
1.3.3 纤维支气管镜检查下气道黏膜活检 所有患者在气道局部麻醉或联合全身麻醉状态下行纤维支气管镜检查。在段级支气管开口附近取3 ~ 5块气道黏膜。标本迅速放入4%福尔马林中固定,后期行HE染色及免疫组化检测。
1.3.4 基底膜厚度的测量 固定好的气道黏膜组织,经脱水、包埋、切片、中性树胶封片后,置光学显微镜下观察,采用image J(NIH,美国)软件进行基底膜厚度测量。每个标本至少测量3个不同位置基底膜厚度,最终取平均值。测量方法参考Justyna的方法。
1.3.5 免疫组化 气道粘膜组织行福尔马林固定、脱水、包埋、切片、脱蜡、水化。3%H2O2封闭15min,兔抗人E-cadherin多克隆抗体(1∶100)4℃孵化过夜。抗兔二抗37℃孵化60min,DAB显色。苏木素复染1min,脱水、封片,倒置相差显微镜下观察拍照。
1.4 统计学分析
采用SPSS16.0软件进行统计学分析,计量资料作正态性检验,如样本符合正态分布以(±s)表示;如样本不符合正态分布则以中位数(四分位数间距)表示;计数资料用例数(%)表示。两组治疗前基线的比较采用两个独立样本t检验或χ2检验方法,多组间比较采用one-way ANOVA,各组间两两比较采用Bonferroni法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组患者一般情况
健康对照组、哮喘组、慢阻肺组、ACOS组各组间性别、年龄、吸烟史差异无统计学意义(P>0.05)。但各组间肺功能(FEV1、FEV1/FVC)差异有统计学意义(P< 0.05),见表 1。
2.2 各组气道基底膜厚度比较
哮 喘 组(47.25±14.38)μm 及 ACOS组(54.75±18.28)μm气道基底膜厚度较正常组(12.25±3.86)μm明显增厚(P<0.05)。COPD组(23±7.87)μm与正常组无显著差异(P>0.05)。与COPD组相比,ACOS组基底膜厚度明显增厚,且差异有统计学意义(P<0.05);与哮喘组相比,ACOS组基底膜厚度有增加,但差异无统计学意义(P> 0.05)。见图 1 ~ 2。
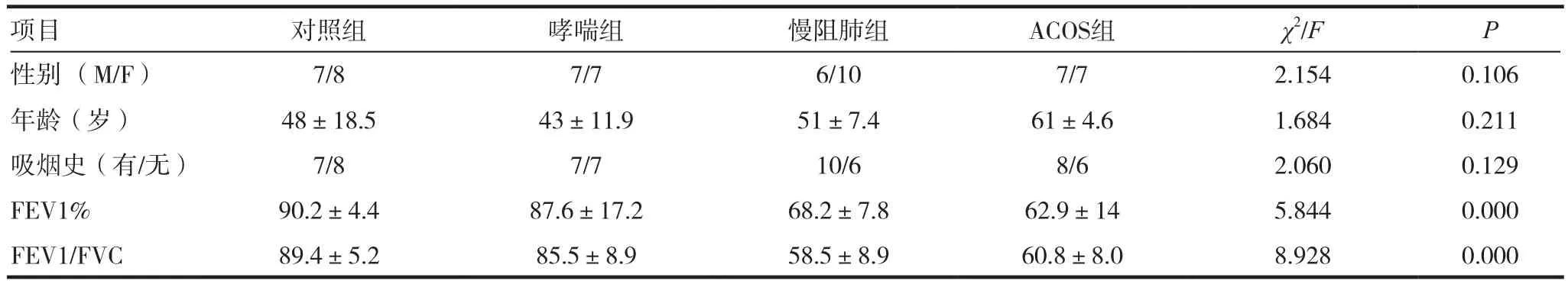
表1 各组间一般资料

图1 各组患者气道黏膜基底膜厚度注:光学显微镜×400倍

图2 各组气道黏膜基底膜厚度比较(±s)
2.3 气道上皮细胞间连接蛋白表达及分布的异同
各组中,E-钙粘蛋白 及β-环连蛋白均主要表达于气道上皮细胞膜,胞质中也有表达,其中β-catenin亦可见胞核表达。相对于正常组,哮喘组、COPD组及ACOS组E钙粘蛋白细胞膜上的分布减少、排列紊乱,但各组间差异不明显(图3)。各组间β环连蛋白表达无明显差异(图4)。
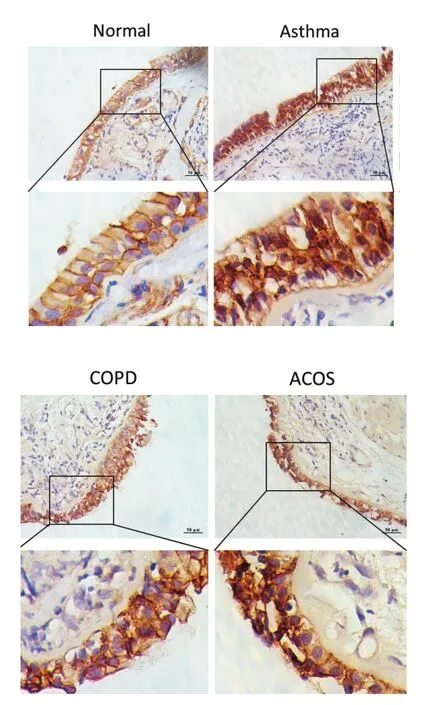
图3 各组气道黏膜E钙粘蛋白免疫组化

图4 各组气道黏膜β环连蛋白免疫组化
3 讨论
哮喘及COPD均属于慢性气道炎性疾病,可累及从中央到外周的整个呼吸道[10]。ACOS作为独立于哮喘及COPD的一种疾病,具有自身的特点。本研究从气道基底膜厚度及气道上皮间连接蛋白的分布入手,从病理特征上进一步认识三种疾病的异同。
本研究发现,与哮喘及COPD患者相比,ACOS患者气道基底膜增厚最明显,提示ACOS患者气道重塑程度最重。这一发现从另一个角度解释了ACOS患者肺功能更差、FEV1下降速度更快、临床症状更重的原因。目前普遍认为,ACOS患者是在患有哮喘基础上进展为COPD,或者在不完全可逆气流阻塞情况下出现部分可逆性气流受限,病人在气道炎症方面更类似于COPD[11-12]。而本实验发现ACOS患者气道基底膜厚度与asthma更类似,COPD患者气道基底膜增厚相对较轻。提示在气道重塑方面,ACOS可能与asthma程度更接近。但有关三种疾病状态下气道重塑的具体差异,尚需更进一步的研究证实。
本研究发现ACOS患者BMT厚度较COPD组明显增厚,可以解释为何临床上ACOS患者对糖皮质激素治疗反应较COPD好。该发现为ACOS患者早期使用表面激素治疗提供了进一步的理论依据。E钙粘蛋白及β-环连蛋白是组成气道上皮细胞间粘附连接及紧密连接的重要分子,参与气道上皮机械屏障及炎症防御功能。既往研究发现哮喘患者中存在E钙粘蛋白、ZO-1等连接蛋白表达异常,且与气道炎症程度有一定相关性[13-14]。本研究发现asthma、COPD及ACOS各组中E钙粘蛋白表达均存在有分布紊乱及表达减少,首次证实了COPD及ACOS患者同样存在有类似哮喘患者的上皮屏障功能的破坏。该研究结果提示屏障功能的破坏可能是慢性气道炎性疾病的共同特征。本研究未发现三组间E钙粘蛋白分布及表达存在显著差异,不排除与病例数较少有关;且受研究条件限制,未同时行诱导痰及肺泡灌洗液检查,未能进一步研究上皮屏障功能的破坏与炎症浸润的关系。本研究中,各组间上皮细胞β环连蛋白表达无显著差异,但其在细胞内的分布可能存在不同,在哮喘组存在细胞核分布增多及分布较弥散的情况,具体的差异尚需进一步的研究来证实。
总之,asthma、COPD、ACOS患者间气道基底膜厚度存在明显差异,提示ACOS组气道重塑程度最重;各组间E钙粘蛋白表达及分布较正常组均有异常。本研究为进一步的认识ACOS及区别ACOS与asthma及COPD提供了新的途径。但仍需大样本的研究及更加深入的分子机制来探讨三种疾病致病机制的异同。

