基于热力学分析方法研究废铅膏含铅组分的浸出行为
张伟,杨家宽,于鲁冀,曾科,喻文昊,高双全
(1. 郑州大学 水利与环境学院, 河南 郑州 450001; 2. 华中科技大学 环境科学与工程学院, 湖北 武汉 430074)
目前,热力学的相关方法被广泛应用于金属浸出等领域,研究浸出相平衡时主要物相存在的条件和状态,对分析湿法冶金过程中各组分在浸出过程的转化等具有重要意义.
犹他大学的LI等[1-5]通过电位-pH相图研究湿法回收金体系中铁离子、亚铜离子等与硫氰酸根(SCN-)的结合方式和相平衡状态时的主要物相组成,分析并预测了金属阳离子在SCN-H2O、Au-SCN-H2O、Ag-SCN-H2O、Cu-SCN-H2O和Fe-SCN-H2O等体系中的行为,结果表明,银离子和铜离子在适宜的硫氰酸盐浓度下主要生成不溶性盐,而在高浓度或低浓度硫氰酸盐溶液中则可溶,铁离子则会与硫氰酸盐形成较多种类的复合物,如Fe(SCN)2+(aq)、Fe(SCN)-、Fe(OH)3、Fe(OH)2等. 通过热力学计算方法可有效分析金属物相在某特定溶液中的主要物相组成.

图1 25 ℃时Pb-Citrate-Sulfate-H2O体系的Eh-pH相图Fig.1 Eh-pH diagram of the Pb-Citrate-Sulfate-H2O system at 25 ℃
物相组成: 0.12 mol·L-1Pb(II),0.12 mol·L-1总硫酸根量,1.0 mol·L-1柠檬酸根总量.
Composition: 0.12 mol·L-1Pb(II), 0.12 mol·L-1total sulfates and 1.0 mol·L-1total citrate.

图2 25 ℃时Pb-Citrate-Sulfate-H2O体系的Fraction分布图Fig.2 Fraction diagram for the Pb-Citrate-Sulfate-H2O system at 25 ℃
物相组成: 0.12 mol·L-1Pb(II),0.12 mol·L-1总硫酸根量,1.0 mol·L-1柠檬酸根总量.
Composition: 0.12 mol·L-1Pb(II), 0.12 mol·L-1total sulfates and 1.0 mol·L-1total citrate.
本文首次使用Medusa软件对废铅膏中含铅组分在柠檬酸-枸橼酸钠体系的浸出特性进行分析,研究其在特定pH浸出环境下产物的组成和稳定存在形式.
1 实验部分
1.1 实验原料
实验选用的废铅膏取自湖北金洋冶金股份有限公司,废铅酸蓄电池经破碎、分选、压滤、洗涤、烘干、粉碎和过筛后获得本实验所需要的原料. 其主要组分为硫酸铅(PbSO4)、二氧化铅(PbO2)和氧化铅(PbO)等,还有少量杂质. 主要含铅成分及质量分数见表1,主要杂质组成及质量分数见表2. 实验反应试剂包括分析纯枸橼酸钠、柠檬酸和去离子水等.

表1 废铅膏含铅成分

表2 废铅膏主要杂质组成
1.2 实验仪器
X’Pert PRO型X射线衍射仪,对制备的前驱体进行测试; 铜靶材,Ni滤波,最大功率为3 kW,管流60 mA,测试角度为5°~ 80°.
1.3 热力学分析软件
相关热力学数据从NIST中获取,热力学数据计算以Medusa热力学软件为载体(Royal Institute of Technology,Sweden),参考ERIKSON的算法[7-8],考虑组分之间所有可能的平衡常数,同时最小化吉布斯自由能. 结果以Eh-pH和Fraction相图形式呈现. 铅与柠檬酸根配合的热力学相关数据如表3所示.
1.4 实验过程
通过调节浸出剂枸橼酸钠和柠檬酸的投加量,将初始pH值分别调整为3.5,4.2,4.7和5.2,通过恒温水浴将温度控制在25 ℃. 加入定量的废铅膏,浸出时间控制在24 h. 反应结束,固液分离,获得固相前驱体.
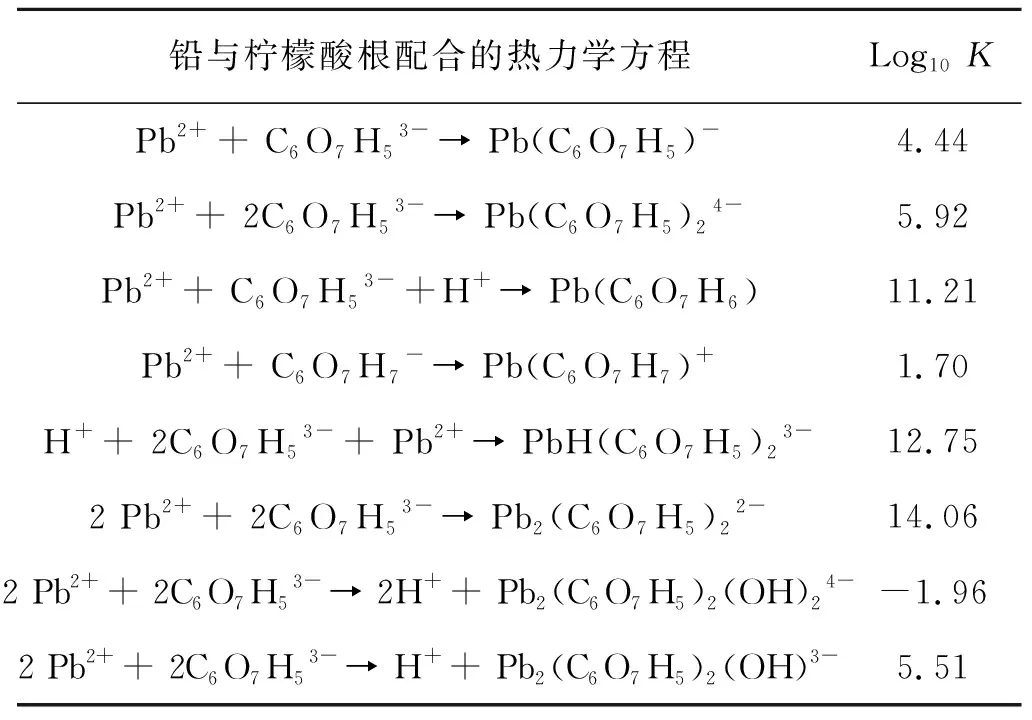
表3 铅与柠檬酸根配合的热力学相关数据
2 结果与讨论
图3为废铅膏在不同pH条件下的XRD图谱.
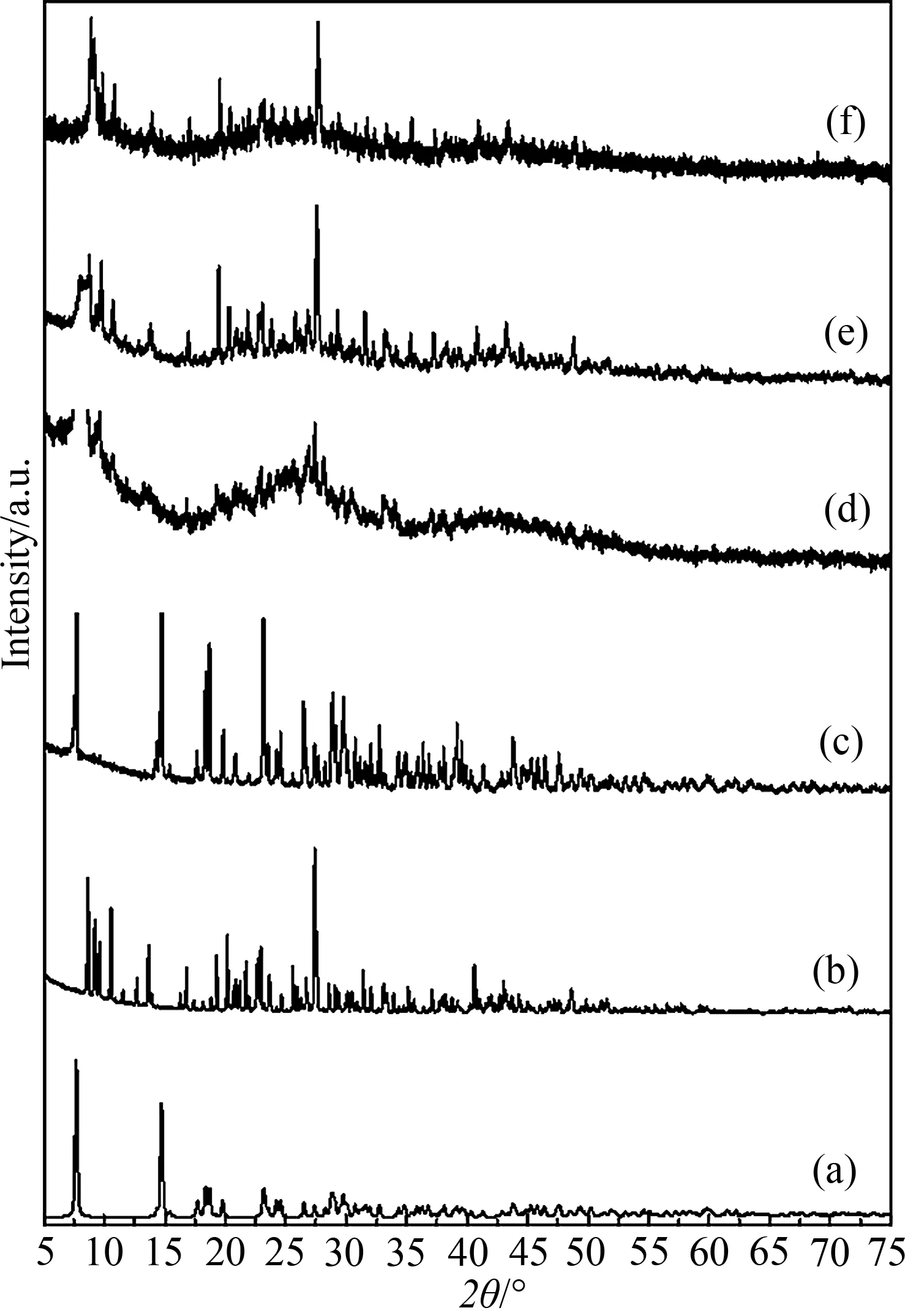
图3 废铅膏在不同pH条件下的XRD图谱Fig.3 The XRD patterns of lead citrate precursors obtained in various pH conditions
(a) 标准Pb(C6H6O7)·H2O; (b) 外购Pb3(C6H5O7)2·3H2O; (c) pH=3.5; (d) pH=4.2; (e) pH=4.7; (f) pH=5.2.
(a) Standard lead citrate of Pb(C6H6O7)·H2O; (b) Lead citrate Pb3(C6H5O7)2·3H2O provided by Alfa Aesar China (Tianjin) Co., Ltd; (c) pH = 3.5; (d) pH = 4.2; (e) pH = 4.7; (f) pH = 5.2.
由图3可知,在pH值为3.5和4.2时,浸出生成的柠檬酸铅出峰位置与标准柠檬酸铅相近,表明固相产物的分子式应为Pb(C6H6O7)·H2O;而在pH值为4.7和5.2的浸出环境下,柠檬酸铅出峰位置与外购柠檬酸铅相似,表明产物分子组成应为Pb3(C6H5O7)2·3H2O. 从4个pH条件下的物相组成来看,在pH值为4.2时所制备的前驱体基线明显不平整,表明在此pH值和温度条件下,产物晶型不完整,若要使晶型趋于完整,则需进一步处理.
废铅膏在不同pH浸出条件下的铅回收率如图4所示. 由图4可知,不同pH浸出条件下铅回收率略有差别,但总体均大于96.4%. 随着浸出体系pH值的升高,铅回收率略有降低,由pH=3.5时的97.2%降低至pH=5.2时的96.4%,经分析,主要由于浸出环境pH值的升高加速了产物柠檬酸铅的溶解[9],从而使回收率略有降低.

图4 废铅膏在不同pH条件下的铅回收率Fig.4 Lead recovery of spent lead paste after leaching procedure in various pH conditions
浸出产物的最终形态与浸出完成后体系的pH值有关,对浸出过程pH值的变化进行分析,结果如图5所示. 由图5可知,不同初始pH环境的浸出体系其pH值变化不大,浸出完成时体系的pH值只较反应开始前略有升高.原因是其为缓冲体系.

图5 废铅膏在不同初始pH条件下浸出过程中pH值随时间的变化Fig.5 Variation of pH value versus leaching time in different original pH conditions
使用Medusa热力学软件对热力学数据进行计算,得到Pb-CitH-CitNa体系(其中,CitH代表柠檬酸,CitNa代表枸橼酸钠)的Eh-pH图和Fraction物相分布图如图6所示.

图6 25 ℃时 Pb-CitH-CitNa浸出体系Eh-pH和Fraction分布图 Fig.6 Eh-pH and Fraction diagram of Pb-CitH-CitNa leaching system at 25 ℃
(c) 为晶体符号: 200.0 mmol·L-1Pb(II), 400.0 mmol·L-1Cit3-.
(c) Containing 200.0 mmol·L-1Pb(II) and 400.0 mmol·L-1Cit3-.

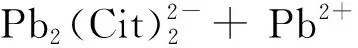
(1)
当pH>7.6、电位为-0.3 ~ 0.4 V时,Pb(OH)2成为浸出体系的稳定物相;当电位<0时,浸出体系的稳定物相为Pb单质,表明提高浸出体系的电位可实现Pb单质向柠檬酸铅络合态的转化;当电位>1.0 V时,浸出体系的稳定物相为PbO2,通过添加还原剂降低浸出体系的环境电位,可实现PbO2向柠檬酸铅络合态的转变.
3 结 论

以上结论表明,可以采用热力学分析软件分析废铅膏含铅组分的浸出行为和产物组分;也可基于此方法分析废铅膏中主要杂质与柠檬酸根的络合行为及稳定存在物相.因内容较多,待另文研究. 此方法还可推广至对含重金属矿物或电子废弃物的浸出行为研究.


