补肾活血针刺法对SAMP8小鼠杏仁核蛋白质组学表达的影响
梁梅亭 朱宏 董克礼 李广诚


摘要:目的 观察补肾活血针刺法对阿尔茨海默病(AD)模型小鼠SAMP8杏仁核蛋白质组学表达的影响,探寻针刺治疗AD的潜在靶点蛋白。方法 30只6月龄雄性SAMP8小鼠随机分为针刺组和对照组,每组15只,针刺组选取“肾俞”“百会”“血海”“膈俞”进行干预,对照组予以相同时间捉抓刺激。干预8周后,取杏仁核,采用蛋白质组学技术鉴定差异蛋白质点。结果 与对照组比较,针刺组最终鉴定有9个差异蛋白质点,其中6个上调、3个下调,根据蛋白质数据库中提供的相关信息,差异蛋白质点功能主要涉及线粒体能量代谢、氧化应激、β-淀粉样蛋白(Aβ)产生等方面。结论 补肾活血针刺法可调节杏仁核内多种蛋白质的表达,提示其可能是通过改善线粒体能量代谢、抗氧化应激、减少Aβ产生等来实现对AD的潜在治疗作用。
关键词:阿尔茨海默病;补肾活血;针刺;SAMP8小鼠;杏仁核;蛋白质组学
DOI:10.3969/j.issn.1005-5304.2018.03.013
中图分类号:R245 文献标识码:A 文章编号:1005-5304(2018)03-0058-06
Abstract: Objective To observe the effects of Bushen Huoxue acupuncture method on amygdaloid protein expression in SAMP8; To explore the potential target protein for acupuncture treatment of Alzheimer disease (AD). Methods Thirty six-month-old male SAMP8 mice were randomly divided into acupuncture group and control group, 15 mice in each group. Acupuncture group selected Baihui (GV20), Shenshu (BL23), Geshu (BL17) and Xuehai (SP10) to intervene. The control group was given the same time to catch and stimulate. After 8 weeks, the amygdala was extracted and the differential expression protein spots were identified by proteomic techniques. Results Compared with control group, acupuncture group eventually identified 9 differential expression protein spots, of which 6 up-regulated and 3 down-regulated. According to the relevant information provided in the protein database, the main function of differential expression proteins involved in the mitochondrial energy metabolism, oxidative stress, and production of Aβ. Conclusion Bushen Huoxue acupuncture method can regulate multiple protein expressions in amygdala, suggesting that it may be through improving mitochondrial energy metabolism, oxidative stress, reducing production of Aβ to realize the potential therapeutic effects on AD.
Keywords: Alzheimer disease; Bushen Huoxue; acupuncture method; SAMP8 mice; amygdala; proteomics
阿尔茨海默病(Alzheimer disease,AD)是最常見的痴呆类型之一,也是最常见的神经变性疾病,以记忆力减退、认知功能障碍及人格改变为主要临床表现,其病理特征是β-淀粉样蛋白(Aβ)脑内异常沉积形成的老年斑、Tau蛋白过度磷酸化导致的神经元纤维缠结以及神经元的广泛丢失。AD具体发病机制目前尚不明确。研究发现,在AD中,杏仁核是最容易受累,也是Aβ最早沉淀的部位之一[1-2],磁共振也发现AD患者杏仁核以每年3.79%的速度萎缩[3],与此同时,杏仁核体积的下降与认知功能损害有关[4-5]。SAMP8小鼠是日本竹田俊男教授经过20代以上的近亲交配形成遗传背景和老化特征稳定的模型,表现快速老化症状[6],它在早期阶段就开始出现为与年龄相关的记忆力和学习能力的下降[7],AD的症状和特征性病理表现如Aβ沉积、tau蛋白异常磷酸化和神经元的损失也已证实在SAMP8小鼠中同样存在[8]。因此,SAMP8小鼠是较为理想的AD动物模型[9]。
近年来,蛋白质组学技术越来越成熟,可用于大规模蛋白质间相互作用的研究,使其在寻找药物治疗靶点上得到广泛应用,但AD与杏仁核的关系及针刺干预罕见报道。为此,本研究采用蛋白质组学方法,观察补肾活血针刺法干预AD模型SAMP8小鼠后杏仁核蛋白组学表达的变化,寻找治疗SAMP8小鼠的潜在靶点蛋白,为补肾活血针刺法治疗AD奠定基础。
1 材料与方法
1.1 动物及分组
6月龄雄性SAMP8小鼠30只,清洁级,体质量20~25 g,天津中医药大学第一附属医院动物实验中心,动物合格证号0004678。适应性喂养1周后,将30只SAMP8小鼠按照随机数字表分为针刺组和对照组,每组15只。小鼠均饲养于垫锯木屑的饲料笼中,动物房内温度18~22 ℃,相对湿度40%~50%,保证充足的光照和通风,自由摄食饮水。本实验经中南大学湘雅三医院实验动物伦理委员会的批准[批准号LLSC(LA)2014-028]。实验过程中操作按照科技部2006年颁布的《关于善待实验动物的指导性意见》标准进行。
1.2 干预
针刺组选取“百会”“血海”“肾俞”“膈俞”,“百会”向后平刺3~5 mm,“血海”“肾俞”直刺2~3 mm,“膈俞”以80°角斜向上刺2~3 mm,其中血海、肾俞、膈俞先刺激左侧穴位,次日再刺激右侧,交替进行,小鼠穴位定位以及针刺深度参照《实验针灸学》中的“动物针灸穴位图谱”[10]。进针后,补泻手法参考针刺手法量学标准[11]:“血海”“膈俞”施捻转泻法,施针幅度180~360°,施针频率50~60次/min;“肾俞”“百会”施捻转补法,施针幅度60~90°,施针频率120~150次/min,运针1 min,留针10 min。对照组小鼠进行与针刺组相同时间、相同程度捉抓刺激。各组每日做相应处理1次,第7日暂停1次,连续干预8周。
1.3 主要试剂与仪器
蛋白提取试剂盒(南京建成生物工程研究所),BCA蛋白浓度测定试剂盒(碧云天生物科技研究所),复合双向凝胶电泳试剂(Amresco),复合质谱鉴定试剂碳酸氢铵(Sigma)。Imagescanner扫描仪(型号ImagescannerⅡ),Image Master 2D platinum 5.0凝胶图像分析软件(Bio-Rad),Voyager-DE STR 4307 MALDI-TOF-MS质谱仪(Applied Biosystem),Mascot MS/MS数据库查询软件(Matrixscience)。0.25 mm×13 mm华佗牌针灸针,苏州医疗用品厂有限公司。
1.4 杏仁核蛋白提取
针刺干预8周后,10%水合氯醛(300 mg/kg)麻醉小鼠,断颈处死,将小鼠全脑完整取出,置于小鼠脑模具(深圳瑞沃德)中,参考小鼠脑立体定位图谱定位[12],取出杏仁核组织,用蛋白提取试剂盒分离并纯化杏仁核蛋白质,将纯化的杏仁核蛋白质离心,超声破碎,再离心提取杏仁核蛋白质团块,-80 ℃冰箱保存备用。
1.5 双向凝胶电泳
将2组小鼠杏仁核总蛋白质参照Gorg A等[13]介绍的方法各进行3次双向凝胶电泳分离,经银染后得到背景清晰、分辨率高、重复性好的2-DE图谱各3块。使用ImageMaster 2D platinum 5.0软件对图谱进行图像分析,将识别获得的蛋白质点的面积、灰度等数据拟合成一张新的凝胶,在拟合凝胶图谱的基础上对各胶进行匹配分析。
1.6 质谱分析与蛋白质鉴定
将蛋白质点从凝胶上切割下来后,置于1.5 mL Eppendorf管中,制备好的样品在MALDI-TOF-MS质谱仪上分析,在联网状态下应用Mascot MS/MS数据库查询,输入包含肽质量指纹数据*.DAT的文件,软件自动链接http://www.matrixscience.com网站,返回查询结果。
2 结果
2.1 双向凝胶电泳结果
每张胶片得到>1000个蛋白质点,经过分析发现绝大部分蛋白质点在相同位置上丰度是一致的,通过ImageMaster 2D platinum 5.0软件对凝胶图谱进行分析发现,针刺组与对照组间有9个差异点(差异蛋白质点选取标准是为蛋白质的差异表达上升或者下降2倍以上且至少同时出现在3次不同的实验中),与对照组比较,针刺组表达上调的6个,表达下调的3个。详见图1、图2。
2.2 质谱分析及蛋白质鉴定结果
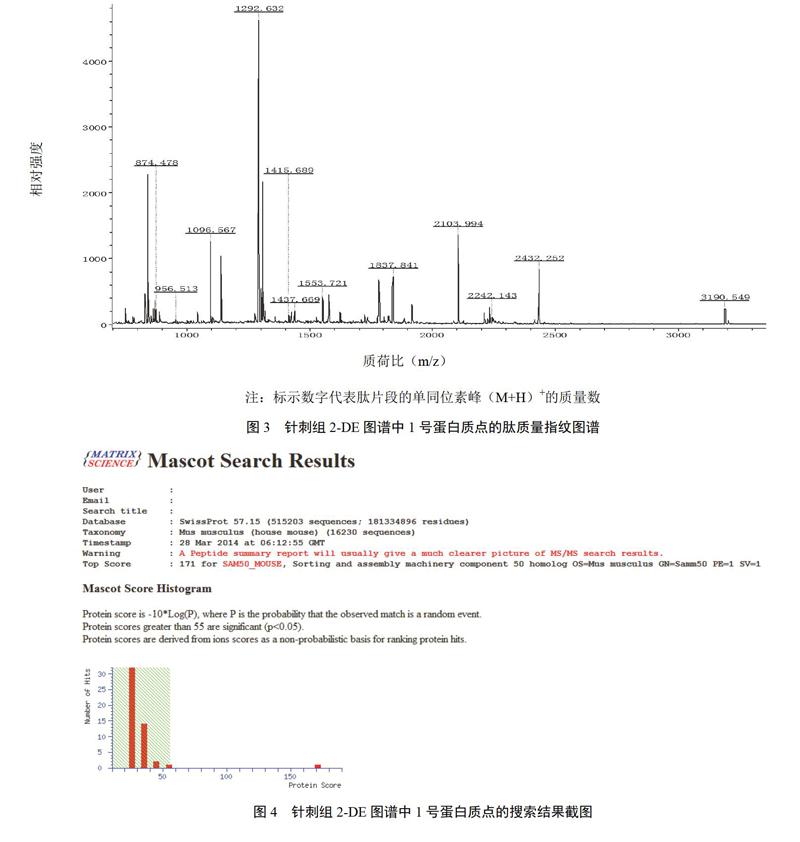
从针刺组中选定有待分析的差异蛋白质点后,采用Ultraflex III TOF/TOF质谱仪对差异蛋白质点进行初步鉴定,测得各自肽质量指纹图谱(以1号编号蛋白为例,见图3)。将获得的蛋白质点肽质量指纹图谱用软件flex Analysis过滤基线峰、识别信号峰。
利用BioTools软件搜索uniprot数据库,通过蛋白质点肽质量指纹谱与蛋白质数据库的比较来鉴定蛋白质,得到Mascot得分(以1号编号蛋白为例,搜索到出的蛋白质Mascot得分为171分,说明结果鉴定可靠,见图4)。
鏈接http://www.matrixscience.com网站搜索蛋白质点肽质量指纹图谱的匹配结果见图5。其中匹配分数≥55的蛋白质9个,功能涉及线粒体能量代谢、氧化应激、Aβ产生等方面,包括序列装配结构组件50同系物(SAM50)、细胞色素b5(CYB5B)、星形胶质蛋白(GFAP)、NAD依赖去乙酰化酶2(SIRT2)、核不均一核糖核蛋白K(hnRNP K)、核不均一核糖核蛋白H2(hnRNP H2)、硫氧还蛋白1(TRX1)、原肌球蛋白1(TPM1)、脂筏蛋白(FLO1)。详见表1。
3 讨论
AD属中医学“痴呆”“愚痴”等范畴。AD发病的主要中医病理基础是肾虚血瘀,并贯穿AD发病的全过程。本实验前期研究表明,补肾活血针刺法能有效提高AD患者的记忆力、改善认知功能和日常生活自理能力[14];同时能使AD模型SAMP8小鼠水迷宫实验逃避潜伏期缩短,改善其学习记忆能力[15-16]。补肾活血针刺法取肾俞、百会、血海、膈俞为基本穴位,其中肾俞为肾之背俞穴,有补肾助阳之功;百会处于人之头顶,在人体的最高处,手足三阳经及督脉的阳气在此交会,又名三阳五会穴,三阳指手足三阳经,五会指五脏六腑的气血皆会于此,故刺激百会有补肾通脑、开窍增智、行气活血之功;血海为血证要穴,膈俞为八会穴之血会,两者配合,活血通脉之功尤效。以上诸穴配合,共奏补肾活血之功。
杏仁核位于海馬的前方和海马旁回沟的深部,侧脑室下角的前方。它与内侧颞叶、前额叶皮层、前扣带回、丘脑和下丘脑等许多脑区有着广泛的纤维联系。大量研究表明,杏仁核在AD的发病过程中扮演了极为重要的角色,在早期AD患者中,杏仁核明显萎缩且萎缩程度和疾病症状严重程度密切相关[17-20]。杏仁核参与了认知加工过程,能够调节记忆的编码、巩固和提取;另外,杏仁核可能在AD的非认知性精神行为症状中起着重要作用,如AD患者常出现的焦虑、抑郁等非认知性症状与杏仁核密切相关[18]。大鼠杏仁核内注射Aβ25-35能制备出成功的类AD模型[21],这也反证了杏仁核在AD发病过程中的重要作用。因此,在AD的研究过程中,杏仁核是不可或缺的,具有重要的研究意义。
线粒体的结构和功能异常在AD的病理过程中起着重要作用[22]。SAM50对维持线粒体形态、线粒体嵴的形态学、线粒体呼吸链酶复合物至关重要[23]。SAM50适量减少可能导致线粒体形态和嵴形态改变,而SAM50的严重消耗可能影响线粒体呼吸链复合物,最终导致神经元线粒体结构功能紊乱[24]。本实验发现补肾活血针刺法能使SAM50表达上调,推测针刺可能通过调节线粒体形态结构来改善线粒体能量代谢障碍,实现对AD的治疗作用。
氧化应激被认为是AD的一个重要的上游致病因素。CYB5B是线粒体内外膜之间的主要电子传递者,参与生物体组织中一系列重要的氧化还原反应[25]。CYB5B活性下降会导致线粒体呼吸链电子传递障碍,使电子漏增多,自由基产生增多,引起大量的活性氧在体内聚集,诱发氧化应激,导致细胞死亡。TRX1是体内重要的抗氧化蛋白,能清除过量的活性氧及过氧化氢[26],减慢超氧化物歧化酶的下降,同时能修复过氧化的巯基蛋白,减轻氧化应激的损伤。补肾活血针刺法能上调CYB5B、TRX1的表达,推测其可能是通过减少自由基产生、抗氧化发挥作用。
Aβ作为老年斑的主要组成成分,在AD的发病中起着极为重要的作用。FLO1是β-淀粉样蛋白前体产生Aβ的平台,与Aβ在脑内的沉积呈正相关;FLO1减少可使Aβ产生减少,降低Aβ的毒性作用。GFAP在激活状态下可以产生Aβ[27],而GFPA广泛激活是AD早期的一种表现[28]。GFAP是神经系统中含量最丰富的细胞,其产生的Aβ在脑内的聚集和老年斑的形成过程中起着重要作用[29]。本实验发现补肾活血针刺法下调FLO1、GFAP的表达量,提示补肾活血针刺法防治AD的作用可能是通过减少Aβ的产生来实现的。
综上,本实验采用比较蛋白质组学方法发现,通过补肾活血针刺法干预能调节SAMP8小鼠杏仁核内多种蛋白质的表达,其功能涉及线粒体能量代谢、氧化应激、Aβ产生等方面,这些可能是补肾活血针刺治疗AD的潜在作用靶点蛋白。
参考文献:
[1] BRAAK H, BRAAK E, Neuropathological stageing of Alzheimer- related changes[J]. Acta Neuropathol,1991,82(4):239-259.
[2] FURUKAWA K, OKAMURA N, TASHIRO M, et al. Amyloid PET in mild cognitive impairment and Alzheimer's disease with BF-227:comparison to FDG-PET[J]. J Neurol,2010,257(5):721-727.
[3] FJELL A M, WALHOVD K B, FENNEMA-NOTESTINE C, et al. One-year brain atrophy evident in healthy aging[J]. J Neurosci,2009, 29(48):15223-15231.
[4] ROH J H, QIU A, SEO S W, et al. Volume reduction in subcortical regions according to severity of Alzheimer's disease[J]. J Neurol,2011,258(6):1013-1020.
[5] HUA Q, HE R. Alzheimer's disease-mechanisms, drug targets and alternative treatments[J]. Curr Top Med Chem,2016,16(5):470-471.
[6] TAKEDA T. Senescence accelerated mouse (SAM):a biogerontological resource in aging research[J]. Neurobiol Aging,1999,20:105-110.
[7] MORLEY J E, FARR S A, KUMAR V B, et al. The SAMP8 mouse:a model to develop therapeutic interventions for Alzheimer's disease[J]. Curr Pharm Des,2012,18(8):1123-1130.
[8] PALLAS M, CAMINS A, SMITH M A, et al. From aging to Alzheimer's disease: unveiling “the switch” with the senescence-accelerated mouse model (SAMP8)[J]. J Alzheimers Dis,2008,15(4):615-624.
[9] TAKEDA T. Senescence-accelerated mouse (SAM) with special references to neurodegeneration models, SAMP8 and SAMP10 mice[J]. Neurochem Res,2009,34(4):639-659.
[10] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2007:253-257.
[11] 卞金玲,张春红.石学敏院士针刺手法量学的概念及核心[J].中国针灸,2003,23(5):38-40.
[12] FRANKLINKB, PAXINOS G. The mouse brain in stereotaxic coordinates:third edition[M]. New York:Academic Press,2007:39-62.
[13] GORG A, OBERMAIER C, BOGUTH G, et al. The current state of two-dimensional electrophoresis with immobilized pH gradients[J]. Electrophoresis,2000,21(6):1037-1053.
[14] 朱宏,董克礼,吴岳,等.补肾活血法对阿尔茨海默病患者认知功能改善的影响[J].中国老年学杂志,2010,30(11):1493-1495.
[15] 戴思思,董克礼,朱宏,等.“补肾活血”针刺法对老年痴呆模型SAMP8 小鼠学习记忆能力和脑组织AChE活性的影响[J].上海针灸杂志,2010, 29(1):57-59.
[16] 戴思思,董克礼,朱宏,等.“补肾活血”针法对快速老化模型小鼠SAMP8学习记忆能力及海马CA1区NEP表达的影响[J].湖南中医药大学学报,2015,35(1):60-63,72.
[17] PRESTIA A, BOCCARDI M, GALLUZZI S, et al. Hippocampal and amygdalar volume changes in elderly patients with Alzheimer's disease and schizophrenia[J]. Psychiatry Res,2011,192(2):77-83.
[18] POULIN S P, DAUTOFF R, MORRIS J C, et al. Amygdala atrophy is prominent in early Alzheimer's disease and relates to symptom severity[J]. Psychiatry Res,2011,194(1):7-13.
[19] ESPANA J, GIMENEZ-LLORT L, VALERO J, et al. Intraneuronal beta-amyloid accumulation in the amygdala enhances fear and anxiety in Alzheimer's disease transgenic mice[J]. Biol Psychiatry,2010,67(6):513-521.
[20] LAIN A H, LIEBERMAN A P, PFANNL R, et al. Nodular bilateral amygdala degeneration in demented individuals[J]. Acta Neuropathol,2010,120(5):683-688.
[21] SCHIENLE A, EBNER F, SCHAFER A. Localized gray matter volume abnormalities in generalized anxiety disorder[J]. Eur Arch Psychiatry Clin Neurosci,2011,261(4):303-307.
[22] SWERDLOW R H,KHAN S M. A“mitochondrial cascade hypothesis”for sporadic Alzheimer's disease[J]. Med Hypotheses,2004,63(1):8-20.
[23] OTT C, DORSCH E, FRAUNHOLZ M, et al. Detailed analysis of the human mitochondrial contact site complex indicate a hierarchy of subunits[J]. PLoS One,2015,10(3):e0120213.
[24] OTT C, ROSS K, STRAUB S, et al. Sam50 functions in mitochondrial intermembrane space bridging and biogenesis of respiratory complexes[J]. Mol Cell Biol,2012,32(6):1173-1188.
[25] SCHENKMAN, J B, JANSSON I. The many roles of cytochrome b5[J]. Pharmacol Ther,2003,97(2):139-152.
[26] SPECTOR A, YAN G Z, HUANG R R, et al. The effect of H2O2 upon thioredoxin-enriched lens epithelial cells[J]. J Biol Chem,1988, 263(10):4984-4990.
[27] LAIRD F M, CAI H, SAVONENKO A V, et al. BACE1, a major determinant of selective vulnerability of the brain to amyloid-beta amyloidogenesis, is essential for cognitive, emotional, and synaptic functions[J]. J Neurosci,2005,25(50):11693-11709.
[28] ZHAO J, O'CONNOR T, VASSAR R. The contribution of activated astrocytes to Abeta production:implications for Alzheimer's disease pathogenesis[J]. J Neuroinflammation,2011,8:150.
[29] CARTER S F, SCHOLL M, ALMKVIST O, et al. Evidence for astrocytosis in prodromal Alzheimer disease provided by 11C- deuterium-L-deprenyl:a multitracer PET paradigm combining 11C- Pittsburgh compound B and 18F-FDG[J]. J Nucl Med,2012,53(1):37-46.
(收稿日期:2017-08-09)
(修回日期:2017-09-09;編辑:华强)

