放疗前中性粒细胞与淋巴细胞比值对食管癌患者预后的评估价值
吴 佳, 赵涤非
(江南大学附属医院 无锡市第四人民医院 放疗科, 江苏 无锡, 214000)
放射治疗是食管癌治疗的主要手段之一,但局部失败及远处转移仍常见。近年关于中性粒细胞与淋巴细胞比值(NLR)与恶性肿瘤患者预后关系的研究日渐增多,多种分子和细胞水平的研究证实了二者间的相关性。国内外通过对鼻咽癌、胃癌、结直肠癌、肝癌、乳腺癌等恶性肿瘤的前瞻性研究[1-2]发现NLR具有较高的敏感性和特异性。本研究采用回顾性研究方法,分析了食管癌患者放疗前NLR与预后的关系,现报告如下。
1 资料与方法
1.1 一般资料
收集2002年1月—2012年12月随访资料完整且在本院接受食管癌放疗的86例患者的临床资料进行回顾性分析。入组标准: ① 病理学证实为食管鳞癌; ② 未行手术治疗; ③ 无急性炎性反应和类风湿性关节炎。于放疗前1周内进行血常规检查,计算NLR。
1.2 随访及生存分析
放疗后2年内每3个月随访1次,放疗后2~5年每3~6个月随访1次,放疗5年后每年随访1次。随访内容包括病史采集、肿瘤标志物检查、上消化管造影、胸腹部CT、胃镜等。生存时间的起点为病理确诊时间,终点为患者复发或死亡时间。末次随访日期为2017年10月31日。
1.3 统计学方法
采用SPSS 19.0统计软件。采用χ2检验和Fisher精确检验比较分类变量,t检验比较正态分布的计量资料。采用Kaplan-Meier法进行生存分析,计算总生存及无病生存,并Log-rank法检验; 多因素分析通过Cox比例风险回归模型完成,确定影响预后的独立因素。P<0.05为差异有统计学意义。
2 结 果
本研究以NLR平均值作为截点,统计得出NLR平均值为2.56, 将NLR≥2.56定义为NLR升高。NLR与临床病理特征的关系: 86 例食管癌患者中,男53例,女33例; 年龄44~76岁,中位年龄65岁,平均年龄65岁。放疗前低NLR组与高NLR组的年龄、性别比较均无显著差异(P>0.05); 而TNM分期、肿瘤分化程度及复发情况的差异有统计学意义(P<0.05或P<0.01)。放疗前高NLR组患者的分期较晚,肿瘤分化程度较低,复发风险也可能相对较高。见表1。
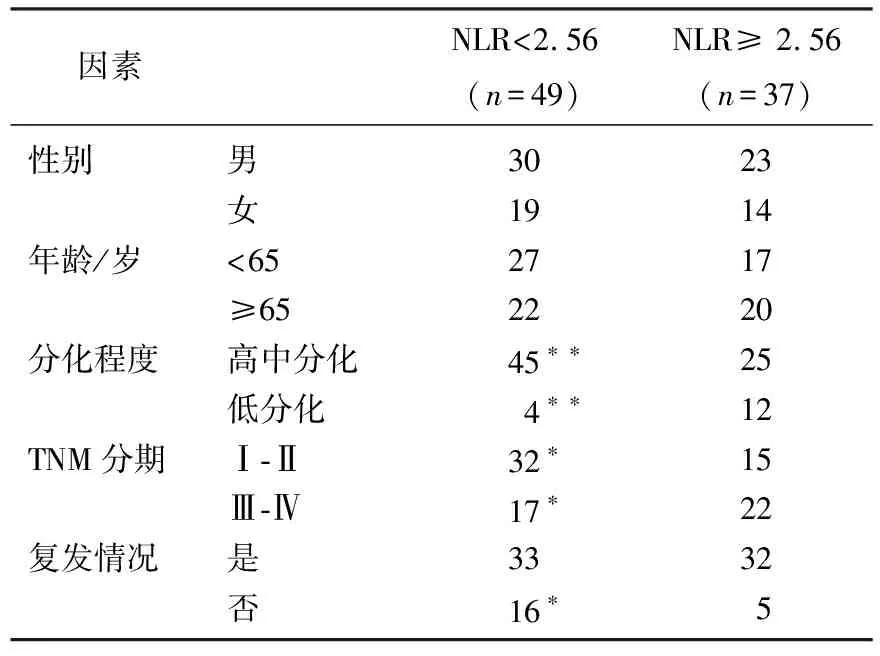
表1 不同中性粒细胞与淋巴细胞比值组食管癌患者的临床病理特征
与NLR≥ 2.56比较, *P<0.05, **P<0.01。
总生存的单因素及多因素分析: 中位生存时间为29个月, 1、3与5年总生存率分别为75.0%、40.8% 和 22.5%。单因素分析结果表明, NLR、肿瘤分化程度、TNM分期及化疗与食管癌患者放疗后总生存率相关(P<0.05)。放疗前高NLR组患者的3、5年总生存率分别为32.3%、14.0%, 放疗前低NLR组患者的3、5年总生存率分别为52.8%、33.2%。多因素分析结果表明, NLR、肿瘤分化程度、TNM分期及化疗是食管癌放疗后总生存的独立预后影响因素(P<0.05)。无病生存的单因素及多因素分析: 中位生存时间为14个月。单因素分析结果表明, NLR、肿瘤分化程度、TNM分期及化疗与食管癌患者放疗后无病生存率相关(P<0.05)。放疗前高NLR组患者的1、3年无病生存率分别为45.0%、18.3%, 放疗前低NLR组患者的1、3年无病生存率分别为72.8%、44.9%。多因素分析结果表明, NLR、肿瘤分化程度、TNM分期及化疗是食管癌患者放疗后无病生存的独立相关因素(P<0.05)。见表2。
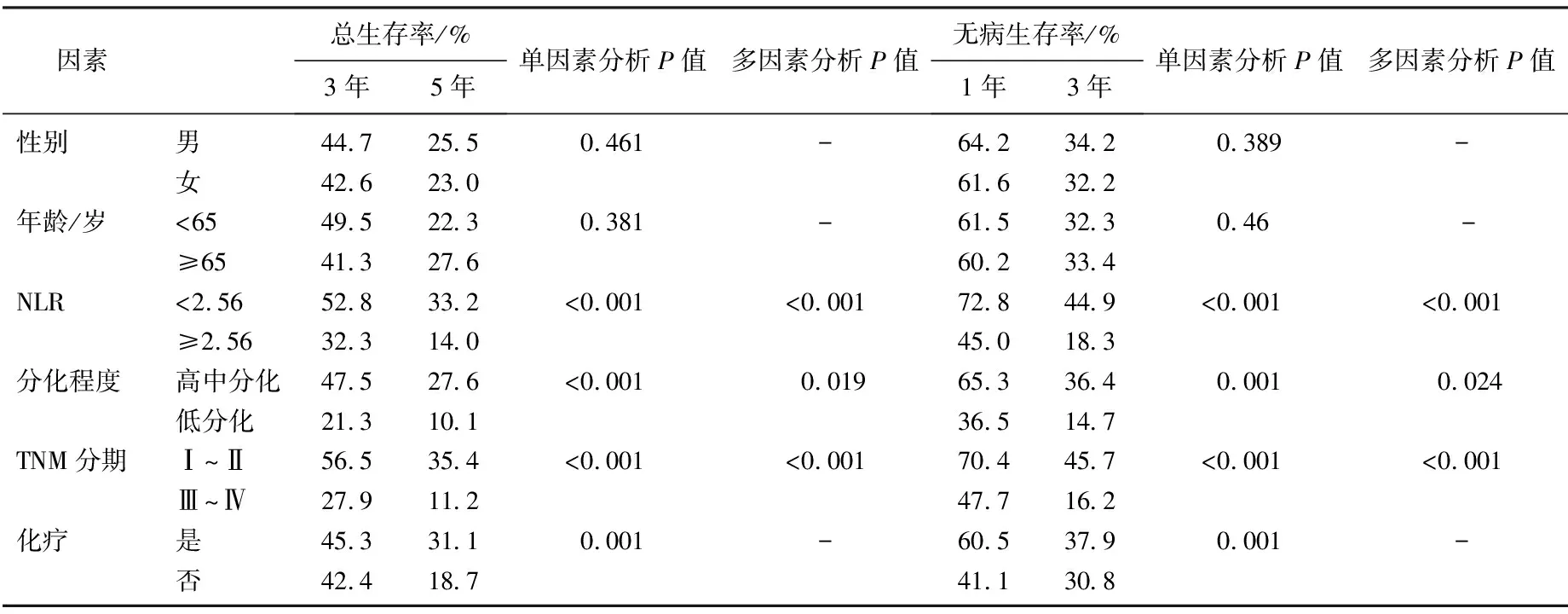
表2 食管癌放疗后患者总生存和无病生存的单因素和多因素分析
3 讨 论
通过对肿瘤免疫与分子机制进行研究,认为炎性反应是影响肿瘤患者预后的重要因素。中性粒细胞计数增加和(或)淋巴细胞计数绝对或相对减少导致了NLR的升高。目前中性粒细胞参与恶性肿瘤进展的机制尚不明确。Queen[2]研究表明,在肿瘤周围组织中常分布着中性粒细胞,其分泌了大量血管内皮生长因子,可提供适宜的微环境促进了肿瘤局部浸润及转移。同时中性粒细胞可能参与诱导抑癌基因的突变和受体、补体及免疫球蛋白的降解,对肿瘤细胞的增殖和分化具有促进作用。而淋巴细胞则在肿瘤细胞的破坏与凋亡过程具有重要作用。其中CD4+T淋巴细胞分泌干扰素γ, 对肿瘤细胞产生直接的细胞毒性作用; 抗原递呈细胞提供了双刺激信号,激活了CD8+T淋巴细胞,聚集至肿瘤部位,发挥特异性细胞毒效应,包括释放细胞毒性物质,产生破坏细胞膜、降解DNA或诱导细胞凋亡等作用[3]。NLR升高可能增强了肿瘤的侵袭性,同时抑制了机体免疫反应,提示肿瘤预后不良。
TNM分期系统目前仍是食管癌预测预后的金标准,但是该分期系统对大体解剖的依赖性较大,在预后评估方面存在诸多缺陷,对患者做出精准化预测比较困难。Sato等发现食管癌化疗前NLR≥2.2,淋巴结转移风险将明显增加,而化疗的疗效可能明显降低[4]。Sharaiha[5]的研究显示, NLR升高可作为食管癌患者根治术后的独立预后指标,NLR升高者无病生存期和总生存期均较短。苏子剑等[6]对345例食管癌手术患者的回顾性调查也发现了同样的结果,进一步分层研究结果表明NLR对于不同分期、化疗与否及复发与否的食管癌患者均显示出了良好的预测价值。Absenger[7]对504例肿瘤患者的研究发现, NLR在肿瘤复发时间、总体生存率的预测中具有重要作用。许多文献中均证实了术前NLR可作为评价食管癌患者独立预后指标,并且具有较高的敏感性及特异性,但对接受放疗的食管癌患者类似研究并不多见。
本研究回顾性分析了82例食管癌放疗患者,发现放疗前高NLR组患者存在着分期晚、肿瘤分化程度低、复发转移风险高的特点,单因素分析结果表明,放疗前NLR升高导致患者总生存率及无病生存率降低,提示预后较差,多因素分析结果表明NLR是食管癌患者放疗后出现复发或转移的独立预后因素。目前放疗同期是否需要化疗尚无定论, Sato的研究表明治疗前NLR高及淋巴结转移是病理应答不良的独立影响因素, NLR<2.2组病理应答阳性为56%, 而NLR≥2.2组病理应答阳性仅为21%,因此认为高NLR组化疗疗效不佳,但该研究样本量较小,临床价值有限。本研究发现放疗联合化疗组总生存及无病生存均优于单纯放疗组,但本研究中部分化疗患者一般情况相对较好,治疗耐受性相对较强,可能影响了随访的结果,所以NLR升高者同步放化疗的疗效有待进一步的研究。
放疗在食管癌综合治疗中具有重要地位,而放射敏感性与患者预后密切相关,放射敏感性高者生存时间明显延长。所以准确评估食管癌的放射敏感性,由此个体化治疗方案是食管癌放射治疗研究的重要方向。李晓惠等通过对鼻咽癌放射敏感性的研究发现,随着NLR逐渐升高,鼻咽癌患者放射敏感性逐渐下降[8]。但目前尚无NLR和食管癌患者放射敏感性相关性的报道,是否可依据NLR筛选出不同放射敏感性的食管癌患者,以制定精确化个体化的放疗方案,以提高放疗疗效,减轻不良反应,还有待多中心、大样本研究来验证。

