106例溃疡性结肠炎临床病理学特征分析
初祯
作者单位:110000 沈阳市肛肠医院
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病(inflammatory bowel disease,IBD)的一种主要表现形式。目前UC的发病机制尚不十分明确,认为是遗传、感染、肠黏膜屏障功能失调及免疫因素(自身抗体、细胞凋亡、细胞因子、黏附分子、Toll受体等)共同作用的结果[1]。其临床主要表现为腹痛、腹泻、黏液脓血便、体质量减轻,病程迁延不愈,活动期和缓解期交替发生。目前UC的诊断尚无金标准,主要是结合病史、临床症状、内镜、病理及实验室检查,并排除感染性及非感染性肠炎而做出诊断。肠镜下UC病变按累及的最大范围可分为直肠炎、左半结肠炎和广泛结肠炎[2]。UC患者最严重的并发症即为癌变,结直肠黏膜不典型增生作为此癌变的基础病变正逐渐引起广泛关注[3]。本文收集我院2010年1月至2017年12月收治的106例UC患者的临床及病理学资料,进行回顾性分析,分析其临床病理特征,使临床医务人员对UC有更深的认识,为临床的诊断及治疗提供帮助。
1 资料与方法
1.1 研究对象 我院2010年1月至2017年12月收治的106例诊断为UC的住院患者,均有详尽的肠镜及病理学资料。符合纳入标准的UC患者106例,其中男性60例(56.60%),女性46例(43.40%),男女比例1.30∶1;年龄18~76岁,平均年龄(47.02±13.45),发病高峰年龄段为45~59岁。
1.2 纳入标准 符合“2012年中华医学会消化病学分会炎症性肠病协作组”的诊断标准。
1.3 剔除标准 临床及病理学资料不完整者;诊断不明确者。
1.4 内镜诊断标准 黏膜血管纹理模糊、紊乱或消失、充血、水肿、质脆自发或接触出血和脓性分泌物附着,亦常见黏膜粗糙、呈细颗粒状;糜烂或溃疡;结肠袋变浅、变钝或消失以及假息肉和黏膜桥等。
1.5 病理组织学诊断标准 ①活动期:黏膜表面糜烂,浅溃疡形成;固有膜内重度弥漫性急慢性炎细胞浸润;有隐窝脓肿和隐窝周围炎;隐窝结构的改变等。②缓解期:黏膜糜烂或溃疡愈合;固有膜内中性粒细胞浸润减少或者消失,淋巴细胞、浆细胞浸润;淋巴滤泡形成;隐窝结构改变;腺体增生,异型增生(上皮内瘤变)以及潘氏细胞化生(结肠脾曲以远)。
1.6 分组情况
1.6.1 年龄分组 青年人:≤44岁,中年人:45~59岁,老年人:≥60岁。
1.6.2 病程分组 根据相关文献,将病程分为:<1年,1~5年,>5~10年,>10~20年,>20年。
1.6.3 临床类型分组 初发型:指首次发作,既往无UC发作史;慢性复发型:指发作期与缓解期交替出现,临床最多见;慢性持续型:症状持续,间以症状加重的持续发作;爆发型:急性起病,病情严重,全身毒血症状明显,可伴中毒性巨结肠、肠穿孔、败血症等并发症。
1.6.4 严重程度分组 参照Witts标准,轻度:腹泻<4次/d,便血轻或无,无发热,贫血无或轻,血沉正常;中度:介于轻度与重度之间;重度:腹泻>6次/d,有明显黏液脓血便,体温>37.5℃,脉搏>90次/min,血红蛋白<100 g/L,血沉>30 mm/h。
1.6.5 病变范围分组 采用蒙特利尔分型,直肠型(proctitis,E1):局限于直肠,未达乙状结肠;左半结肠型(left-sided,E2):累及左半结肠(脾曲以远);广泛结肠型(extensive,E3):广泛病变累及脾曲以近乃至全结肠。
1.7 统计学方法 全部数据采用SPSS 17.0统计软件处理,计量资料以(±s)表示,采用t检验,计数资料以率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同年龄组性别构成情况比较(表1) 106例UC患者不同年龄组男女之间差异无统计学意义(P>0.05)。
2.2 不同病程年龄组构成情况比较(表2) 106例UC患者中,病程<1年的67例(63.21%),1~5年的31例(29.25%),>5~10年的1例 (0.94%),>10~20年的5例(4.72%),>20年的2例(1.89%),病程主要是<1年及1~5年;不同病程分组中各年龄组构成差异无统计学意义(P>0.05)。

表1 不同年龄组性别构成情况比较[n(%)]

表2 不同病程年龄组构成情况比较[n(%)]
2.3 106例UC患者临床分型特征(表3) 106例UC患者中,主要为初发型(56.60%)及慢性复发型(34.91%),病情以轻中度为主(58.49%,30.19%),广泛结肠型E3占大多数(43.40%)。

表3 106例UC患者临床分型特征
2.4 106例UC患者临床表现(表4) 106例UC患者中,主要临床表现为黏液脓血便(80.19%)、腹泻(76.42%)、腹痛(62.26%)及里急后重(43.40%),其他症状相对较少见。

表4 106例UC患者临床表现
2.5 106例UC患者内镜下表现(表5) 106例UC患者中,镜下所见主要为充血水肿(86.79%)和糜烂溃疡(64.15%),其次为假息肉(36.79%)和黏膜粗糙颗粒感(28.30%),脓性分泌物、自发性出血、血管纹理模糊或消失、肠腔狭窄、结肠袋变浅或消失、黏膜瘢痕形成、肠管僵硬、皱壁结构模糊或消失及黏膜桥均较少见。
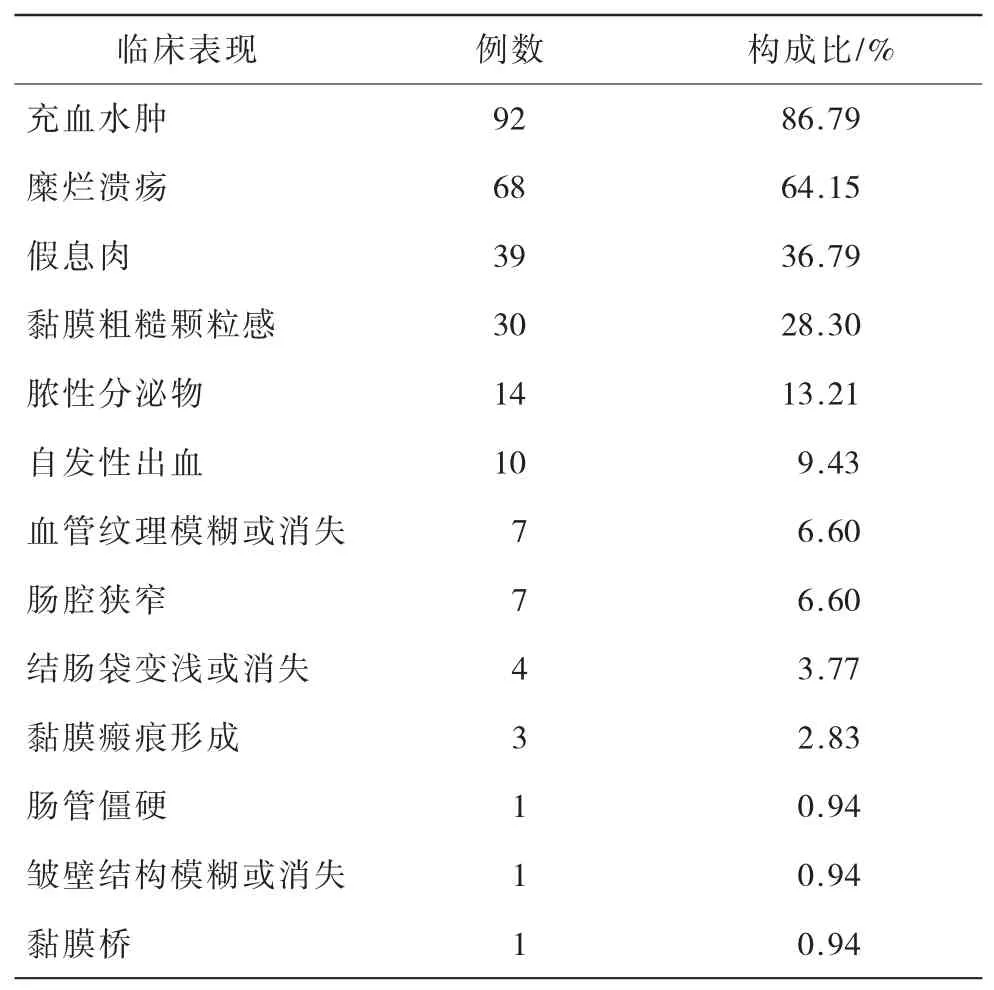
表5 106例UC患者内镜下表现
2.6 106例UC患者病理结果(表6) 106例UC患者中,主要病理表现为黏膜急慢性炎(82.08%)、溃疡形成(21.70%)及腺瘤性息肉(15.09%),其中病理检出不典型增生患者25例(23.58%)。
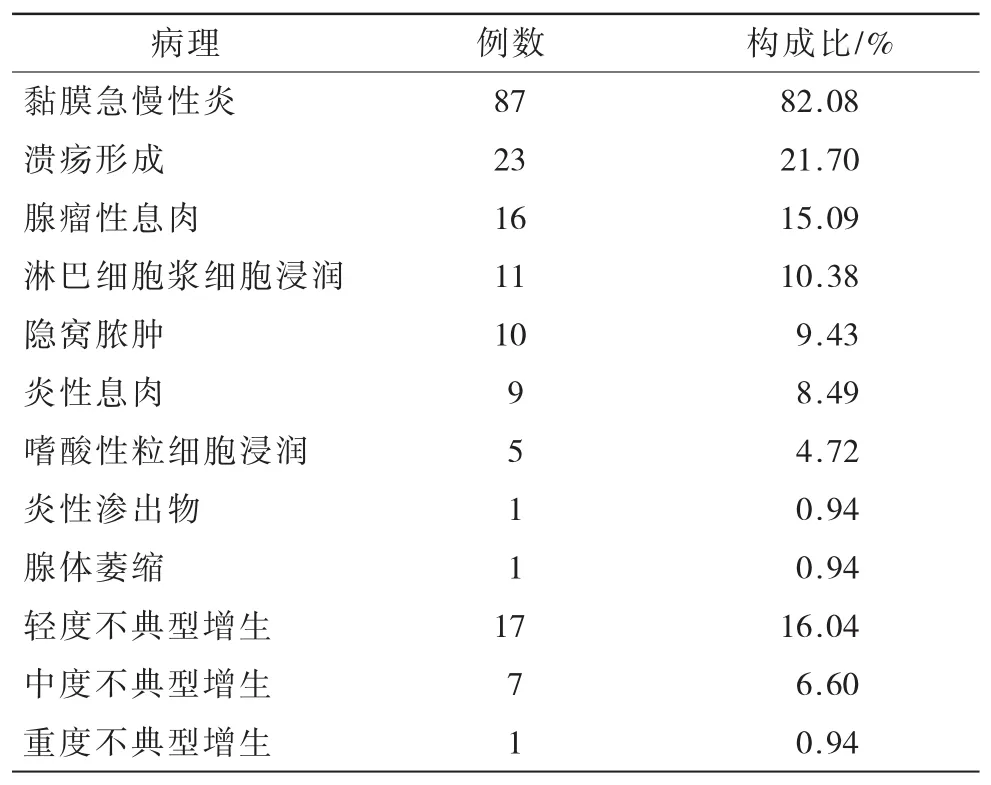
表6 106例UC患者病理结果
3 讨论
UC是西方国家的常见病,既往报道我国相对少见,近30年UC在我国的发病率不断上升,但仍低于西方国家[4]。目前认为UC的发生是具有遗传易感性的个体在环境、微生物和肠道免疫等因素共同作用下的结果[5]。目前的病因学研究包括①坏境和遗传因素:“卫生假说”指出个体在儿童期时若生活中接触微生物抗原较少,他的免疫系统将得不到锻炼从而防御能力较弱,不能够应对日后生活中的新抗原,不能产生高效的免疫应答以清除攻击自身的抗原。②微生物因素:包括致病原和肠道共生菌。③免疫机制:包括肠黏膜屏障、免疫细胞和细胞因子的参与。促炎因子增多,抗炎因子减少是导致肠道黏膜慢性炎症的主要因素[6]。
随着我国对UC流行病学研究的开展,进一步表明我国UC发生率呈上升趋势。刘艳迪等[7]报道UC患者中男性多于女性,中国炎症性肠病协作组进行的大样本研究结果显示男女之比为1.34∶1[8]。本文男女比例1.30∶1,所得结果与国内研究基本一致。
西方国家UC发病年龄多呈双峰状分布,我国患者年龄分布与西方国家不同,我国大型流行病学研究调查结果报道我国UC发病高峰年龄在40~49岁,且呈单峰分布,可能与种族、基因、饮食结构、生活环境等不同有关[9]。本文中,发病高峰年龄段为中年组,未再进一步细化,可在随后的工作中继续完善,为UC的研究提供更详尽的年龄数据。
多项研究表明在UC的临床类型中,初发型及慢性复发性多见,爆发型最少见[10-11]。本文中,主要为初发型(56.60%)及慢性复发型(34.91%),病情以轻中度为主(58.49%,30.19%),出现1例爆发型,与上述研究基本相符。初发型多见可能与生活水平及人们健康意识的提高有关;慢性复发型多见与本病特点相关,易受多种因素影响且具有终身复发倾向,加上患者医从性差,易导致病情反复。UC分为轻度、中度、重度三种类型,在临床上轻度最常见,起病缓慢,症状轻微,多局限在直肠及乙状结肠;重度较少见,起病急,症状重,多伴全身症状、肠外表现及并发症,可累及全结肠;中度则间于两者之间。本文中病情以轻中度为主(58.49%,30.19%),广泛结肠型E3占大多数(43.40%)。这与其他研究基本一致[12]。别文华研究指出UC主要以腹泻、黏液脓血便、腹痛为临床表现[13]。本文研究结果与之类似。
UC易被误诊为慢性结肠炎,故内镜结合病理检查在UC的诊断中具有非常重要的意义。本文中镜下所见主要为充血水肿(86.79%)和糜烂溃疡(64.15%),其次为假息肉(36.79%)和黏膜粗糙颗粒感(28.30%),脓性分泌物、自发性出血、血管纹理模糊或消失、肠腔狭窄、结肠袋变浅或消失、黏膜瘢痕形成、肠管僵硬、皱壁结构模糊或消失及黏膜桥均较少见。腺瘤性息肉具有高度恶变性,不典型增生是上皮细胞的异常增生,其是癌前病变的形态学表现。对此类患者进行肠镜监测和多点、多部位病理活检具有非常重要的意义。
本文对106例UC患者临床及病理学资料进行了简单的回顾性分析,资料有限,且并未逐一比较各因素的相关性,有待于进行更进一步的研究,加深对UC的认识,为UC的早期诊断及治疗提供帮助。

