蒲葵子甲醇提取物抗鼻咽癌的实验研究
许望纯 朱贾娴 李祖国
作者单位:510515 火箭军广州疗养院二科(许望纯);510515 南方医科大学病理学系(朱贾娴,李祖国)
鼻咽癌是常见的恶性肿瘤之一,好发于我国南方各省,其发病率为男性26.1/10万,女性10.1/10万,严重危害人民身体健康[1]。目前对鼻咽癌的治疗方法主要是放疗或以放疗为主的综合性治疗[2],效果虽然满意,但仍存在严重的放疗反应及毒副作用,并且需支付昂贵的医疗费用,从而使部分患者难以接受治疗。因此,开发研制高效、低毒、廉价,能同时预防和治疗鼻咽癌的中药制剂,一方面能促进鼻咽癌高发地区人民的身体健康,同时对发展传统制药产业有着重要推动作用,具有极大的社会和经济意义。
蒲葵子为棕榈科植物蒲葵的种子,性平,淡,味甘涩,治外伤出血,选方治疗各种癌症[3]。广东省江门、新会、四会部分居民采用民间流传秘方自行采集蒲葵子治疗中晚期鼻咽癌,取得良好的治疗效果。广西医科大学附属肿瘤医院研制的金浦抑瘤片由金不换、蒲葵子、高硒螺旋藻、绞股蓝等组成,经临床应用证明具有良好的抗鼻咽癌作用[4]。我们曾对经病理诊断确诊为鼻咽癌低分化鳞状细胞癌的20例患者采用放射治疗加蒲葵子为主的中药治疗,随访3年,无一例复发。另外2例老年鼻咽癌晚期患者,未行放射治疗而仅服用蒲葵子,随访3年,癌肿有消退。从临床实践中观察到,蒲葵子中含有有效的抗鼻咽癌药用成分,且患者服用蒲葵子未见明显毒副作用。本研究将利用蒲葵子的甲醇提取物,以鼻咽癌细胞株C666和5-8F为对象进行系统的体外抗鼻咽癌活性实验,旨在确认其抗鼻咽癌的作用效果,初步探讨其抗癌的机制,并为受试提取物研制成为抗鼻咽癌的中药有效制剂提供实验依据。
1 材料
1.1 细胞株 人鼻咽癌C666和5-8F细胞均购自美国ATCC公司,由本实验室保存。用含有8%的胎牛血清的RPMI1640培养基置于37℃ 5%CO2饱和湿度条件下培养备用。
1.2 药物与试剂 蒲葵子采自南方医科大学校园及解放军广州疗养院院区绿化植物蒲葵,将蒲葵子自然晾干后粉碎,经甲醇萃取为蒲葵子甲醇提取物。RPMI1640培养基购于美国Gibco公司,胎牛血清购于美国Corning公司。CCK8试剂盒购于上海翊圣生物科技有限公司。荧光二抗及DAPI购于北京中杉金桥生物技术有限公司。Caspase3和P21抗体及二抗购于美国proteintech公司。Caspase7抗体购于美国ABclonal公司。Annexin V-FITC/PI细胞凋亡检测试剂盒购于江苏凯基生物技术股份有限公司。其余试剂均为国产分析纯。
2 方法
2.1 蒲葵子甲醇提取物(LCME)的制备 称取5 g蒲葵子甲醇萃取物置于锥形瓶,加入100 mL无水甲醇,置于电炉上加热至沸腾,持续20 min。过滤,回收滤渣,再加入100 mL无水甲醇煮沸20 min,重复3次。合并滤液,倒入蒸发皿中加热蒸发至糊状物,室温冷却后得到1.35 g浸膏,产率27%。将浸膏溶于PBS中,制成不同浓度LCME的PBS溶液,过滤,经高温高压处理后可用于处理细胞。
2.2 细胞培养 人鼻咽癌株C666和5-8F用含体积分数为8%的胎牛血清的RPMI1640培养液,在37℃、5%CO2、饱和湿度条件下培养,取对数生长期细胞进行实验。
2.3 CCK8法检测 C666和5-8F细胞中LCME的IC50值取对数生长期的细胞接种于96孔板中,每孔1 000个细胞,每孔体积200 μL,贴壁后加入LCME处理细胞,浓度设为0、25、50、100、200、400、500 μg/L 7个组,每个浓度组设6个平行孔,培养48 h。实验终止前2 h每孔加入20 μL CCK8试剂,再培养2 h后用酶标仪在450 nm测定每孔的吸光度(OD450)值。计算细胞生长抑制率=(空白对照组OD450值-药物处理组OD450值)/空白对照组OD450值×100%。绘制药物浓度-生长抑制率曲线,并计算IC50值。
2.4 细胞形态学观察 取对数生长期的C666和5-8F细胞,分别加入130 μg/L和220 μg/L的LCME处理48 h,用普通光学显微镜分别观察两株细胞加药处理前后的生长情况并摄片。
2.5 免疫荧光共聚焦检测细胞中Caspase3蛋白的表达差异 取对数生长期的C666和5-8F细胞接种于共聚焦小皿,分别用浓度为130 μg/L和220 μg/L的LCME处理,培养至适宜密度,弃去培养液,PBS洗涤3次,5 min/次;用4%多聚甲醛室温下固定30 min后PBS洗涤3次,5 min/次;用0.5%Triton X-100室温下破膜10 min,PBS洗涤3次,5 min/次;10%正常山羊血清室温下封闭30 min后稀释兔抗Caspase3抗体,4℃孵育过夜;次日室温孵育30 min后PBS洗涤3次,5 min/次;在暗室中加稀释的山羊抗兔IgG/FITC,孵育30 min后PBS洗涤5次,5 min/次;避光加DAPI,孵育10 min后PBS洗涤3次,5 min/次;激光共聚焦显微镜观察并摄片。
2.6 平板克隆形成实验 取对数生长期的C666和5-8F细胞接种于六孔板,每孔300个细胞,每孔体积2 mL,贴壁后加入LCME处理细胞:C666细胞中LCME浓 度设为0、65、130、195 μg/L 4个 组 ,5-8F细胞中LCME浓度设为0、110、220、330 μg/L 4个组,每个浓度组设3个复孔,培养7 d。PBS洗涤3次,5 min/次,用4%多聚甲醛固定20 min后用PBS洗涤3次,5 min/次;吉姆萨染色液染色30 min,流水冲洗15 min,空气干燥。计数形成的细胞克隆数,并计算克隆形成率=克隆数/接种细胞数×100%。
2.7 CCK8法检测LCME对细胞增生的影响 取对数生长期的C666和5-8F细胞接种于96孔板中,每孔1 000个细胞,每孔体积200 μL,贴壁后加入LCME处理细胞:C666细胞中LCME浓度设为0、65、130、195 μg/L 4个组,5-8F细胞中LCME浓度设为0、110、220、330 μg/L 4个组,每组5个复孔,培养24 h、48 h、72 h和96 h。终止培养前2 h每孔加入20 μL CCK8试剂,再培养2 h后用酶标仪在450 nm测定每孔的吸光度(OD450)值,并绘制各浓度组的时间-OD450值曲线。
2.8 Western Blotting检测蛋白变化 取对数生长期的C666和5-8F细胞,分别加入130 μg/L和220 μg/L的LCME处理48 h;收集细胞并提取总蛋白进行SDS-PAGE电泳;用湿转法将蛋白转至PVDF膜;用5%的脱脂牛奶室温封闭1 h;稀释Caspase3,Caspase7和P21抗体,4℃孵育过夜;次日室温孵育30 min后用PBS洗涤3次,10 min/次;用5%的脱脂牛奶稀释二抗,室温孵育1 h后用PBS洗涤3次,10 min/次;化学发光法显影,自动凝胶成像系统采集图像;重复实验3次。
2.9 流式细胞术检测细胞凋亡率 取对数生长期的C666和5-8F细胞,分别加入130 μg/L和220 μg/L的LCME处理48 h;用不含EDTA的胰酶消化收集细胞;用PBS洗涤细胞2次(2 000 rpm离心5 min),收集约2.5×105个细胞/管;在暗室中加入Binding Buffer 500 μL/管 、Annexin V-FITC 5 μL/管 和Propidium Iodide 5 μL/管,混匀;反应15 min后用流式细胞仪检测凋亡细胞百分比。
2.10 统计学处理 所有实验数据采用GraphPad Prism7进行分析,计量资料采用(±s)表示,多组比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 CCK8法检测C666和5-8F细胞中LCME的IC50值 各浓度LCME处理细胞48 h后的药物浓度-生长抑制率曲线(图1)。可见不同浓度的LCME对两株细胞的增生均有一定的抑制作用,且浓度越高,抑制作用越明显。计算得C666的48 h IC50=130 μg/L,5-8F的48 h IC50=220 μg/L。

图1 不同浓度蒲葵子甲醇提取物作用下C666和5-8F细胞株的生长抑制率
3.2 形态学观察分析 普通光镜下未经LCME处理的C666和5-8F细胞呈簇状平铺排列,形状规则,界限清楚,饱满透亮,呈旺盛的生长趋势。经LCME处理48 h后,贴壁细胞数量明显减少,形状变圆,折光性增强,胞内有色素沉着,较多细胞皱缩或漂浮(图2)。可见LCME诱导了两种细胞株发生凋亡。

图2 光学显微镜下C666和5-8F细胞株形态
3.3 免疫荧光共聚焦检测细胞中Caspase3蛋白的表达差异 荧光显微镜下,未经LCME处理的对照组C666和5-8F细胞中绿色荧光呈弱阳性,而经过各自IC50浓度的LCME处理48 h后的细胞,绿色荧光呈强阳性,且均在胞质中表达(图3)。可见经过LCME处理后的细胞胞质中凋亡蛋白Caspase3蛋白的表达量明显增加。
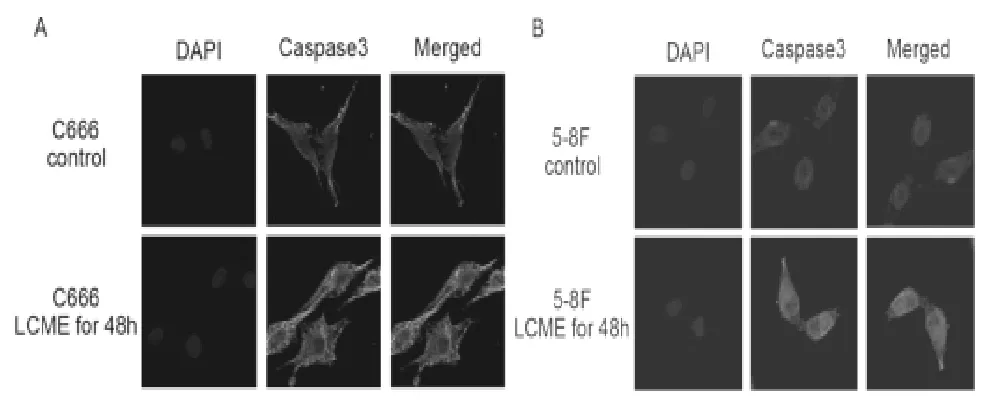
图3 免疫荧光共聚检测C666(A)和5-8F(B)细胞株中Caspase3的表达(×120)
3.4 平板克隆形成实验 不同浓度的LCME对C666和5-8F细胞的克隆形成均有明显的抑制作用,且浓度越高,克隆形成率越低,对细胞生长的抑制作用越明显,差异具有高度统计学意义(P<0.01,图4)。

图4 不同浓度LCME作用下C666(A)和5-8F(B)细胞的克隆形成率
3.5 CCK8法检测LCME对细胞增生的影响 不同浓度LCME处理后的细胞与对照组相比,所测得的OD450值有显著差异,表明各浓度LCME对C666和5-8F细胞的增生均有明显的抑制作用,且浓度越高,处理的时间越长,抑制作用越显著,具有时间和浓度依赖性,差异具有高度统计学意义(P<0.01,图5)。
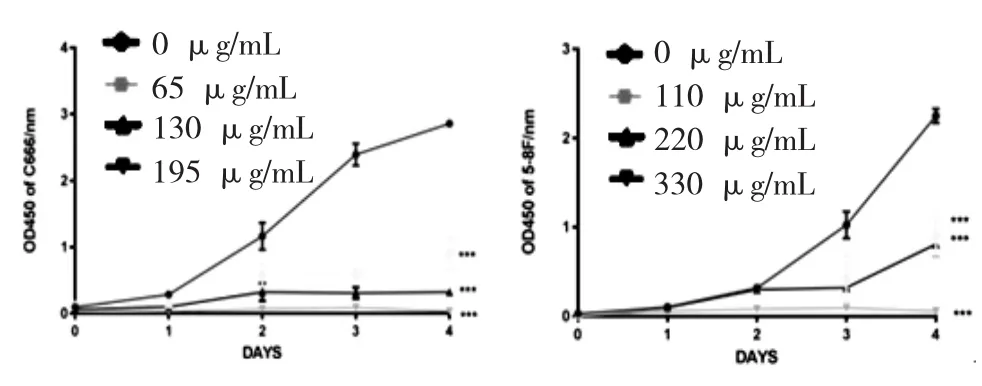
图5CCKB法检测不同浓度LCME对C666和5-8F细胞增生的影响
3.6 Western Blotting检测蛋白变化 经LCME处理48 h的C666和5-8F细胞与未经LCME处理的对照组相比,凋亡蛋白Caspase3,Caspase7和P21表达水平均明显上调(图6)。
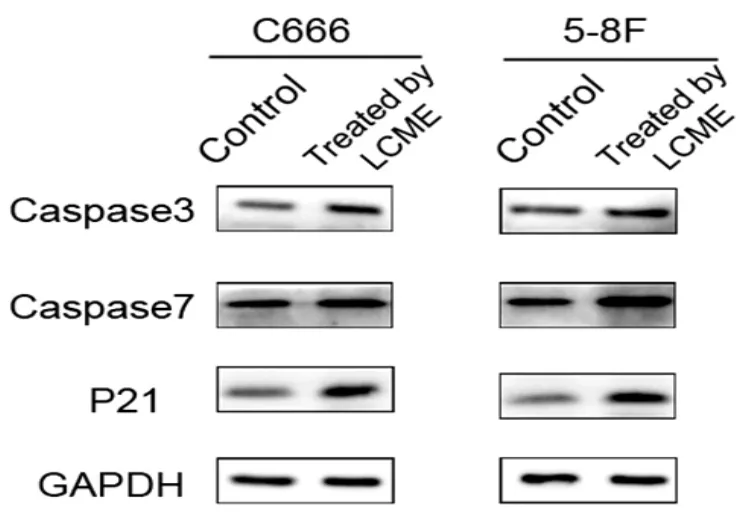
图6 Western Blotting检测C666和5-8F细胞中Caspase3、Caspase7和P21蛋白的表达变化,GAPDH加对照处理
3.7 流式细胞术检测细胞凋亡率 流式细胞仪PI/Annexin V-FITC双染色法检测细胞凋亡散点图(图7),Q1象限表示机械性损伤细胞,Q2象限表示晚期凋亡或继发性死亡细胞,Q3象限表示正常细胞,Q4象限表示早期凋亡细胞。从图7中可见,未经LCME处理的C666和5-8F细胞正常细胞比例较大,凋亡细胞较少;经LCME处理48 h后正常细胞减少,凋亡细胞明显增多,差异具有统计学意义(P<0.05)。说明LCME可诱导C666和5-8F细胞发生凋亡。

图7 流式细胞术检测C666(A)和5-8F(B)细胞凋亡率
4 讨论
当今在恶性肿瘤的综合治疗中,中医药起着重要的作用,配合放疗、化疗、手术等现代医学治疗的应用,具有减轻治疗毒副反应,增加疗效,调节患者体质等作用[5]。中药经过现代工艺提取其中的有效成分,可以对肿瘤起到直接抑制作用,与传统中药相比具有更高的效价和更广泛的应用空间。蒲葵子作为一种常见易采集的中药材,在民间用于治疗各种癌肿。其中以蒲葵子为主要成分的秘方用于治疗鼻咽癌已有悠久的历史,如常用偏方鼻上方(蒲葵子500 g,半枝莲、莪术、桑寄生各15 g,钩藤、山慈菇、走马胎各12 g,蜂房9 g,蜈蚣3条)用于鼻咽癌的治疗,有着良好的抗癌效果。因此,提取蒲葵子中的有效抗鼻咽癌成分,验证和探索其抗癌的药理作用和作用机制,从而开发高效低毒的防治鼻咽癌中成药,是本实验的主要研究方向与目的。
已有相关文献报道,蒲葵子的水提物具有抑制血管内皮细胞和多种肿瘤细胞系的体外增生作用,包括小鼠纤维肉瘤、人类乳腺癌和结肠癌细胞,对人肝癌细胞株HpG2有促凋亡作用,且未观察到毒副作用[6-7];蒲葵子的乙醇提取物对人白血病细胞HL60和人肝癌Bel-7402细胞的体外增生具有抑制作用[8-9];并且已从蒲葵子中分离出β-谷甾醇、豆甾醇、薯蓣皂苷元、β-胡萝卜苷、小麦黄素、芹菜素、正二十六碳醇等主要化学成分[10]。在预实验中我们采用现代中药分离提纯技术,得到蒲葵子甲醇提取物,发现其在抑制鼻咽癌细胞体外增生方面,较水提物的效价更高。为进一步分析其抗癌效应,我们选择LCME作为研究对象,通过摸索首先解决了蒲葵子醇提取物难溶于水,不方便做细胞学实验的难题,并通过反复醇溶解蒸馏的办法,获得能溶于水的LCME浸膏,并进一步纯化,制成PBS溶液用于处理细胞,使细胞学实验顺利进行。同时,选择高成瘤高转移特性鼻咽癌细胞株5-8F与成瘤具有一定转移特性鼻咽癌细胞株C666两种细胞株进行实验,使LCME的抗鼻咽癌作用得到更全面的证实,并且对比其对不同鼻咽癌细胞株的作用效果。
实验结果表明,LCME对体外培养的C666和5-8F细胞的增生具有明显的抑制作用,并且具有时间和浓度依赖性。通过CCK8法测得C666的48 h IC50=130 μg/L,5-8F的48 h IC50=220 μg/L,定量其增生抑制活性,可知LCME对C666细胞株的效价较5-8F细胞株高。平板克隆形成实验和CCK8实验进一步证了LCME抑制鼻咽癌细胞增生的作用。通过经LCME处理后的细胞形态学观察以及流式细胞术检测细胞凋亡率,可发现其诱导了鼻咽癌细胞发生凋亡。Western Blotting和免疫荧光实验提示LCME通过上调凋亡蛋白Caspase3,Caspase7和P21的表达水平来诱导细胞发生凋亡。
肿瘤细胞的增生生长受多种因素的影响,而诱导肿瘤细胞的凋亡在控制肿瘤发生发展过程中起到重要作用。细胞凋亡涉及一系列的基因和通路的激活、影响和调控,最终通过影响蛋白的表达来实现[11],其中Caspase3,Caspase7和P21均为细胞凋亡过程中很重要的蛋白质。Caspase3和Caspase7是细胞凋亡的效应蛋白,激活后能抑制与细胞结构、细胞周期、DNA修复相关的多种蛋白和激酶失活,抑制细胞增生并促进凋亡[12];而P21蛋白可抑制细胞周期依赖性激酶的活性,参与细胞的增生、分化、衰老、凋亡等多种功能的调节,显著抑制肿瘤细胞的生长[13]。由此提示LCME诱导鼻咽癌细胞凋亡可能通过调控与细胞生长发育相关的基因和通路来实现。如 ICE、Bcl-2、Fas/APO-1、C-myc、p53、AIM等均为重要的凋亡调控因子,LCME可能参与调控其表达或影响其功能的发挥来诱导鼻咽癌细胞的凋亡。
目前已有实验研究证明蒲葵子对多种癌症具有抑制作用[14],有文献报道,从蒲葵子中分离出的新型酚类物质EHHM通过Caspase途径和调节自噬蛋白来诱导HCC细胞的凋亡[15],为深入研究蒲葵子抗癌机制提供了方向与思路。而蒲葵子提取物中具有确切抗癌活性的化学成分和配伍,其诱导癌细胞凋亡的具体机制,对人体内环境的影响,是否与免疫相关等方面还并非特别明确。本课题组今后将在分析LCME中有效成分及配伍的基础上,进一步探讨其诱导鼻咽癌细胞发生凋亡的相关靶向调控基因及其调控机制,并进行动物体内实验证实疗效,从而证实蒲葵子抗癌的药理作用和作用机制,为充分利用蒲葵子资源,开发研制高效、低毒、廉价,能同时预防和治疗鼻咽癌的中药制剂提供实验依据。

