肠道菌群模式菌株的HPLC分离条件优化及其表征
邱丹腾, 张海玲, 陈玲琳, 潘超逸, 陈姗姗, 饶平凡, 刘树滔
(1.福州大学生物工程研究所, 福建 福州 350002; 2.中国科学院上海生命科学研究院, 浙江工商大学食品营养科学联合研究中心, 浙江 杭州 310035)
0 引言
肠道菌群是目前生命科学的一个研究热点, 与人体营养与健康有着密不可分的互惠共生关系.随着现代分子生物学技术的成熟[1-4], 下一代测序技术的不断进展以及价格不断下降[5-6], 大量宏基因组研究产生的海量测序数据, 使不依赖于培养而进行复杂且多样的微生物群落研究成为可能.然而, 无论是现有的分子生物学技术还是高通量测序技术各自在某些方面仍不甚完善, 有一些问题亟待解决[7-8].其中最关键的问题是, 这些方法都是对待测样品中的DNA分子进行分析, 所以具备理想的纯度、 浓度和完整性样品的总DNA的提取是研究的前提和关键.另外, 这两大类分析技术都无法回收细菌细胞进行生理生化分析, 从而进一步确认某种细菌的存在及其特性.如果能找到类似差异显示PCR技术[9]的方法, 预先将肠道菌群样品分成多个组分, 再分别提取DNA, 从而提高DNA的浓度和纯度, 有望提高较低丰度细菌的DNA提取效率, 保证肠道微生物结构多样性及其丰度的检测结果的完整性和准确性.
高效液相色谱技术是微生物分离、 分析和制备方法的一种创新选择.细菌作为带电颗粒, 不同pH环境下其细胞表面带有许多不同的电荷, 可以像生物大分子一样, 利用离子交换色谱技术进行分离[10-12].2006年, 陈章捷等[13]首次探讨了运用高效离子交换色谱分离、 分析动物肠道菌群, 证明该方法能够依据细菌的不同表面性质分离肠道菌群, 但是该研究并未对其分离得到的色谱峰组分进行鉴别.肠道中不同门类的细菌以及一些低丰度的细菌在HPLC中是否能够被有效地检测并分离; 各个洗脱峰组分分别代表哪些菌株, 这些问题都有待进一步的探讨.因此, 本研究选择机体肠道环境中常见的和处于劣势状态的肠道细菌构建肠道模式菌株, 模拟机体的肠道微生态系统, 建立并优化HPLC分离分析方法, 并对该方法进行重现性和灵敏度试验, 利用革兰氏染色法对洗脱峰组分进行镜检观察.本研究建立的肠道菌群模式菌株HPLC分离分析方法, 将为后续粪便样品中肠道菌群的研究奠定基础, 可望从肠道菌群混合体系中将细菌分离开来, 且该方法具有细菌细胞可回收的特点.
1 材料与方法
1.1 仪器与材料
1.1.1菌株
青春双歧杆菌(GImL278)、 鼠李糖乳杆菌(ATCC7469)、 脆弱拟杆菌(ATCC25285)、 产气荚膜梭菌(ATCC13124)、 克雷伯肺炎杆菌(CMCC(B)40117)、 奇异变形杆菌(CMCC(B)49005)、 粪肠球菌(ATCC29212)购自广东环凯生物技术有限公司.大肠埃希菌(ATCC25922)、 金黄色葡萄球菌(ATCC6538)为本实验室保存菌株.
1.1.2主要仪器和试剂
高效液相色谱仪(DL2000, 日本Hitachi公司); 高速离心机(CF15RXII, 日本Hitachi公司); 隔水式恒温培养箱(GNP-9080, 上海精宏实验设备有限公司); pH计(FE20, 梅特勒-托利多(上海)有限公司); 光学显微镜(BM1000, 南京江南永新光学仪器有限公司); 5 L密封培养罐(C-31, 广东环凯生物技术有限公司).
哌嗪、 NaCl、 硫酸铵、 尿素、 NaOH等均为国产分析纯药品; 营养琼脂培养基、 血平板等购自广东环凯生物技术有限公司.
SuperQ-650C强阴离子交换树脂(TSKgel SuperQ-TOYOPEARL 650C, 日本TOSOH公司).
1.2 实验方法
1.2.1肠道模式菌株样品的制备
冻干菌粉以及甘油保种的菌株经复苏活化后, 按体积分数为1%的接种量转接于相应的液体培养基中, 分别对9种细菌进行厌氧/需氧的增菌培养.取培养好的菌液4 mL, 于4 ℃, 12 kr·min-1离心3 min, 尽量吸净上清培养基, 沉淀下来的菌体用无菌水洗涤3遍, 最后将菌体充分悬浮于2 mL的无菌水中(相当于浓缩了2倍), 即为各个单菌样品, 每次上样量为500 μL; 9种单菌样品中各取220 μL制备成混合菌悬液, 充分振荡均匀后, 即为肠道模式混合菌株样品, 每次上样量为500 μL.
1.2.2肠道模式菌株的HPLC分析
平衡缓冲液(A液): 0.02 mol·L-1哌嗪-盐酸缓冲液(pH=8.0); 洗脱缓冲液(B液): 0.02 mol·L-1哌嗪-盐酸缓冲液(pH8.0)+1.0 mol·L-1NaCl.HPLC分析所需试剂均经过0.22 μm的醋酸纤维膜过滤除菌后使用.
色谱系统: 采用日本Tosch公司的强阴离子交换树脂TSKgel SuperQ-TOYOPEARL 650C色谱柱(200 mm×4.6 mm i.d.), 流速1 mL·min-1, 泵压0.5~1.5 MPa, 温度23~28 ℃.洗脱方法: 选择四种不同的洗脱梯度, 对肠道模式混合菌株进行色谱分离效果的比较, 确定最佳洗脱梯度.1)线性梯度洗脱: 细菌样品进样后, 0~10 min用A液平衡, 使样品中的细菌充分吸附到色谱柱上; 10~20 min用0~25% B液线性梯度洗脱; 20~40 min用25%~50% B液线性梯度洗脱; 40~80 min用50%~100% B液线性梯度洗脱; 80~100 min完全转换为B液洗脱, 将残留在树脂上的细菌全部洗脱下来.2)阶梯式梯度一: 洗脱时长共计110 min, A液平衡10 min, 10%~100% B液各洗脱10 min.3)阶梯式梯度二: 洗脱时长共计140 min, 其中A液平衡10 min, 5%~70% B液各洗脱10 min.4)阶梯式梯度三: 洗脱时长共计100 min, 其中A液平衡10 min, 10~60 min分别用10%、 15%、 20%、 25%、 30%的B液各洗脱10 min, 60~100 min用40%~70% B液各洗脱10 min.检测条件: 采用HPLC紫外检测池对通过色谱柱的细菌进行在线检测, 检测波长260 nm.
1.2.3洗脱组分的镜检
肠道模式菌株及各个单菌色谱表征后, 采用灭菌的试管重复多次收集洗脱峰, 分别于4 ℃下12 kr·min-1离心3 min, 取少许沉淀涂片镜检, 采用革兰氏染色法, 在油镜(100×)下观察.
1.2.4重复性试验
采用建立的阶梯式梯度洗脱对肠道模式混合菌株及各个单菌进行色谱表征, 重复试验5次, 分别计算各种细菌色谱表征的5次重复性试验的变异系数.
1.2.5HPLC分离细菌的灵敏度及其吸附量分析
以鼠李糖乳杆菌作为考察HPLC灵敏度和检出限的肠道模式代表菌株.1)浓缩菌液: 取培养至菌体浓度为OD600=0.576的菌液5 mL, 4 ℃下12 kr·min-1离心3 min, 沉淀下来的菌体用无菌水洗涤3遍, 最后充分悬浮于1 mL的无菌水中, 上样量为500 μL; 2)标准菌液: 取培养至菌体浓度为OD600=0.576的菌液100 μL, 4 ℃下12 kr·min-1离心3 min, 用无菌水洗涤3遍, 得到的沉淀重悬于100 μL的无菌水中, 上样量为20 μL.
2 结果与讨论
2.1 色谱分离的洗脱条件优化
参照生物分子色谱分离的方法, 尝试优化色谱分离的洗脱条件, 探讨HPLC方法对肠道菌群模式混合菌株的分离纯化, 以便为肠道菌群总DNA提取的改善等奠定基础.优化首先从线性梯度开始摸索, 在此基础上, 选定了在阶梯式梯度洗脱溶液中所用的适宜浓度.实验结果如图1所示.
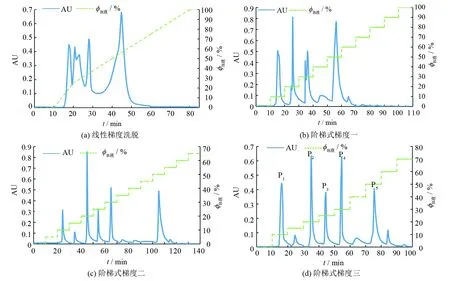
图1 不同洗脱条件下肠道模式混合菌株的HPLC图谱Fig.1 Chromatograms of the intestinal type mixed strains in different gradient elution conditions
中线性梯度洗脱如图1(a)所示, 其分离效果差, 峰型过大且拖尾.因此尝试用依次连续增加洗脱液中B液的百分含量(即NaCl的浓度)实现的阶梯式梯度洗脱, 首先选定了含0.10 ~1.0 mol·L-1NaCl的洗脱液浓度, 结果如图1(b)所示, 0.20、 0.30 mol·L-1处均出现两个相连的洗脱峰.随着洗脱液离子强度变化速率的减小, 如图1(c)所示(从每10 min增加0.10 mol·L-1的变化速率减小为每10 min增加0.05 mol·L-1), 在0.15~0.30 mol·L-1之间实现了图1(b)中相连洗脱峰的分离, 并且在0.35~0.45 mol·L-1洗脱区间未出现洗脱峰.在图1(a)、 1(b)中, 0.70~1.0 mol·L-1洗脱区间均未出现洗脱峰, 说明各组分在0.10~0.70 mol·L-1的洗脱液的洗脱过程中已经被全部洗脱下来.为缩短洗脱时间, 提高分离效率, 最终确定了分离肠道模式混合菌株的最佳洗脱条件: 阶梯式梯度三, 结果如图1(d)所示, 其分离效果好、 分辨率高.
2.2 单菌的色谱表征
为考察各个目的细菌在肠道模式混合菌的HPLC色谱图中的出峰位置(洗脱液中NaCl的浓度), 在建立的最佳阶梯式梯度洗脱条件的基础上, 本研究探索了各单菌的色谱行为.各单菌上样量为500 μL, 洗脱条件为阶梯式洗脱梯度三, 结果如图2所示.
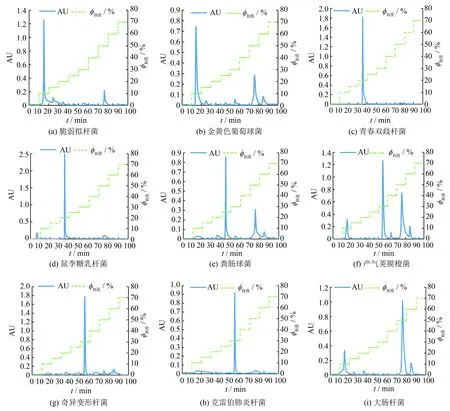
图2 不同细菌的HPLC图谱Fig.2 Chromatograms of different bacteria
从图2中可以看出, 脆弱拟杆菌的出峰位置为0.10 mol·L-1, 其余小峰镜检结果未观察到菌体(见图2(a)); 金黄色葡萄球菌出现了前后两个色谱峰, 其中0.10 mol·L-1处的镜检结果为细菌峰, 0.50 mol·L-1处未观察到菌体(见图2(b)); 青春双歧杆菌及鼠李糖乳杆菌的出峰位置均为0.20 mol·L-1(见图2(c), (d)); 粪肠球菌的出峰位置为0.25 mol·L-1, 其余小峰镜检结果未观察到菌体(见图2(e)); 产气荚膜梭菌出现了三个明显的色谱峰(可能与其表面荚膜多糖含量有关), 分别在0.10、 0.30及0.50 mol·L-1处, 根据反复收集得到的洗脱峰的镜检结果, 发现其在0.10、 0.40、 0.60 mol·L-1处的小洗脱峰并无菌体的存在(见图2(f)); 奇异变形杆菌及克雷伯肺炎杆菌的出峰位置(0.30 mol·L-1)一致, 其余小峰镜检结果未观察到菌体(见图2(g), (h)); 大肠杆菌也出现了前后两个色谱峰, 以0.50 mol·L-1为细菌峰, 0.10 mol·L-1处的镜检结果未观察到菌体(见图2(i)).图2各色谱图中出现的小峰, 其镜检结果均未观察到菌体细胞的存在, 可能是260 nm处有吸收峰的蛋白质.与图1(a)(线性梯度线脱)及图1(d)(阶梯式梯度洗脱)中的肠道模式混合菌株相一致的是, 单菌的色谱表征结果共有5种含有细菌的洗脱峰.
2.3 5个洗脱组分的确认
为确认收集到的洗脱组分是否为细菌, 对图1(d)中收集得到的各个洗脱峰按照革兰氏染色法进行显微镜检查, 其中P1~P5共5个明显的洗脱组分的镜检结果如图3所示, 视野中分布着许多菌体细胞.而其他小峰并未观察到菌体细胞, 分析可能是一些在260 nm处有吸收峰的蛋白质成分.根据图3的镜检结果, 并结合图1(d)肠道菌群模式混合菌株的色谱图、 图2中各单菌的色谱表征结果以及表1和表2中各种色谱峰的保留时间, 可以得出以下结论: P1为金黄色葡萄球菌(G+, 紫色)和脆弱拟杆菌(G-, 红色); P2为鼠李糖乳杆菌和青春双歧杆菌(G+, 形态相似); P3为粪肠球菌(G+, 紫色); P4为克雷伯肺炎杆菌(G-, 红色)、 奇异变形杆菌(G-, 红色)和产气荚膜梭菌(G+, 紫色); P5为产气荚膜梭菌(G+, 紫色)和大肠杆菌(G-, 红色).出峰位置一致的细菌可能是由于这些细菌的表面电荷特性相近, 造成与离子交换剂吸附力的微小差异而无法分开[13-15].
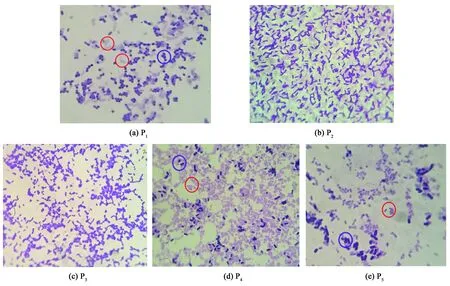
图3 洗脱组分镜检图(100×油镜)Fig.3 Microscope graph of the eluted fractions (100× oil immersion lens)
2.4 重复性试验
各目的菌5次重复性试验结果见表1和表2.11种HPLC色谱表征(2种肠道模式混合菌株、 9种单菌)的5次重复性试验的变异系数均小于1%, 说明本研究建立的HPLC分离分析肠道模式菌株的方法具有良好的重现性.

表1 不同洗脱条件下肠道模式混合菌的重复试验结果

表2 不同洗脱浓度下细菌的重复试验结果
注: 以各洗脱峰对应洗脱液的NaCl浓度表示其出峰位置
2.5 HPLC分离细菌的灵敏度及其吸附量分析
为探讨HPLC分离分析肠道模式混合菌株的检测灵敏度及最大吸附量, 选取鼠李糖乳杆菌作为研究对象, 调节鼠李糖乳杆菌的浓度及其上样量并进行色谱表征.
如图4(a)所示, 当鼠李糖乳杆菌的上样浓度为培养菌液(OD600=0.576)的5倍、 上样量为505 μL时, 开始出现穿透峰, 随着上样浓度及上样量的增加, 穿透峰的面积逐渐增大, 洗脱峰的面积基本不再增加, 甚至由于离子交换树脂吸附过载使得洗脱峰面积减小; 该浓度及上样量下, 色谱柱的吸附量达到最大.如图4(b)所示, 鼠李糖乳杆菌的上样浓度为OD600=0.576(标准菌液)、 上样量为20 μL时, 该样品信号强度低于0.05 AU, 但其色谱图中出现了明显的洗脱峰, 峰型对称而尖锐、 基线低; 该浓度及上样量下, 经5次试验反复收集得到的洗脱组分镜检观察到的菌体细胞非常的微量.为更加高效地分离回收菌体细胞、 区分蛋白峰和细菌峰, 选定上述上样浓度及上样量范围为HPLC方法分离分析肠道菌群的有效检测范围.实验结果表明, 本检测范围内建立的HPLC方法检测灵敏度高、 重现性好; 色谱柱的上样浓度为培养菌液(OD600=0.576)的5倍时, 其最大上样量为500 μL.

图4 不同上样量鼠李糖乳杆菌色谱图Fig.4 Chromatograms of the L.rhamnosus in different injection volume
2.6 HPLC上样前后菌体状态分析
采用革兰氏染色法将各个单菌HPLC上样前后的菌体细胞进行显微镜观察, 发现其中8种单菌HPLC上样前后, 除了菌体密度变化外, 菌体状态并无明显差异.但是鼠李糖乳杆菌的菌体状态发生了明显的变化, 如图5所示.图5(a)为鼠李糖乳杆菌上样前的镜检图, 从中可看到菌体呈短小的双杆状, 头尾相连、 规则排列.图5(b)为鼠李糖乳杆菌HPLC色谱分离后收集得到的洗脱组分镜检图, 分散在显微镜视野中, 菌体呈双杆状、 单杆状.这可能是随着洗脱液的稀释作用使菌浓降低(c 图5 鼠李糖乳杆菌HPLC上样前后镜检图(100×油镜)Fig.5 Microscope graph of the L.rhamnosus before/after the HPLC analysis (100× oil immersion lens) 本研究采用高效液相色谱分离分析肠道模式混合菌株, 对其洗脱条件进行优化, 显著提高了层析效果及其分辨率.最终确定了采用HPLC分离分析肠道模式菌株的最佳洗脱条件: 阶梯式梯度洗脱, 洗脱时长共计100 min, 细菌样品进样后, 0~10 min用A液平衡, 使样品中的细菌充分吸附到色谱柱上; 10~60 min分别用含0.10、 0.15、 0.20、 0.25和0.30 mol·L-1NaCl的洗脱液各洗脱10 min; 60~100 min用0.40~0.70 mol·L-1洗脱液各洗脱10 min.肠道模式混合菌株经过高效液相色谱分离得到5个明显含有细菌的洗脱峰组分, 结合5个洗脱峰组分的镜检结果和各单菌的色谱图, 分析可知9种肠道模式菌株的出峰位置(洗脱液中NaCl的浓度)分别为0.10 mol·L-1(脆弱拟杆菌和金黄色葡萄球菌)、 0.20 mol·L-1(青春双歧杆菌和鼠李糖乳杆菌)、 0.25 mol·L-1(粪肠球菌)、 0.30 mol·L-1(奇异变形杆菌、 克雷伯肺炎杆菌和产气荚膜梭菌)以及0.50 mol·L-1(大肠杆菌和产气荚膜梭菌).色谱柱的上样浓度为培养菌液(OD600=0.576)的5倍时, 其最大上样量为500 μL. 肠道模式混合菌株中有些细菌的洗脱峰保留时间仅有微小的差异, 并且具有良好的重现性.尝试通过缩小洗脱液浓度变化来进一步分离这些细菌, 但是其洗脱峰位置并没有发生改变.由此可以推断出, 这些出峰位置类同的细菌具有相似的表面电荷特性[13-15].以上HPLC技术用于肠道模式混合菌株的分离纯化工作, 为肠道菌群样品中细菌细胞的分离回收、 总DNA的有效提取、 PCR扩增效果的提高等奠定了前期基础. 液相色谱技术用于细菌纯种、 混合物、 肠道菌群以及发酵食品特定生产菌株的分离、 分析已有研究, 但对该方法的了解和应用目前尚处于发展初期.本课题组将传统上用于研究蛋白质等大分子物质的高效液相色谱作为肠道模式菌株的分离检测技术, 并实现目标菌体细胞的分离回收和分析, 以期为后续实验中大鼠肠道菌群的分析提供快速、 准确、 可定量的分离检测手段, 从而揭示肠道菌群的组成和动态变化.该方法的建立, 可望为粪菌移植、 益生菌开发以及与肠道菌群相关的疾病研究提供方法学上的支持, 为环境监测、 食品安全监测以及疾病监测等与人们生活息息相关的领域提供新的技术, 具有极其广阔的应用领域和发展前景.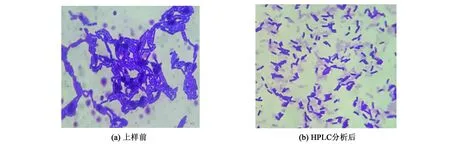
3 结语

