室温钠离子电池材料及器件研究进展∗
陆雅翔 赵成龙 容晓晖 陈立泉 胡勇胜
(中国科学院物理研究所,北京 100190)
(2018年4月28日收到;2018年5月9日收到修改稿)
1 引 言
近年来,可再生能源的高效利用迫切需要新型廉价的储能技术.在众多储能技术中,二次电池以其便携灵活的特点备受关注.目前进入储能示范应用的二次电池主要有四类:铅酸电池、高温钠硫电池、钒液流电池和锂离子电池.其中锂离子电池占比高达60%,然而没有一种电池技术能在所有指标中全面领先.自商业化以来,锂离子电池历经近三十年的发展,以其能量密度高、循环寿命长、维护费用低等优点已经在“4C”(即计算机、通信、网络和消费电子)产品中占领了主体市场;同时,锂离子电池作为电动汽车动力电池的最佳选择,发展势头日益强劲.随着锂离子电池在电动汽车的广泛应用,相关原材料的成本和储量正面临着严峻的问题.根据美国地质调查局公布的数据显示,2015年全球已探明锂资源量为3950万吨(中国为540万吨),可开采的锂资源储量为1350万吨,按1 kWh消耗0.6 kg碳酸锂,只能储118300 GWh的能量.如果以特斯拉电动汽车使用80 kWh的锂离子电池组为基准计算,需48 kg碳酸锂,全球可开采的锂储量仅仅能满足14.8亿辆汽车的需求.此外,一些关键元素如钴元素的成本也在大幅度上涨.对于大规模储能而言,资源丰富和成本低廉是最为关键的要素,锂离子电池难以同时支撑起电动汽车和电网储能两大产业的发展.因此,寻求一种成本低廉、适于大规模储能电网发展的技术仍是亟待解决的问题.
早在20世纪70年代末期,对钠离子电池技术的研究几乎与锂离子电池同时期开展,其电池构成与锂离子电池相同,包括正极、负极、隔膜和电解液.此外,两者还具有相似的离子脱出/嵌入机制.充放电过程中钠离子像摇椅一样在正负极间穿梭,电子则在外电路中流动,实现化学能与电能的相互转化(如图1).虽然钠离子电池的能量密度尚不及锂离子电池,但其储量丰富和成本低廉的优势对发展规模化储能大有裨益,有望成为锂离子电池在相关领域的有益补充,同时可逐步取代铅酸电池.因此,钠离子电池技术是大规模电力储能系统的重要选择之一,对新能源领域具有非常重要的意义.
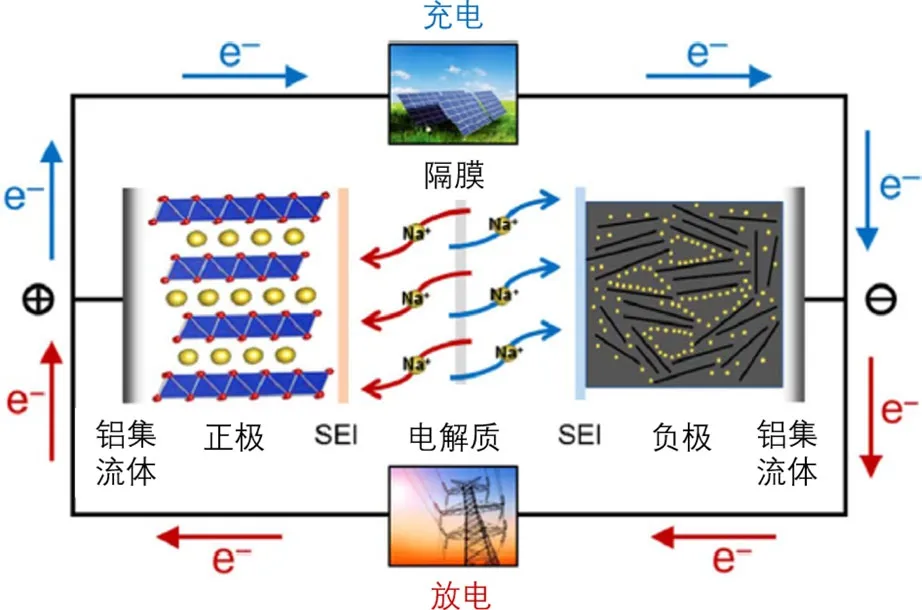
图1 钠离子电池工作原理Fig.1.The working principle of rechargeable Na-ion batteries.
钠离子电池技术的发展离不开对高性能电极和电解质材料的研发.作为与锂同属一族的碱金属,钠与锂物理化学性质虽接近但仍存差异.例如,Na+比Li+半径要大 (1.02 Å vs.0.76 Å),在相似的晶体结构中会有不同的表现;钠的标准电极电位(−2.71 V vs.standard hydrogen electrode,SHE)高于锂的标准电极电位(−3.02 V vs.SHE)0.33 V等.因此,对钠离子电池材料的研究可以借鉴锂离子电池,但却无法完全移植,直接把锂离子电池的典型材料以及其他相关衍生物用于钠离子电池是不合适的.所以,寻找适合钠离子电池的材料是其走向实用化的关键.
自1980年法国Delmas教授等发现钠离子能够在NaCoO2层状氧化物中实现可逆脱嵌之后,研究人员相继报道了其他钠离子电池的正负极材料,并对其实际应用展开探索.已有报道表明,正极材料中钠离子层状氧化物、隧道型氧化物、聚阴离子化合物和普鲁士蓝类材料均具有一定的容量和循环性能.负极材料中碳基材料、钛基氧化物、合金和有机材料均具备一定的储钠能力.这些材料均表现出了一定的储钠性质,但仍存在着不同程度的问题.例如,对正极材料的选择虽多样,但各自仍有不足:含Ni层状氧化物空气中不稳定、价格昂贵;普鲁士蓝类前驱体为剧毒KCN,结晶水不易控制;聚阴离子材料电子电导率低,含有毒元素V等.对负极材料而言,碳基材料以其丰富的资源储量、优异的导电性、较低的储钠电位和较高的储钠容量等优点被认为是综合性能最好、近期最有可能产业化的负极材料,但仍存在容量偏低所间接导致的成本偏高等问题.近年来,我国钠离子电池的研发速度快,学界和产业界的参与热度高.科技部在“十三五”智能电网重点专项储能方向规划上已将钠离子电池列为“新型储能器件的基础科学与前瞻技术研究”的首要内容.中国科学院物理研究所自2011年以来致力于低成本、高性能的钠离子电池技术的开发,已经在正极、负极、电解质等关键材料方面取得了一系列的进展,现已申请发明专利30余项(已授权18项[1−18],包括美国和日本专利各1项[17,18]),无论是在基础研究还是在产业化发展上都取得了重要突破,力争钠离子电池技术研究与应用的前沿制高点.下文将重点介绍近年来我们在室温钠离子电池正、负极材料,电解质材料和Ah级电池方面所开展的一些原创性工作及取得的重要突破,以庆祝物理所90岁生日,并向在这一研究领域奋斗的同行们分享,以期携手努力共同推动钠离子电池的实用化.
2 室温钠离子电池正极材料研究进展
2.1 Cu基层状氧化物
在层状氧化物正极材料中,含有Ni或Co活性元素的化合物通常表现出较高的容量和循环稳定性,但含有这些元素的原料成本近年来都在大幅度增涨,而且绝大多数含钠层状氧化物在空气中极不稳定,容易吸水,会额外增加材料的储存、运输和使用成本.虽然已报道了Na-Fe-Mn-O成本低廉、环境友好的系列层状氧化物材料,但其电化学性能较差.历经近3年时间的探索,我们在国际上首次发现含钠层状氧化物中Cu2+/Cu3+氧化还原电对高度可逆的现象,并基于这一基础研究的突破,设计和制备出低成本、环境友好的NaxCuiFejMnkMyO2+β系列层状氧化物正极材料(M为对过渡金属位进行掺杂取代的元素).通过适量Cu的引入有效提升了材料的导电性能和电化学性能,具有类似Ni或Co的功能,而CuO的价格只有NiO的一半.研究开发的代表性材料有O3-Na0.9[Cu0.22Fe0.30Mn0.48]O2[19],P2-Na7/9Cu2/9Fe1/9Mn2/3O2[20],O3-Na[Cu1/9Ni2/9Fe1/3Mn1/3]O2[21]等.其中,O3-Na0.9[Cu0.22Fe0.30 Mn0.48]O2正极材料可以实现0.4个钠离子的可逆脱嵌,可逆容量为100 mAh/g,平均工作电压3.2 V,首周效率90.4%,倍率性能良好,循环性能优异(100周后,容量保持率在97%),如图2所示;并且该正极材料在空气中相比其他O3相层状氧化物材料表现出了良好的循环稳定性,已具备了实用化条件.
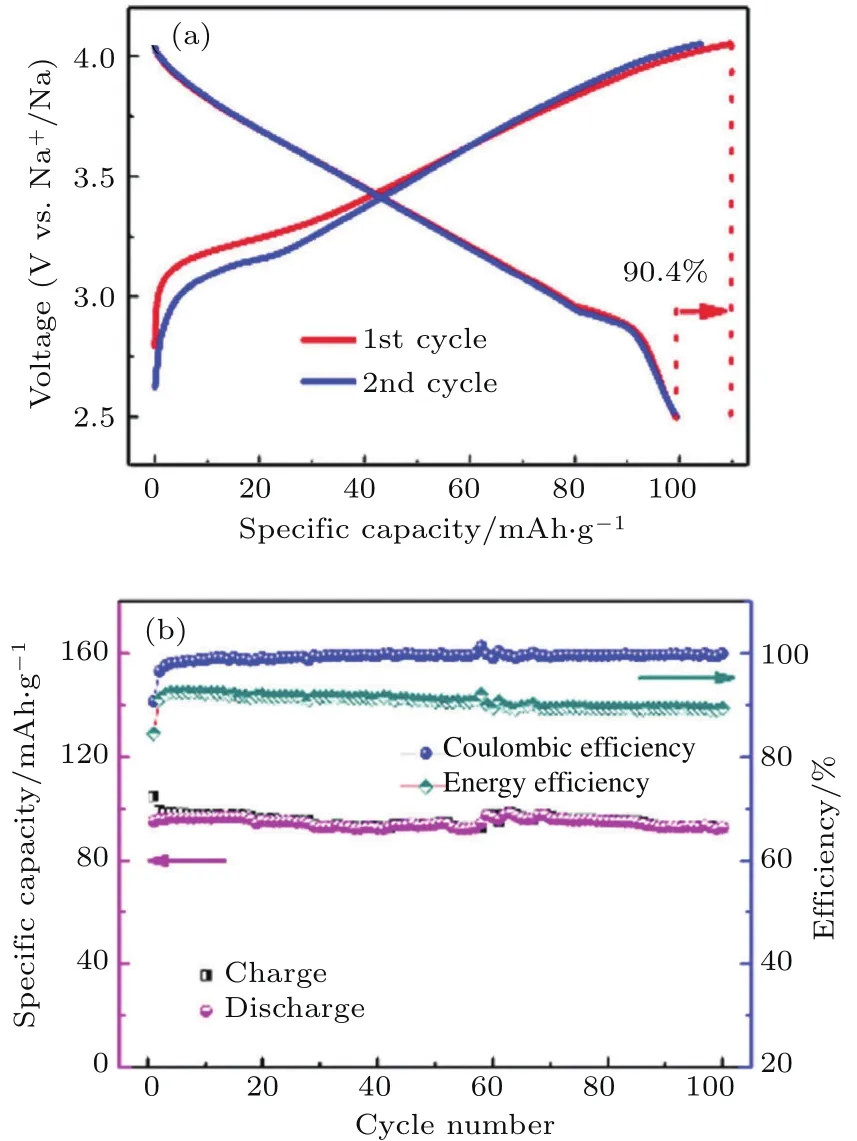
图2 (a)Na0.9[Cu0.22Fe0.30Mn0.48]O2电极材料的充放电曲线;(b)长循环性能[19]Fig.2.(a)The charge and discharge curves of the Na0.9[Cu0.22Fe0.30Mn0.48O2electrode cycled between 2.5 and 4.05 V;(b)long-term cycling performance[19].
2.2 Na0.44[Mn1−xTix]O2隧道氧化物
正交相的隧道型氧化物Na0.44MnO2具有较高的结构稳定性和较好的循环寿命,然而在全电池中其只能实现0.22个Na的可逆循环,容量较低(约45 mAh/g).我们经研究发现,通过Ti4+部分取代Mn4+得到的Na0.44[Mn0.61Ti0.39]O2可以再嵌入0.17个Na+,将钠的含量提高到0.61,得到Na0.61[Mn0.61Ti0.39]O2[22],有效地提高了可逆容量.同时钛的取代改变了材料在充放电过程中的电荷补偿机制,打破了材料中Mn3+/Mn4+的电荷有序性,得到了较为平滑的充放电曲线.在此基础上利用具有高电位的Fe3+/Fe4+氧化还原电对替换部分低电位的Mn2+/Mn3+,设计出了空气中稳定的Fe基隧道型氧化物正极材料Na0.61[Mn0.27Fe0.34Ti0.39]O2[23].通过高分辨球差校正电镜确定了该材料中的各原子占位及其充放电过程中结构的变化.该正极材料在2.5—4.2 V电压范围内首周可逆容量可达90 mAh/g,同时表现出了较高的放电电压(3.56 V)(图3(a));采用穆斯堡尔谱证实了充放电过程中Fe3+/Fe4+氧化还原电对参与电化学反应,这是首次在隧道型氧化物中实现Fe3+/Fe4+氧化还原电对的可逆转变(图3(b)).使用该正极和硬碳负极组装的非水钠离子全电池的能量密度可达224 Wh/kg(根据正负极质量之和计算得到),显示了较好的倍率及循环性能.更为重要的是,该材料中所使用的元素Na,Fe,Mn,Ti均在地壳中含量丰富、环境友好,适合发展大规模储能用钠离子电池. 此外,设计出的电压相对较低的高钠含量的隧道型氧化物Na0.66[Mn0.66Ti0.34]O2[24]被证明可以用作水溶液钠离子电池的正极材料,与碳包覆NaTi2(PO4)3/C负极材料组装的水溶液钠离子全电池的平均输出电压约为1.2 V,显示了优异的倍率和循环性能.
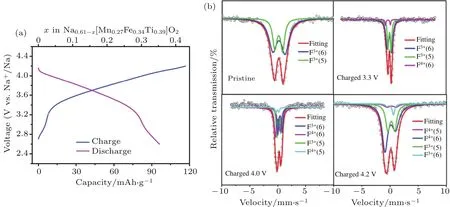
图3 (a)Na0.61[Mn0.27Fe0.34Ti0.39]O2电极材料的充放电曲线;(b)不同充放电状态下的穆斯堡尔谱信息[23]Fig.3.(a)The charge and discharge curves of the Na0.61[Mn0.27Fe0.34Ti0.39]O2electrode;(b)Fe Mössbauer spectra of samples at di ff erent charged states[23].
2.3 可逆氧变价层状正极材料
嵌入型过渡金属层状氧化物(AMO2,A=Li+或Na+,M=过渡金属)是重要的锂离子/钠离子电池正极材料.在传统观念中其电荷补偿主要靠过渡金属阳离子变价实现,因此容量受限于过渡金属得失电子的数目.然而这一传统观念随着锂离子电池富锂层状氧化物正极材料(O3结构Li[LixM1−x]O2)的发现而受到挑战.大量研究工作表明,富锂层状材料中的晶格氧参与了电子得失过程,从而提供额外容量.实际上,不仅仅是富锂材料,许多含钠层状氧化物材料都可以实现氧参与电荷补偿提供额外容量的电化学过程.但是晶格氧如何参与电荷补偿、如何实现可逆的氧变价一直是界内争论的热点.我们通过与美国一些研究组(美国橡树岭国家实验室刘珏博士、布鲁克海文国家实验室胡恩源博士和杨晓青研究员、劳伦斯伯克利杨万里研究员、斯坦福直线加速器中心刘宜晋研究员等)合作,首次利用中子散射、同步辐射技术等先进表征手段细致研究了P3-Na0.6[Li0.2Mn0.8]O2正极氧化物材料中氧参与电化学反应前后的晶体结构以及与氧有关的短程结构变化(图4)[25].研究表明,充电后的材料几乎没有晶格氧的损失,结构仍为P相层状结构,但是伴随有大量堆叠层错的出现.通过分析发现,该材料的晶体结构特点对其可逆氧变价行为有着关键的调控作用:P结构具有较大的层间距,能够容忍O—O键长变化带来的晶格畸变;同时较大的层间距能有效抑制充电过程中阳离子向碱金属层的迁移,保持稳定的层状结构,从而使得氧离子的氧化还原反应可逆.对氧变价机理的深入理解为设计具有稳定可逆氧变价行为的高电压、高容量锂/钠离子正极材料提供了新的思路.
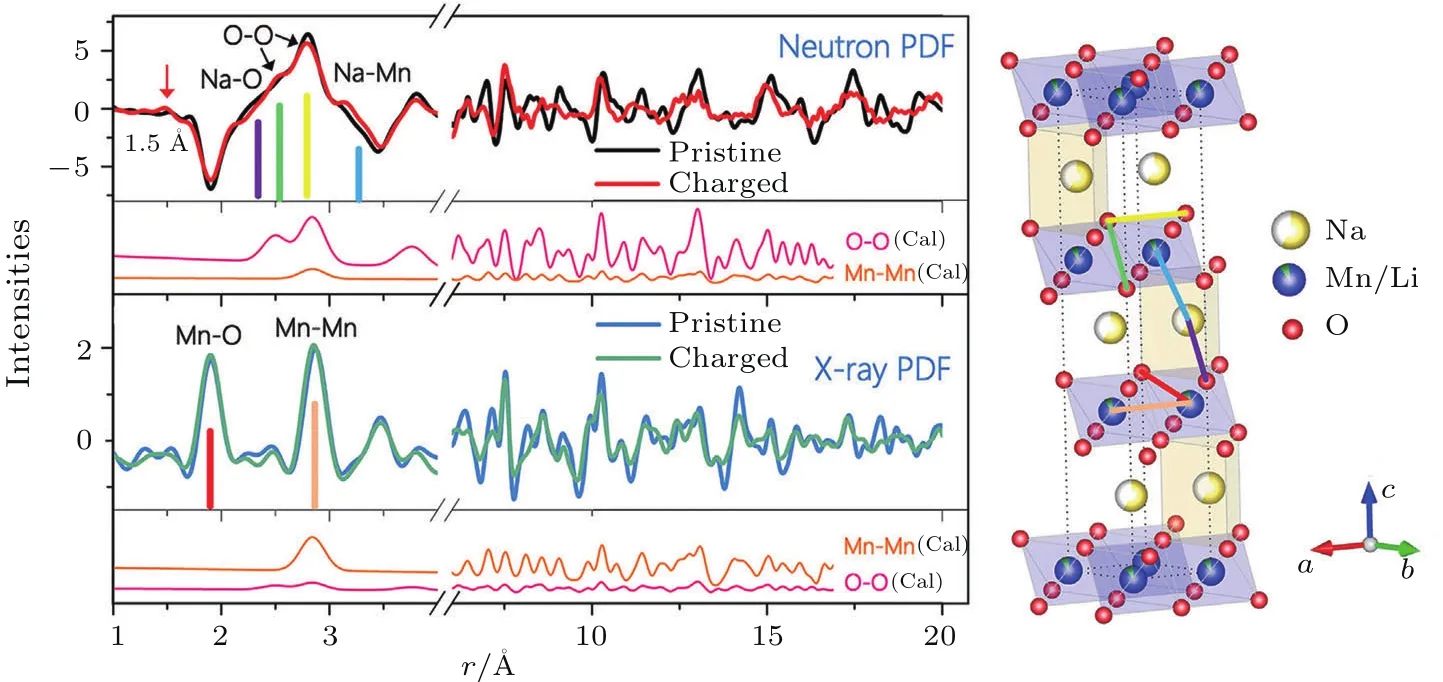
图4 P3-Na0.6[Li0.2Mn0.8]O2电极材料脱钠状态下的局域结构信息[25]Fig.4.Detection of local structural changes upon desodiation of P3-Na0.6[Li0.2Mn0.8]O2[25].
3 室温钠离子电池负极材料研究进展
3.1 碳基负极材料
无定型碳材料以其丰富的资源储量、优异的导电性、较低的储钠电位和较高的储钠容量等优点被认为是综合性能最好、近期最有可能产业化的负极材料.基于此,我们开展了大量的研究工作.首先以蔗糖为原料,结合水热合成和高温碳化制得了球形外观的硬碳微球,并系统研究了碳化温度对其电化学性能的影响[26].随后,利用天然棉花的管状结构,经一步高温碳化法制备了硬碳微管,澄清了限制硬碳倍率性能的因素,深化了对硬碳负极材料储钠机理的理解,认为在高电位斜坡区对应钠离子在硬碳表面缺陷部位上的吸附,在低电位平台区对应钠离子在硬碳材料无序纳米孔内的填充[27].目前通过实验设计正在开展无定型碳材料储钠机制的研究工作.尽管经生物质硬碳前驱体制备的碳负极材料储钠容量较高,然而前驱体成本太高(例如树脂类聚合物)或者产碳率太低(例如碳水化合物),不利于材料的大规模应用.基于此现状,我们提出了把低成本的软碳和高性能的硬碳有机结合起来的思路,开发一类新型的无定型碳材料.例如,通过在沥青前驱体中加入一定比例的木质素,发现木质素和沥青之间存在一定的乳化作用,高温裂解后得到一种无序度很高的无定型碳材料,该材料的储钠容量达到250 mAh/g,循环极其稳定[28].随后,又提出采用成本更加低廉的无烟煤作为前驱体,通过简单的粉碎和一步碳化得到了一种具有优异储钠性能的软碳负极材料[29].通过控制裂解条件进而调控其微观结构,所得软碳材料的储钠容量达到220 mAh/g,其首周效率超过83%,展现了优异的循环稳定性.最重要的是此种碳负极材料在所有的碳基负极材料中性价比最高,同时该软碳合成所需原材料资源丰富、廉价易得、产碳率高达90%(对环境影响小),且制备工艺非常简单,成本极其低廉,已具备了实用化条件.
3.2 尖晶石负极材料
尖晶石结构Li4Ti5O12因其良好的结构稳定性和优异的电化学性能,很早就作为锂离子电池负极材料被广泛研究和报道.我们首次发现该材料可用作钠离子电池负极材料,平均嵌钠电压为0.9 V,比容量为150 mAh/g左右,对应3 mol Na的嵌入和脱出.通过优化电解液、黏结剂和电极结构,可以显著提高Li3[LiTi5]O12的循环性能和库仑效率[30].随后,通过原位同步辐射衍射技术,揭示了该材料具有“纳米尺寸效应”[31].此外,借助于第一性原理计算和球差电镜测试结果,发现Na可以嵌入到Li3[LiTi5]O12的晶格产生一个不同于嵌锂的新型三相反应机理(图5)[32].随着Na的嵌入,同时有两个新相Li6[LiTi5]O12与Na6[LiTi5]O12生成,放电产物为三相共存结构,并得到了电镜观察的直接证明:我们观察到了形成的Li3[LiTi5]O12/Li6[LiTi5]O12界面以及Li6[LiTi5]-O12/Na6[LiTi5]O12界面,且初始相Li3[LiTi5]O12与Na6[LiTi5]O12相之间间隔着Li6[LiTi5]O12相.其中Li3[LiTi5]O12/Li6[LiTi5]O12之间晶格失配大约为0.1%,Li6[LiTi5]O12/Na6[LiTi5]O12之间晶格失配率为12.5%,而且在原子尺度上观察到各个相之间的尖锐界面结构.这些研究结果为后续全面理解嵌脱外来原子引起的母体材料新相边界形成及结构演化奠定了基础.
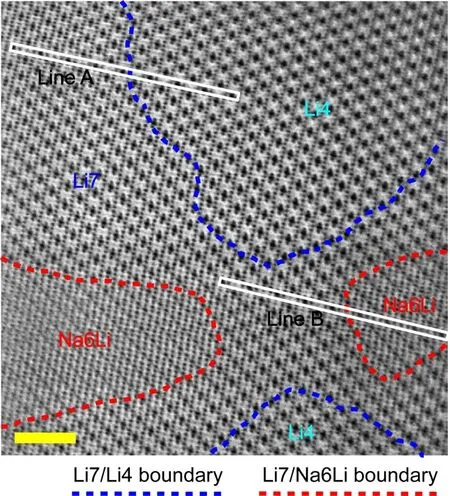
图5 Li4Ti5O12嵌钠状态下的三相共存球差电镜图[32]Fig.5. Scanning transmission electron microscope imaging of a three-phase coexistence region of sodiated Li4Ti5O12[32].
3.3 零应变层状氧化物
在对尖晶石结构的Li4Ti5O12嵌钠机理认识的基础上,我们设计出了P2-Na0.66[Li0.22Ti0.78]O2零应变负极材料[33].该材料为P2层状氧化物,空间群为P63/mmc,Li/Ti占过渡金属位,钠占碱金属层间的两个位置(2b,2d),与上下氧形成三棱柱结构.通过第一性原理计算预测该材料能够稳定存在并且发现钠在嵌入脱出过程中体积形变仅有0.21%,而且锂的引入有助于钠离子的传输(实测Na+表观扩散系数约为1×10−10cm2/s),进一步降低了钠离子扩散活化能.经电化学测试发现该材料在C/10倍率下显示116 mAh/g左右的可逆容量,200周循环后容量保持率为88%,在2C的倍率下循环1200周后容量保持率为75%,显示出极其稳定的循环性能;充放电曲线为斜坡状,平均储钠电压为0.75 V,远高于金属钠的沉积电位(图6(a)和图6(b));对材料放电态的结构进行精确确定,进一步证明材料仍然保持P2层状结构,嵌钠前后体积变化仅为0.77%,近似零应变,这也说明了该材料能够显示极其稳定的循环性能的原因.之后,又设计了一种零应变的层状P2-Na0.6[Cr0.6Ti0.4]O2,既可以作为钠离子电池的正极材料又可以作为负极材料(图6(c)和图6(d))[34].作负极时利用具有低电位(平均0.8 V)的Ti4+/Ti3+氧化还原电对,可逆容量达100 mAh/g,显示出较好的倍率和循环性能.同时利用中子散射研究了该材料过渡金属层中Cr,Ti的分布以及碱金属层中Na+-空位的分布,发现在不同钠含量(0.33—1)和很宽的温度范围内(3—1073 K),均显示出混占位的情况,即无序分布,并总结出过渡金属层以及碱金属层有序/无序分布的规律.最后,利用该层状材料分别作为正极和负极组装钠离子对称电池,平均工作电压2.5 V,显示出优异的倍率性能(12C,容量保持率75%).最近,我们又报道了一种新型的Na-Mg-Ti-O层状负极材料.不同于传统高Na含量(>0.8)的O3相电极材料在充放电过程中容易发生相转变的现象,该O3相材料(Na含量为0.66)在整个充放电过程中一直保持着单相的反应机理[35].
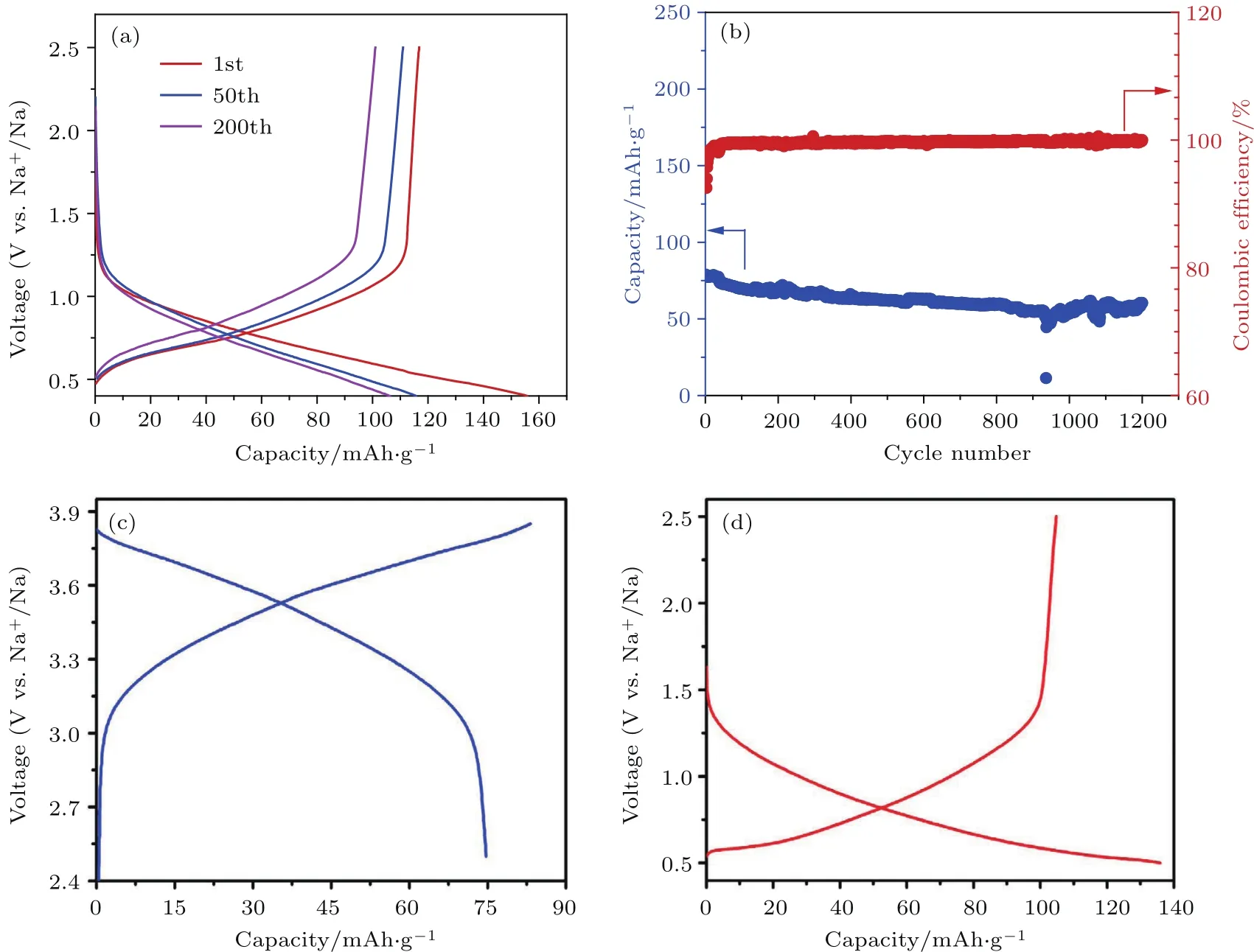
图6 Na0.66[Li0.22Ti0.78]O2电极材料的(a)充放电曲线和(b)长循环性能[33];Na0.6[Cr0.6Ti0.4]O2电极材料作为(c)正极和(d)负极的充放电曲线[34]Fig.6.(a)The charge and discharge curves and(b)long-term cycling performance of the Na0.66[Li0.22Ti0.78]O2 electrode[33];the charge and discharge curves of Na0.6[Cr0.6Ti0.4]O2as both the(c)cathode and(d)anode[34].
3.4 有机负极材料
有机电极材料具有丰富的化学组成,原料可以从自然界生物质中得到,来源丰富,可循环降解,对环境无害.作为电极材料具有可调的宽电位范围,可以实现多电子转移,引起了研究者的极大兴趣.我们先后研究报道了多种有机钠离子电池电极材料,并在材料性能的优化和机理研究方面做了大量的工作,包括Na2C8H4O4[36],Na2C14H6O4[37],Na2C6H2O4[38]等.最近,通过解析有机化合物的晶体结构并结合理论计算,提出了一种全新的有机负极材料的储钠机制.以Na2C6H2O4为例,发现其晶体结构是由互相平行的有机苯环层和无机Na—O八面体层交错堆叠而成的有机-无机层状结构,所有的C—O键长均一样,介于单双键之间.分别嵌入1个和2个Na后,其层状结构保持不变(图7),Na—O的配位环境发生了变化.理论计算结果表明,电子在有机苯环层内传递和存储,苯环为氧化还原中心,而钠离子在无机Na—O层中扩散和存储.这个新的机制类似于过渡金属层状氧化物材料,对于设计新型的有机材料提供了理论指导.
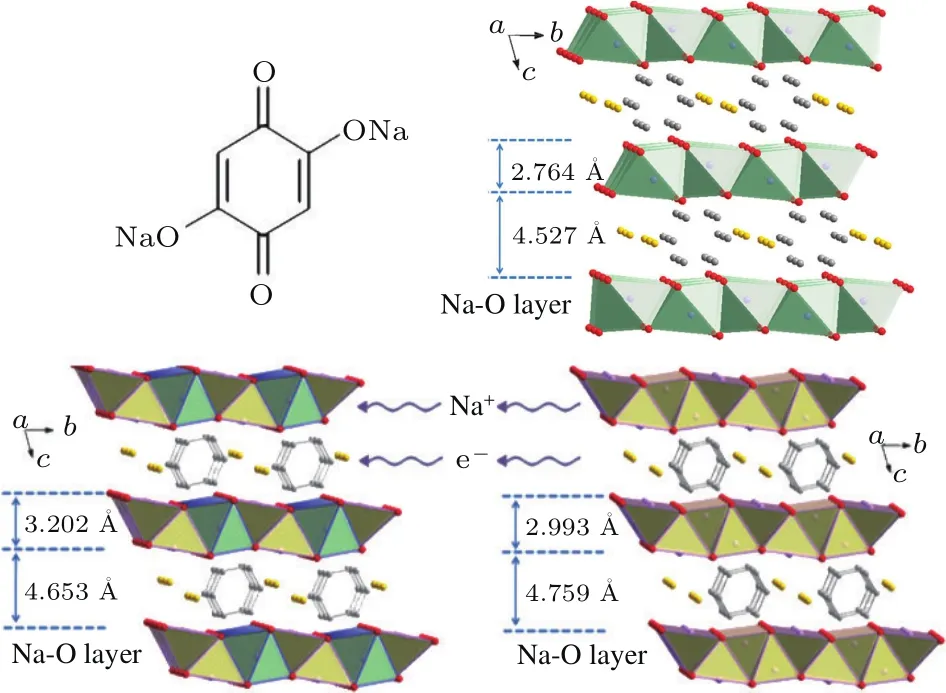
图7 Na2C6H2O4电极材料晶体结构和储钠机理[38]Fig.7.The crystal structure of Na2C6H2O4and its Na storage mechanism[38].
4 室温钠离子电池电解质材料研究进展
4.1 液体电解质材料
电解液是电池的重要组成部分,一种好的电解液应该具有高离子电导、宽电化学窗口、良好的热稳定性以及化学稳定性等特点.在实际应用中,好的电解液还能够在电池工作中保持稳定,不会持续与正负极以及集流体反应或者直接分解产生气体.钠离子电池的电解液研究尚处于起步阶段,还未得到很好的优化.我们于2012年首次将一种新型的钠盐NaFSI(sodium bis( fl uorosulfonyl)imide,Na[(FSO2)2N])应用于碳酸酯非水电解质,例如NaFSI/EC+DEC和NaFSI/PC,能大幅度提升电极材料的性能[39].不同电解液成分对电池性能影响的对比如图8所示.
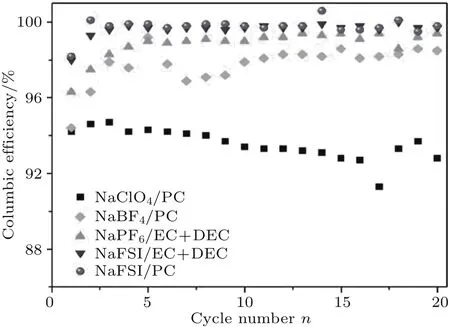
图8 同一钠离子电池在不同电解液中的库仑效率对比[39]Fig.8.Comparison of Coulombic efficiency of Na-ion batteries with the same electrode but various electrolytes[39].
4.2 固体电解质材料
用固体电解质取代液态电解液有望进一步提高电池的安全性能与循环寿命.固体电解质材料高的离子电导、优良的稳定性以及与电极材料良好的界面兼容性是发展固态钠电池技术的关键.目前已报道的固体电解质材料主要分为无机电解质、聚合物电解质和复合电解质.其中,NASICON结构的化合物AnM2(XO4)3(A=碱金属;M=Y,Ti,Sn,V,Nb,Ta等;X=Si,P,S等)以其开放的三维Na+传输通道被广为关注.Na1+xZr2SixP3−xO12(0 6 x 6 3)作为钠离子电池固体电解质被广泛报道,未经掺杂的Na3Zr2Si2PO12的室温离子电导率约为6.7×10−4S/cm.由于NASICON材料开放的结构框架,可以被很多元素替代,例如,Zr4+位可被二价、三价、四价或五价的元素取代,Si/P位可用Ge或As替代等.我们以Zr位取代的Na3+xZr2−xMxSi2PO12为体系,通过引入阳离子La3+,提出了一种全新的原位复合电解质材料,表现出较高的离子电导率[40].由于La3+离子与主相材料中骨架结构阳离子Zr4+的半径相差较大(1.06 Å vs.0.79 Å),因此不能占据在主体相的晶格位,而是形成了一个第二相Na3La(PO4)2(图9).形成的新相改变了主相中Na的含量,提高了晶粒的离子电导率,也调节了晶界组成,提高了陶瓷致密度,降低了晶界电阻.La掺杂制备的Na3.3Zr1.7La0.3Si2PO12固体电解质的室温离子电导率可达3.4×10−3S/cm, 是Na3Zr2Si2PO12的5倍,其晶界电导率比Na3Zr2Si2PO12提高了一个数量级.在80◦C时,离子电导率可达1.4×10−2S/cm.基于该复合电解质的钠离子电池表现出优异的循环稳定性.此外,我们在聚合物电解质方面也做了大量的工作,如poly(ethylene oxide)(PEO)与钠盐共混的聚合物电解质:PEO/NaFSI[41],PEO/NaTFSI(sodium bis(tri fl uoro methanesulfonyl)imide,Na[(CF3SO2)2N])[42],PEO/NaFNFSI(sodium( fl uorosulfonyl)(n-nona fl uorobutanesulfonyl)imide,Na[(FSO2)(n-C4F9SO2)N])[43].

图9 Na3.3Zr1.7La0.3Si2PO12固体电解质形貌和元素分布[40]Fig.9.Microstructure and mappings of Na3.3Zr1.7La0.3Si2PO12composite electrolyte[40].
5 室温钠离子软包电池研究进展
具有完全自主知识产权的Na-Cu-Fe-Mn-O正极材料和无烟煤基软碳负极材料已在我们实验室实现了公斤级制备,并研制出1—2 Ah钠离子软包电池.如图10所示,其能量密度达到100 Wh/kg,是铅酸电池(约40 Wh/kg)的两倍多,平均工作电压为3.1 V,目前循环500周后容量保持率为86%以上,1C充放电倍率下的容量是0.1C的80%,能量转换效率高达90%.低温性能很好,−20◦C下放电容量是室温放电容量的86%,−30◦C下放电容量是室温放电容量的80%;自放电率很低,满电态电池室温搁置1个月,荷电保持率96.6%,荷电恢复率99.6%;满电态电池55◦C搁置6天,荷电保持率90%,荷电恢复率99.8%.并通过了一系列针刺、挤压、短路、过充、过放等适于锂离子电池的安全实验.最近,我们研制出了一个72 V,80 Ah(5.76 kWh)的钠离子电池组(图10(e)),并在低速电动车上进行示范运行,其典型的充放电曲线如图10(f)所示.我们在室温钠离子电池方面所做的开创性工作均已申请中国发明专利,核心发明专利已获得授权,为推动钠离子电池的实用化奠定了坚实的基础[1−18].
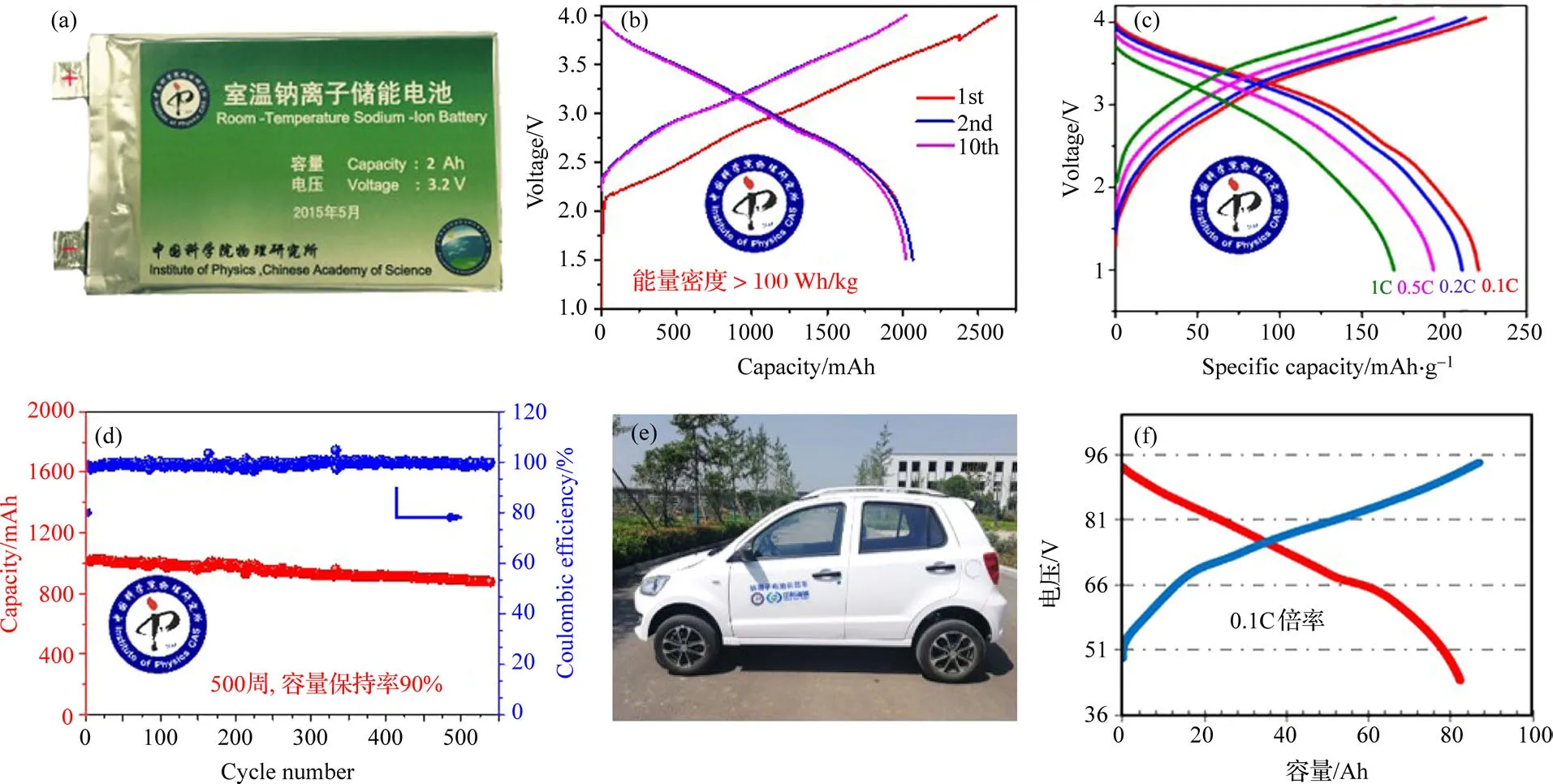
图10 (a)—(d)钠离子软包电池及其电化学性能[29];(e)钠离子电池组用于低速电动车;(f)72 V,80 Ah钠离子电池组的充放电曲线Fig.10.(a)–(d)The prototype rechargeable Na-ion pouch cells and their Na storage performance[29];(e)the prototype rechargeable Na-ion battery pack for low-speed electric vehicles;(f)the charge-discharge pro fi le of 72 V,80 Ah Na-ion battery pack.
6 结 论
钠离子电池以其丰富的资源和较低的成本优势将会在大规模储能中发挥重要作用,将会对建立清洁能源体系产生重大意义.对钠离子电池电极材料和电解质材料的研究是推动其成熟发展的核心,对其工艺技术的开发是推广其实际规模应用的关键.在机遇与挑战并存的社会环境下,我们致力于钠离子电池关键材料与器件的研究,力争占据钠离子电池技术研究与应用的前沿制高点.不仅致力于低成本、高安全、高能量密度材料体系的制备与器件研制,更注重探寻其暗藏的科学问题,提出合理的解决思路,揭示材料结构的演变机制,研究界面相互作用机制,剖析离子电子输运/存储机制等,以科学理论指导实验设计,以实验结论完善科学理论,在正负极材料、电解质材料和电池器件研究中取得了重要突破,并将在推动钠离子电池产业化进程中做出贡献.钠离子电池在基础科学和关键技术中还存在诸多挑战,对其研究与推广仍任重而道远,期待经过我们进一步不懈的探索,钠离子电池在未来的大规模储能领域将会占据重要席位,担当重要角色.
[1]Zhao L,Hu Y S,Li H,Chen L Q 2011 Chinese Patent ZL2011103263772(in Chinese)[赵亮,胡勇胜,李泓,陈立泉2011中国专利ZL2011103263772]
[2]Hu Y S,Wang Y S,Xu S Y,Li H,Chen L Q 2012 Chinese Patent ZL2012101071363(in Chinese)[胡勇胜,王跃生,徐淑银,李泓,陈立泉2012中国专利ZL2012101071363]
[3]Hu Y S,Wang Y S,Liu P,Chen L Q 2012 Chinese Patent ZL2012101765232(in Chinese)[胡勇胜,王跃生,刘品,陈立泉2012中国专利ZL2012101765232]
[4]Hu Y S,Wang Y S,Xu S Y,Li H,Chen L Q 2012 Chinese Patent ZL2012102721231(in Chinese)[胡勇胜,王跃生,徐淑银,李泓,陈立泉2012中国专利ZL2012102721231]
[5]Hu Y S,Mu L Q,Chen L Q,Huang X J 2014 Chinese Patent ZL201410490257X(in Chinese)[胡勇胜,穆林沁,陈立泉,黄学杰2014中国专利ZL201410490257X]
[6]Hu Y S,Xu S Y,Wang Y S,Li Y M,Chen L Q,Huang X J 2014 Chinese PatentZL2014101955310(in Chinese)[胡勇胜,徐淑银,王跃生,李云明,陈立泉,黄学杰2014中国专利ZL2014101955310]
[7]Hu Y S,Wu X Y,Mu L Q,Ding Y J,Chen L Q,Huang X J 2014 Chinese Patent ZL2014102450296(in Chinese)[胡勇胜,吴晓燕,穆林沁,丁月君,陈立泉,黄学杰2014中国专利ZL2014102450296]
[8]Hu Y S,Li Y M,Xu S Y,Wang Y S,Chen L Q,Huang X J 2014 Chinese PatentZL2014103425412(in Chinese)[胡勇胜,李云明,徐淑银,王跃生,陈立泉,黄学杰2014中国专利ZL2014103425412]
[9]Hu Y S,Xu S Y,Li Y M,Chen L Q,Huang X J 2014 Chinese Patent ZL2014103479357(in Chinese)[胡勇胜,徐淑银,李云明,陈立泉,黄学杰 2014中国专利ZL2014103479357]
[10]Hu Y S,Wang Y S,Chen L Q,Huang X J 2014 Chinese Patent ZL2014103642414(in Chinese)[胡勇胜,王跃生,陈立泉,黄学杰2014中国专利ZL2014103642414]
[11]Hu Y S,Mu L Q,Chen L Q 2014 Chinese Patent ZL2014105498969(in Chinese)[胡勇胜,穆林沁,陈立泉2014中国专利ZL2014105498969]
[12]Hu Y S,Zhang Z Z,Xu K Q,Chen L Q,Huang X J 2014 Chinese PatentZL2014107729525(in Chinese)[胡勇胜,章志珍,徐凯琪,陈立泉,黄学杰 2014中国专利ZL2014107729525]
[13]Hu Y S,Li Y M,Chen L Q 2015 Chinese Patent ZL2015100300759(in Chinese)[胡勇胜,李云明,陈立泉2015中国专利ZL2015100300759]
[14]Hu Y S,Wang Y S,Chen L Q 2015 Chinese Patent ZL2015101700142(in Chinese)[胡勇胜,王跃生,陈立泉2015中国专利ZL2015101700142]
[15]Hu Y S,Li Y M,Chen L Q 2015 Chinese Patent ZL2015107086328(in Chinese)[胡勇胜,李云明,陈立泉2015中国专利ZL2015107086328]
[16]Hu Y S,Wang Y S,Liu P,Chen L Q,Huang X J 2015 Chinese Patent ZL2015109471194(in Chinese)[胡勇胜,王跃生,刘品,陈立泉,黄学杰 2015中国专利ZL2015109471194]
[17]Hu Y S,Li Y M,Xu S Y,Wang Y S,Chen L Q,Huang X J 2016 Japanese Patent JP2016-537294 A
[18]Hu Y S,Mu L Q,Chen L Q 2017 US Patent US9 728 780 B2
[19]Mu L,Xu S,Li Y,Hu Y S,Li H,Chen L,Huang X 2015 Adv.Mater.27 6928
[20]Li Y,Yang Z,Xu S,Mu L,Gu L,Hu Y S,Li H,Chen L 2015 Adv.Sci.2 1500031
[21]Mu L Q,Qi X G,Hu Y S,Li H,Chen L Q,Huang X J 2016 Energy Storage Sci.Tech.5 324(in Chinese)[穆林沁,戚兴国,胡勇胜,李泓,陈立泉,黄学杰 2016储能科学与技术5 324]
[22]Wang Y,Liu J,Lee B,Qiao R,Yang Z,Xu S,Yu X,Gu L,Hu Y S,Yang W,Kang K,Li H,Yang X Q,Chen L,Huang X 2015 Nat.Commun.6 6401
[23]Xu S,Wang Y,Ben L,Lü Y,Song N,Yang Z,Li Y,Mu L,Yang H T,Gu L,Hu Y S,Li H,Cheng Z H,Chen L,Huang X 2015 Adv.Energy Mater.5 1501156
[24]Wang Y,Mu L,Liu J,Yang Z,Yu X,Gu L,Hu Y S,Li H,Yang X Q,Chen L,Huang X 2015 Adv.Energy Mater.5 1501005
[25]Rong X,Liu J,Hu E,Liu Y,Wang Y,Wu J,Yu X,Page K,Hu Y S,Yang W,Li H,Yang X Q,Chen L,Huang X 2017 Joule 2 125
[26]Li Y,Xu S,Wu X,Yu J,Wang Y,Hu Y S,Li H,Chen L,Huang X 2015 J.Mater.Chem.A 3 71
[27]Li Y,Hu Y S,Titirici M M,Chen L,Huang X 2016 Adv.Energy Mater.6 1600659
[28]Li H B,Shen F,Luo W,Dai J Q,Han X G,Chen Y N,Yao Y G,Zhu H L,Fu K,Hitz E,Hu L B 2016 ACS Appl.Mater.Inter.8 2204
[29]Li Y,Hu Y S,Qi X,Rong X,Li H,Huang X,Chen L 2016 Energy Storage Mater.5 191
[30]Zhao L,Pan H L,Hu Y S,Li H,Chen L Q 2012 Chin.Phys.B 21 028201
[31]Yu X,Pan H,Wan W,Ma C,Bai J,Meng Q,Ehrlich S N,Hu Y S,Yang X Q 2013 Nano Lett.13 4721
[32]Sun Y,Zhao L,Pan H,Lu X,Gu L,Hu Y S,Li H,Armand M,Ikuhara Y,Chen L,Huang X 2013 Nat.Commun.4 1870
[33]Wang Y,Yu X,Xu S,Bai J,Xiao R,Hu Y S,Li H,Yang X Q,Chen L,Huang X 2013 Nat.Commun.4 2365
[34]Wang Y,Xiao R,Hu Y S,Avdeev M,Chen L 2015 Nat.Commun.6 6954
[35]Zhao C,Avdeev M,Chen L,Hu Y S 2018 Angew.Chem.Int.Ed.https://doi.org/10.1002/anie.201801923
[36]Zhao L,Zhao J,Hu Y S,Li H,Zhou Z,Armand M,Chen L 2012 Adv.Energy Mater.2 962
[37]Mu L,Lu Y,Wu X,Ding Y,Hu Y S,Li H,Chen L,Huang X 2017 Green Energy&Environ.3 63
[38]Wu X,Jin S,Zhang Z,Jiang L,Mu L,Hu Y S,Li H,Chen X,Armand M,Chen L,Huang X 2015 Sci.Adv.1 e1500330
[39]Jian Z,Han W,Lu X,Yang H,Hu Y S,Zhou J,Zhou Z,Li J,Chen W,Chen D,Chen L 2013 Adv.Energy Mater.3 156
[40]Zhang Z,Zhang Q,Shi J,Chu Y S,Yu X,Xu K,Ge M,Yan H,Li W,Gu L,Hu Y S,Li H,Yang X Q,Chen L,Huang X 2017 Adv.Energy Mater.7 1601196
[41]Qi X,Ma Q,Liu L,Hu Y S,Li H,Zhou Z,Huang X,Chen L 2016 ChemElectroChem 3 1741
[42]Ma Q,Hu Y S,Li H,Chen L,Huang X,Zhou Z 2018 Acta Phys.-Chim.Sin.34 213(in Chinese)[马强,胡勇胜,李泓,陈立泉,黄学杰,周志彬 2018物理化学学报 34 213]
[43]Ma Q,Liu J,Qi X,Rong X,Shao Y,Feng W,Nie J,Hu Y S,Li H,Huang X,Chen L,Zhou Z 2017 J.Mater.Chem.A 5 7738

