基于透光率测定优化生防菌制剂表面活性剂方案
刁红亮,田晶,韩志慧,邢培翔,马瑞燕*
(1.山西农业大学 农学院,山西 太谷 030801;2.吕梁学院 生命科学系,山西 离石 033000)
昆虫病原真菌作为一类昆虫病原微生物,在害虫生物防治中起着非常重要的作用,其中尤以真菌农药技术的应用效果最为显著。真菌农药具有寄主范围广、对环境安全、防治害虫不产生抗药性等优点,具有广阔的发展前景[1]。目前,国内外市场上真菌杀虫剂常见剂型多为以气生分生孢子为活性物的可湿性粉剂、油悬浮剂和悬浮乳剂等,其中50%以上为可湿性粉剂、悬浮乳剂和水分散粒剂等兑水喷雾使用的水基化应用制剂[2]。
开发真菌杀虫剂,表面活性剂的选择是关键。不同剂型中表面活性剂都起着重要作用,如可作为分散剂、乳化剂、润湿剂等[3]。真菌水基制剂要求不溶于水的活性成分(分生孢子)颗粒均匀分散于水相中,并在一定时间内保持稳定的分散状态,形成相对稳定的悬浮分散体系,即具有良好的分散悬浮性能。影响分散悬浮性的因素很多,其中具有分散与悬浮作用的表面活性剂(即分散剂)的使用最为关键。分散剂品种选择合适、质量高、用量适当,便能够防止颗粒体之间发生凝聚,从而使制剂具备良好的分散悬浮性能[4]。分散体系的分散稳定性可通过沉降容积、悬浮率、透光率、Zeta电位、动态光散射(DLS)粒径测定等方法表征,其中紫外透光率测定具有简便、快速、稳定等特点,常用于悬浮体系颗粒分散稳定性的表征[5,6]。
玫烟色棒束孢Isariafumosorosea是一种重要的丝孢类昆虫病原真菌,可寄生同翅目Homoptera、鳞翅目Lepidoptera、鞘翅目Coleoptera、双翅目Diptera和膜翅目Hymenoptera昆虫,是茶树、蔬菜和果树害虫的重要致病真菌之一, 尤其对同翅目蚜虫、粉虱等刺吸式口器害虫有很强的致病力[6~9]。该菌分布广、容易培养、且对人畜安全,是一种重要的生防资源[7]。国外目前已有多种制剂产品面世,约占到所有真菌农药产品的5.9%[10],如荷兰的Biocon©和Biobest©,美国和欧洲的芽生孢子制剂PFR97©等[6,10]。目前,国内玫烟色棒束孢研究工作已取得不少进展,但尚未实现大规模的开发和应用[9]。
本文以玫烟色棒束孢IF1106菌株气生分生孢子水悬浮液为研究对象,通过测定孢子悬浮液的紫外透光率,筛选表面活性剂的种类及用量,并对表面活性剂复配方案进行正交优化,以探索具有较高分散悬浮性能的表面活性剂方案,为进一步开发高性能玫烟色棒束孢生防杀虫剂奠定技术基础。
1 材料与方法
1.1 材料
1.1.1供试菌株
玫烟色棒束孢IF1106菌株,保藏编号:CGMCC NO.1396,由山西农业大学农学院生物安全与生物防治研究组实验室提供。
1.1.2供试表面活性剂
供试表面活性剂见表1。
表1 供试表面活性剂Table 1 Surfactants evaluated in this study
1.1.3培养基
马铃薯葡萄糖培养基(Potato dextrose agar, PDA):马铃薯200 g、葡萄糖200 g、琼脂17 g、加蒸馏水至1 L。
1.1.4仪器
生物显微镜,CX31,奥林巴斯中国有限公司;灭菌锅,LS-75HD,济南欧迪医疗器械有限公司;超净工作台, SW-CJ-2FD,苏州净化设备有限公司;灭菌喷雾器,ASONE500 mL,日本ASONE株式会社;霉菌培养箱,BPMJ-250,上海一恒科学仪器有限公司;电热恒温鼓风干燥箱,GZX-GF-II,上海跃进医疗器械有限公司;气流粉碎机,FDV,北京环亚天元机械技术有限公司;电动振筛机,XF200,上海振筛机械设备有限公司;酸度计,STRATER 2100/3C PRO,奥豪斯仪器(上海)有限公司;高剪切乳化机,AD500S-P,上海昂尼仪器仪表有限公司;紫外-可见分光光度计,UV-1 902 A,上海奥析科学仪器有限公司。
1.2 方法
1.2.1菌株分生孢子悬浮液的制备
将活化后玫烟色棒束孢 IF1106 菌株接种在 PDA培养基上,在25 ℃ 条件下培养10 d,用灭菌过的盖玻片刮取孢子,加入适量的无菌水,用磁力搅拌器搅拌30 min,用灭菌四层纱布过滤掉菌丝,显微镜下用血球计数板计数,将孢子悬浮液浓度调整至1×107孢子·mL-1。
1.2.2菌株孢子粉的制备
取大米500 g,加水浸泡10~12 h后沥干水分灭菌,在无菌条件下将灭菌后的大米加入适量无菌水并平铺于托盘中,形成米饭培养基。使用灭菌喷雾器将上述IF1106孢子悬浮液均匀喷洒在米饭培养基表面,用保鲜膜覆盖密封并置于25 ℃、12 L∶12 D光周期的霉菌培养箱培养7~10 d产孢。
将产孢后的托盘揭去保鲜膜,放置于26 ℃电热恒温鼓风干燥箱干燥30~40 h,再在35 ℃下干燥,使物料整体水分含量低于5%。将干燥后的物料置于气流粉碎机进行间歇式粉碎,每次粉碎30 s间隔20 min,共粉碎3~5次,使用电动振筛机将粉碎后物料过400 目筛形成孢子粉备用。
1.2.3孢子悬浮液的制备
取1 g玫烟色棒束孢IF1106的孢子粉置于150 mL锥形瓶中,称取一定量(相对被分散物料的质量百分比)的表面活性剂加入锥形瓶中,并加入100 mL去离子水,以玻璃棒搅拌均匀形成悬浮液,以酸度计测量悬浮液的pH值, 以5%NaOH溶液调整pH值至7~8。
1.2.4孢子悬浮液透光率测定
将以上孢子悬浮液置于高剪切乳化机下,悬浮液液面高于分散头,打开高剪切乳化机的开关,将转速调为四格(约600 r·min-1),剪切1 min。
打开紫外-可见光分光光度计预热 20 min,在第一个比色皿中装参比溶液(等量分散剂溶液,不含有孢子粗粉,其透过率为 100%)作为背景处理,将乳化后的孢子悬浮液(原液或稀释液)加入比色皿中,在环境温度25 ℃和600 nm入射光条件下测定分散体系的透光率并记录数据。将以上乳化后的孢子悬浮液静置30 min,同样条件下测定体系透光率并记录数据,每次测量做3次重复。
1.2.5试验数据处理与分析
本试验所有数据均使用DPS7.05软件进行分析与处理,采用OriginPro8软件绘制不同分散体系透光率与表面活性剂浓度曲线图。
2 结果与分析
2.1 表面活性剂用量对孢子悬浮液透光率的影响
在孢子悬浮液中加入不同用量的4类(非离子、阴离子、高分子和有机硅表面活性剂)10种表面活性剂对分散体系透光率的影响见图1~图4。
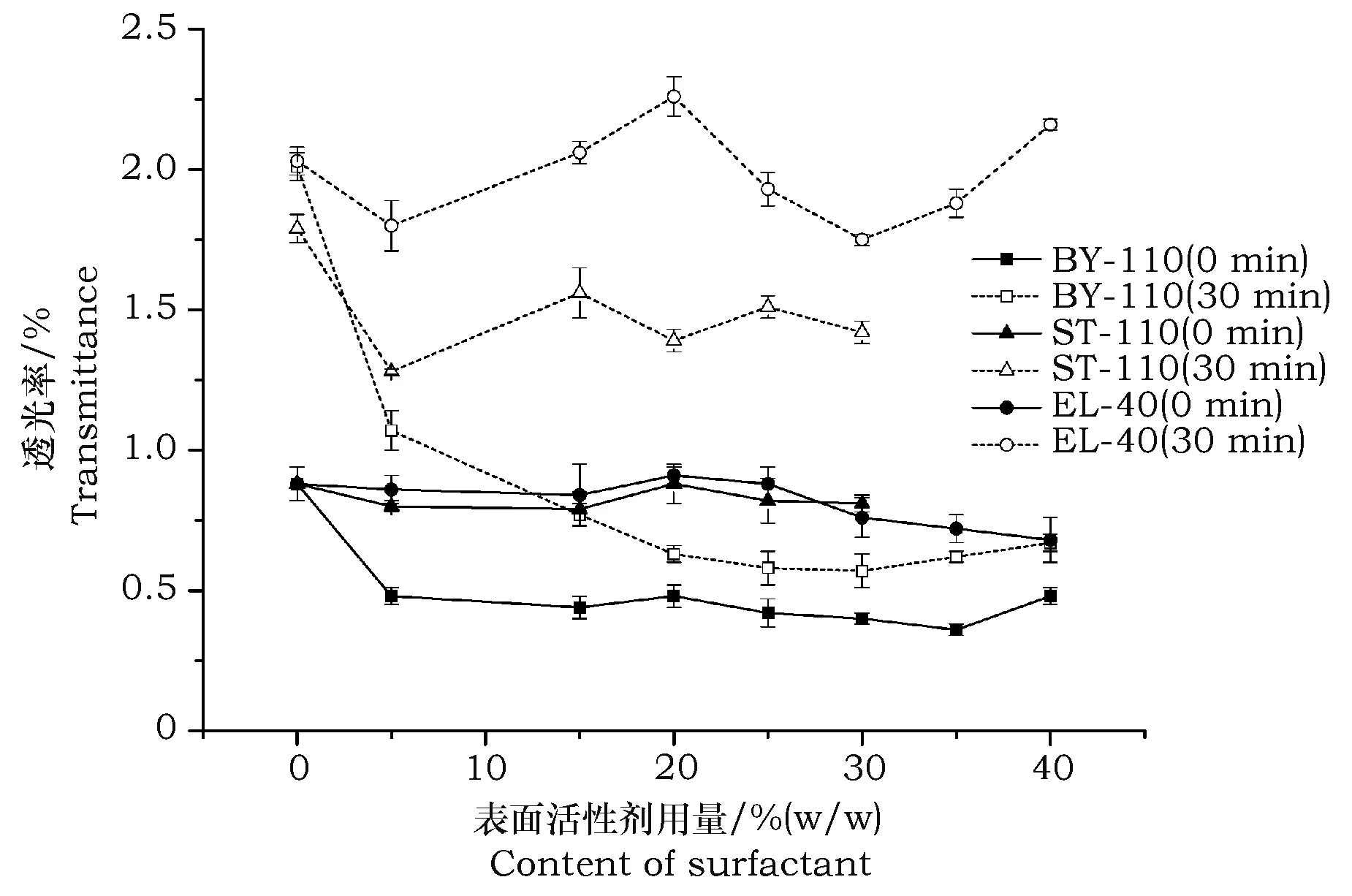
图1 非离子表面化活性剂用量对孢子悬浮液透光率的影响Fig.1 Effect of amount of non-ionic surfactant on the transmittance of conidial suspension
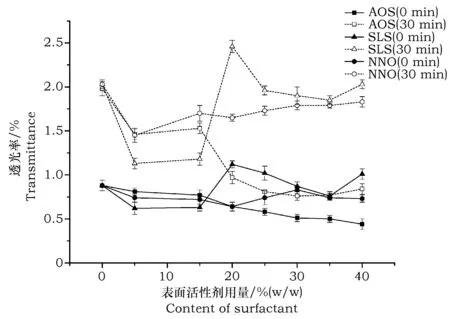
图2 阴离子表面化活性剂用量对孢子悬浮液透光率的影响Fig.2 Effect of amount of anionic surfactant on the transmittance of conidial suspension

图3 高分子表面化活性剂用量对孢子悬浮液透光率的影响Fig.3 Effect of amount of polymeric surfactant on the transmittance of conidial suspension
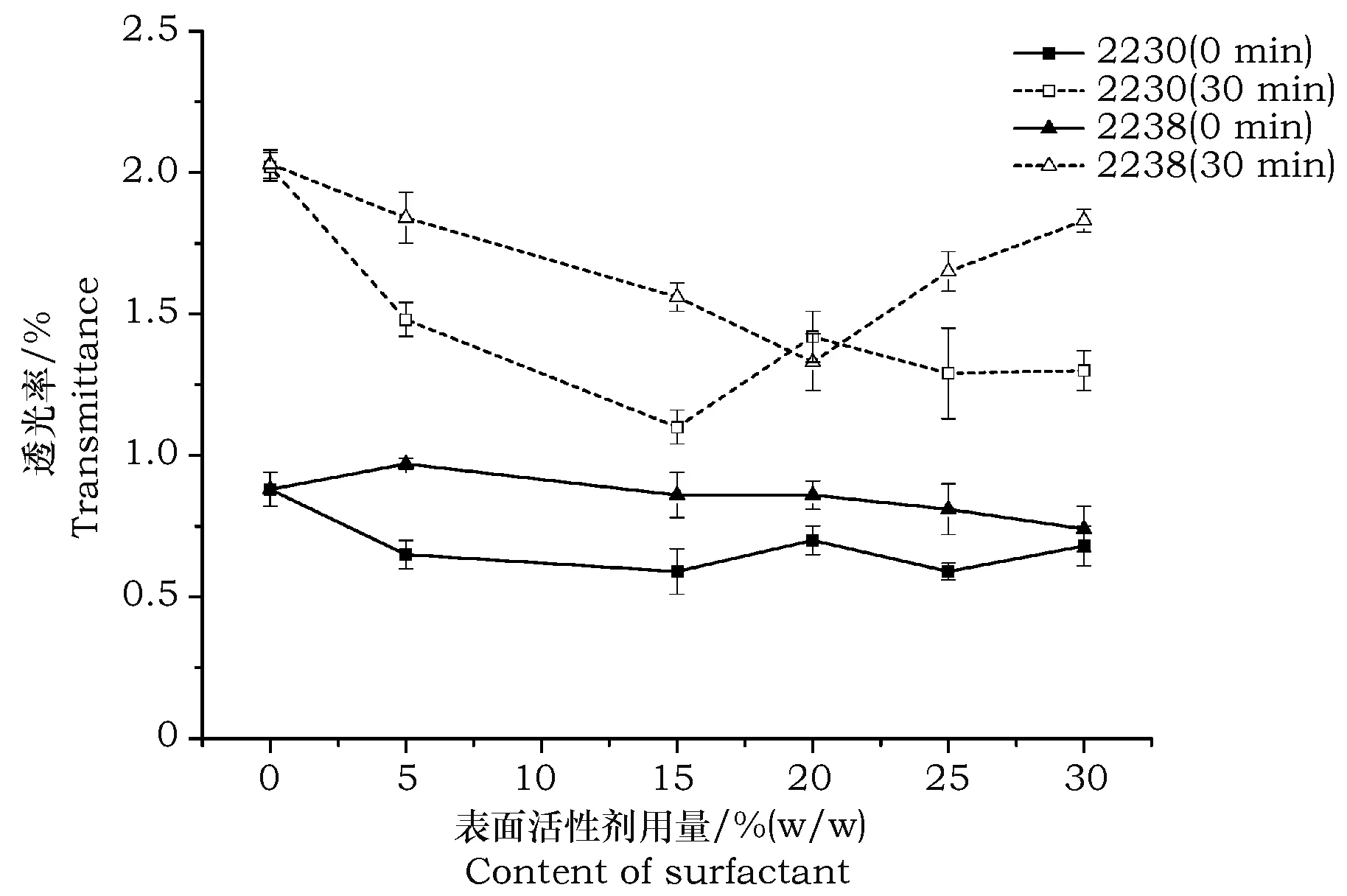
图4 有机硅表面化活性剂用量对孢子悬浮液透光率的影响Fig.4 Effect of amount of organosilicon surfactant on the transmittance of conidial suspension
从图1可以看出,随着孢子悬浮液中表面活性剂用量的增加,体系透光率变化趋势存在明显差异。其中使用BY-110的孢子悬浮液随着表面活性剂用量的增加,静置0 min和30 min的悬浮液透光率呈现明显的下降趋势。当加入量在10%~30%时透光率变化较为平缓,且2条曲线逐渐接近。加入量大于30%时,静置0 min和30 min悬浮液透光率都又开始逐渐上升。
相关研究认为,微粒悬浮液静置时间0 min时的透光率反映了颗粒分散性的好坏,颗粒分散越好,粒径越小,颗粒之间的距离越小,光被吸收和散射的就多,能穿透的较少,则透光率越小,反之,则越大。随时间增加,由于样品之间分散性的差异导致其团聚程度不同,团聚越严重,颗粒的粒径越大,沉降的也就越快,上清液中颗粒浓度减少越快,透光率也就增加越快[6]。因此,本文中的孢子悬浮液静置0 min的透光率反映了分散体系的分散性,而静置30 min的透光率则反映了体系的悬浮稳定性。
基于以上表明:使用BY-110可有效提高孢子悬浮液的分散性与悬浮稳定性,且当使用量在10%~30%时,孢子悬浮液可获得较高的分散性和悬浮稳定性。使用ST-100和EL-40的孢子悬浮液随着表面活性剂量的增加,静置0 min和30 min的悬浮液透光率没有出现下降趋势,且两条曲线彼此分离较远。这表明使用ST-100和EL-40没有有效改善孢子悬浮液的分散性与悬浮稳定性。
同样由图2~图4可知,单独使用阴离子表面活性剂AOS(加入量20%~40%)、高分子表面活性剂CMC-Na(加入量15%~35%)、有机硅表面活性剂2230(加入量10%~30%)可有效提高孢子悬浮液的分散性与悬浮稳定性。
2.2 孢子悬浮液表面活性剂方案的正交优化
单独使用一类表面活性剂作为分散剂普遍存在添加量大,分散效率低、稳定性差等问题,而不同种类表面活性剂的复配使用可在保证各自发挥其作用的同时又能够相互协同,从而极大提高分散微粒体系的分散效率和稳定性[12]。基于此,本文以上述试验筛选出的4种表面活性剂作为制备玫烟色棒束孢IF1106孢子悬浮液的分散剂,通过测量悬浮液透光率(原悬浮液稀释10倍测量)并进行正交试验优化表面活性剂复配方案。
2.2.1正交设计
依据表面活性剂筛选试验结果,以BY-110(非离子)、AOS(阴离子)、2230(有机硅)、CMC-Na(高分子)4种表面活性剂为实验因素,并选取每种表面活性剂在10%~40%范围内的5个用量为水平,具体表面活性剂方案正交优化试验因素水平见表2。
2.2.2正交试验表及孢子悬浮液透光率测定结
因本试验考察4个因素在5个水平上对形成的悬浮液(稀释液)透光率的影响,不考察因素间的交互作用,故选用L25(56)正交表。正交试验表及孢子悬浮液透光率测定结果见表3。
2.2.3正交试验结果极差分析
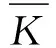
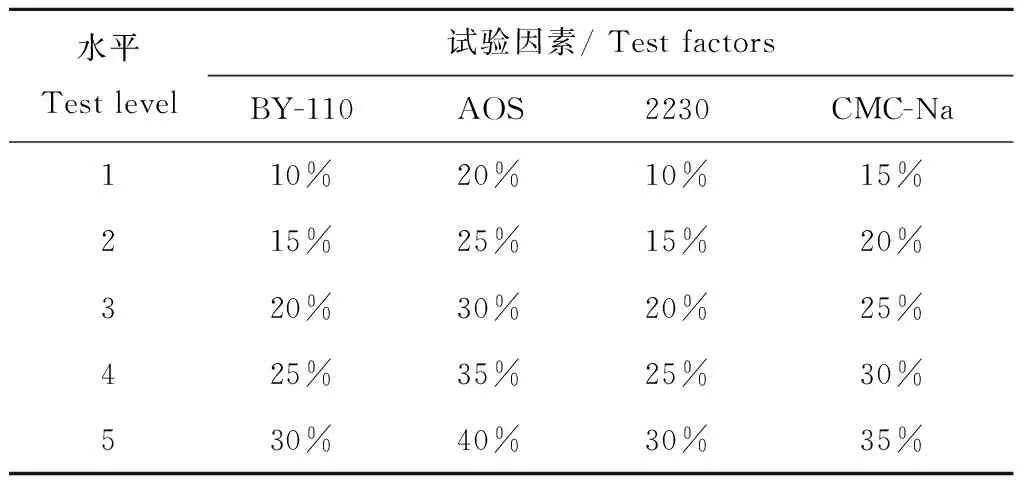
表2 试验因素水平表Table 2 Test factor level table.
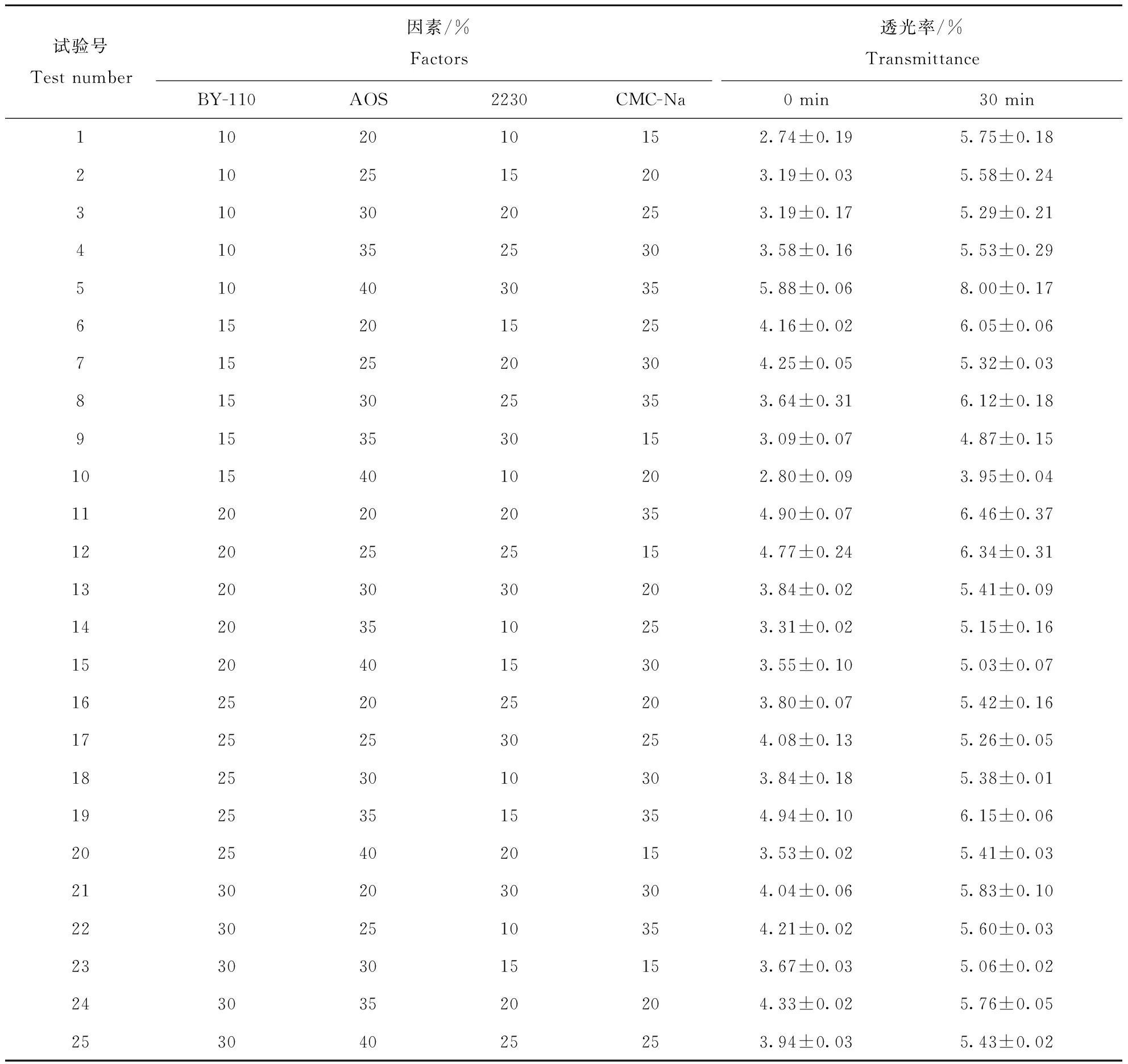
表3 正交实验表及孢子悬浮液透光率测定结果Table 3 Orthogonal experimental table and the determination of the transmittance of conidial suspension
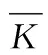
表4 悬浮液静置0 min透光率试验因子值Ki和分析结果Table 4 Test Factor Ki and of the transmittance of conidial suspension static 0 min
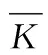
表5 悬浮液静置30 min透光率(分散性)试验因子水平指标Ki和值和分析结果Table 5 Test Factor Ki and of the transmittance of conidial suspension static 0 min
静置0 min和静置30 min的透光率分别反映了悬浮液颗粒的分散性能与悬浮性能。极差分析给出二者的最优表面活性剂方案略有不同,这表明表面活性剂在悬浮液体系中的分散和稳定作用存在差异,适当增加高分子表面活性剂的用量可有效改善分散体系的悬浮稳定性。
悬浮液透光率因子极差R分析结果见表6。从表中可以看出,静置0 min试验因子影响力的主次排序为DCAB,其中D为主要因子,C、A、B为次要因子。静置30 min试验因子影响力的主次排序为DACB,其中D为主要因子,A、C、B为次要因子。
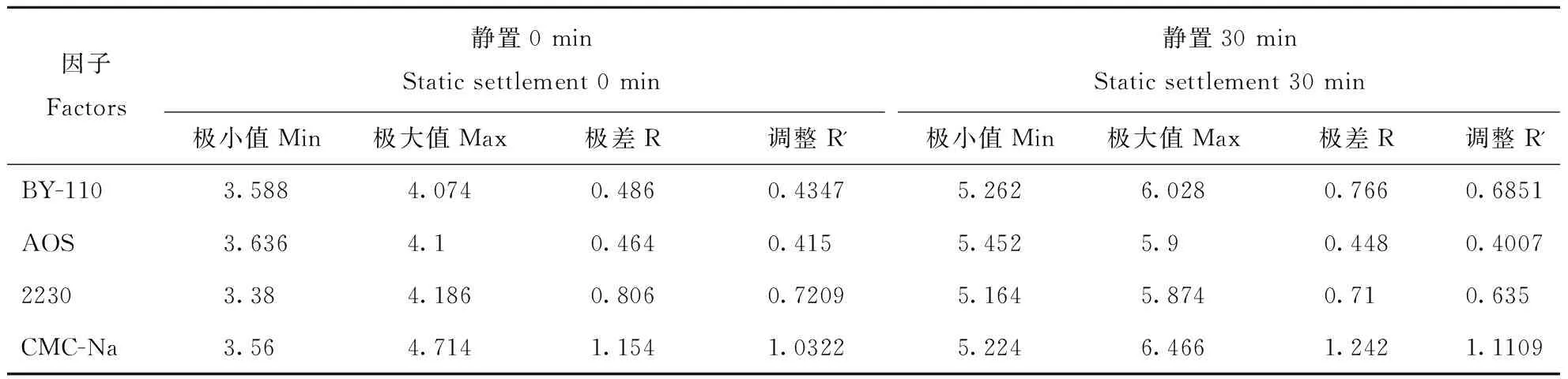
表6 悬浮液透光率因子极差分析结果Table 6 Factor range analysis result of the transmittance of conidial suspension
以因子的水平做横坐标,指标的平均值作纵坐标,绘制因子与指标关系趋势图(图5),从图可以看出试验指标(试验结果)随水平变化趋势。静置0 min孢子悬浮液而言最优水平组合为A2B3C1D1,试验因素影响力的主次排序为DCAB;静置30 min孢子悬浮液而言最优水平组合为A2B3C1D2,试验因素影响力的主次排序为DACB。
综上所述,得到基于悬浮液分散性的最优表面活性剂方案为A2B3C1D1,即表面活性剂复配方案:BY-110(15%)、AOS(30%)、2230(10%)、CMC-Na(15%);得到基于悬浮液悬浮性的表面活性剂方案为A2B3C1D2,即表面活性剂复配方案:BY-110(15%)、AOS(30%)、2230(10%)、CMC-Na(20%)。
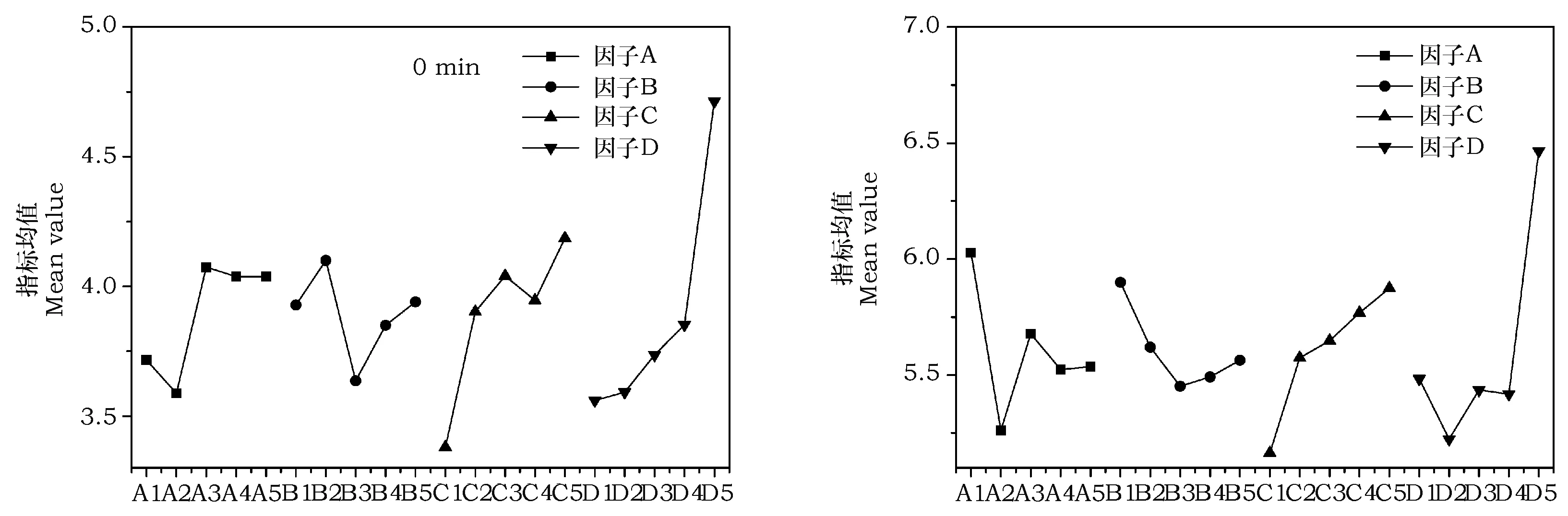
图5 悬浮液透光率试验因子与响应指标关系趋势图Fig.5 Relationship between the test factor and the response index of transmittance of conidial suspension
3 讨论
在微生物活体农药开发研究中,配套制剂技术研究是其产品开发和推广应用的重要基础[13]。适合作为微生物源农药的剂型很多,其中可湿性粉剂和水分散粒剂均为固体剂型且需要兑水形成喷雾液使用,具有水基型制剂和固体制剂的双重优点[14],它既避免了液体制剂运输贮存不便的缺点,又克服了粉剂、细颗粒剂等药效差和施用不便的缺陷,是目前微生物农药最为常见的剂型。
真菌杀虫剂是以虫生真菌分生孢子为活性物的活体微生物源农药,由于分生孢子表面具有较强的疏水性,因此其制剂加工难度普遍高于化学农药[15]。开发真菌可湿性粉剂或水分散粒剂,要求制剂兑水稀释后能够形成较为稳定的悬浮液,不易堵塞喷头且喷雾均匀。分散均匀悬浮稳定的孢子悬浮液的形成主要依赖表面活性剂的使用。具有分散稳定作用的表面活性剂能够使固体颗粒在水相中长时间保持均匀分散,并阻止固液两分散系中固体颗粒相互凝集结团[4],其作用机理在于表面活性剂分子可吸附在固体粒子表面,在粒子周围形成电荷或空间位阻势垒,从而起到阻止粒子之间相互靠近聚集并最终沉降的作用。
真菌制剂兑水稀释后形成的孢子悬浮液属于粒子低浓度分散悬浮体系,如何准确表征孢子粉颗粒兑水后短时间内的分散行为是选择分散剂的关键。紫外透光率测定常用于各种分散体系颗粒分散行为的表征[5,6,16~18],可直观准确揭示分散相在水中的分散与沉降行为。本文以悬浮体系透光率测定作为依据,筛选出对玫烟色棒束孢孢子粉具有良好分散稳定作用的表面活性剂并进行了复配方案的正交优化,基于悬浮液分散稳定性给出了优化的表面活性剂方案,同时显示出高分子和非离子表面活性剂是玫烟色棒束孢孢子悬浮液分散稳定性的主要影响因素。
高分子表面活性剂具有较大的分子量,高分子链可在分散介质中充分伸展形成吸附层,从而产生空间位阻效应,虽然高分子表面活性剂到粒子表面的扩散过程较慢,但其吸附能力强, 不易从表面转移, 能提供优良的分散稳定性[20,21]。同时,高分子和其他表面活性剂之间能够产生协同效应,表现为复合体系比单一表面活性剂或高分子体系具有更优异的性能,例如高分子可与非离子表面活性剂发生缔合作用而展现出更高的表面活性[22]。有机硅表面活性剂的疏水基团是由烷基硅氧烷主链所组成,其疏水性能比传统的碳链烃类表面活性剂更强,其溶液对疏水界面表现出更优良的展着性、润湿性、渗透性,能极大地促进药液扩展,因此常用作喷雾助剂和叶面吸收助剂[23,24],同时疏水端易水解产生硅羟基的有机硅表面活性剂具有一定的分散作用[25]。
4 结论
本研究以悬浮液透光率测定,从悬浮液分散和悬浮稳定性的角度对应用于玫烟色棒束孢孢子悬浮液的表面活性剂进行了筛选,明确了单独使用非离子表面活性剂BY-110(加入量10%~30%)、阴离子表面活性剂AOS(加入量20%~40%)、高分子表面活性剂CMC-Na(加入量15%~35%)、有机硅表面活性剂2230(加入量10%~30%)可获得具有较好分散与悬浮稳定性的孢子悬浮液,同时对以上表面活性剂的复配方案进行了正交优化,结果表明:具有较高分散性的表面活性剂复配方案为BY-110(15%)、AOS(30%)、2230(10%)、CMC-Na(15%);具有较高悬浮稳定性的表面活性剂复配方案为BY-110(15%)、AOS(30%)、2230(10%)、CMC-Na(20%)。

