灰葡萄孢犬尿氨酸单加氧酶基因BcKMO 与病菌cAMP信号途径的关系
袁雪梅,王敏,藏金萍,曹宏哲,张康,张靖,邢继红,董金皋
灰葡萄孢犬尿氨酸单加氧酶基因与病菌cAMP信号途径的关系
袁雪梅,王敏,藏金萍,曹宏哲,张康,张靖,邢继红,董金皋
(河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室/河北农业大学真菌毒素与植物分子病理学实验室,河北保定 071000)
【目的】明确灰葡萄孢()犬尿氨酸单加氧酶基因与病菌cAMP信号途径之间的关系,为进一步阐明调控灰葡萄孢生长、发育和致病力的分子机制打下基础。【方法】利用cAMP信号途径特异性抑制剂SQ22536,检测灰葡萄孢野生型BC22、的T-DNA插入突变体BCG183和回复菌株BCG183/对cAMP信号途径特异性抑制剂的敏感性;分别提取灰葡萄孢野生型BC22、突变体BCG183和回复菌株BCG183/中的cAMP,利用HPLC检测各菌株中cAMP的含量;利用real-time PCR技术检测与cAMP信号途径中cAMP依赖的蛋白激酶(PKA)的催化亚基基因和、调节亚基基因、编码异源三聚体G-蛋白G亚基基因和在病菌不同发育阶段、组织部位以及培养条件下的表达规律;利用real-time PCR技术检测突变体中cAMP信号途径关键基因、、、、的表达水平;利用real-time PCR技术检测cAMP信号途径关键基因、、、、的RNAi突变中的表达水平。【结果】灰葡萄孢的T-DNA插入突变体BCG183对cAMP信号途径特异性抑制剂SQ22536不敏感,受抑制的程度明显低于野生型BC22和回复菌株BCG183/。的T-DNA插入突变体BCG183中cAMP含量明显低于野生型菌株BC22和回复菌株BCG183/。与cAMP信号途径中cAMP依赖的蛋白激酶(PKA)的催化亚基基因、编码异源三聚体G-蛋白G亚基基因和的表达规律基本一致,均为在7 d的菌丝和菌核中表达水平较高;此外,和cAMP信号途径关键基因、、、、均为在含果糖培养基上培养的病菌中表达水平较高。的T-DNA插入突变体BCG183中cAMP信号途径关键基因、、、、的表达水平均明显高于野生型BC22和回复菌株BCG183/。、的RNAi突变体中表达水平明显高于野生型,而、、的RNAi突变体中表达水平明显低于野生型。【结论】负调控cAMP信号途径关键基因、、、、的表达;cAMP信号途径关键基因、负调控的表达,而cAMP信号途径关键基因、、正调控的表达。
灰葡萄孢;;cAMP信号途径
0 引言
【研究意义】灰葡萄孢()是一种重要的植物病原真菌,在全球230多种植物上造成灰霉病[1-2]。由于灰葡萄孢的寄主范围广泛,遗传变异速度快,产生的菌核抵抗逆境能力强,使得灰霉病很难防控[3-6]。随着灰葡萄孢菌株B05.10和T4基因组序列的发布,灰葡萄孢已经成为研究病原物与植物互作的模式真菌[7]。探究灰葡萄孢生长、发育与致病的分子机制,不仅可为制定持久控制灰霉病的策略提供理论依据和实践基础,同时对研究其他真菌的遗传、发育和致病性具有重要参考价值。【前人研究进展】灰葡萄孢的cAMP信号途径在病菌生长、发育和致病过程中发挥着重要的调控作用[8],该途径中包括3个编码异源三聚体G-蛋白G亚基(Gsubunits)的基因[9-10]、[11]和[12],腺苷酸环化酶编码基因(adenylate cyclase)[13],cAMP依赖的蛋白激酶(the cAMP-dependent protein kinase,PKA)催化亚基基因(PKA catalytic subunit)、(PKA catalytic subunit)和调节亚基基因(PKA regulatory subunit)[14],这些基因突变均会影响病菌的生长、发育和致病力。的缺失突变体∆能够产生分生孢子,穿透植物组织,但不能产生软腐症状[9-10]。和的缺失突变体Δ和Δ虽可以侵染寄主,但是侵染速度较野生型缓慢[11-12]。的缺失突变体Δ在寄主体内不能产生分生孢子,但在培养基上的产孢能力不受影响,侵染速度较野生型慢[13]。的缺失突变体Δ生长缓慢,不能在寄主叶片上产生病斑,但在寄主叶片上的产孢能力不受影响[14]。的缺失突变体Δ在生长速度、分生孢子萌发、侵染寄主等方面与野生型没有明显差别[14]。缺失会导致突变体组成型激活PKA,使突变体∆的表型与突变体∆基本一致[14]。【本研究切入点】实验室前期获得了灰葡萄孢致病相关基因(kynurenine 3-monooxygenase),明确了正调控病菌的生长、发育,负调控病菌的致病力,确定了通过调控病菌的胞壁降解酶活性、毒素活性、产酸能力、致病相关基因及信号途径基因的表达而影响病菌的致病力[15-17]。但是该基因与病菌cAMP信号途径之间的关系尚未明确。【拟解决的关键问题】通过检测灰葡萄孢突变体对cAMP信号途径抑制剂的敏感性、突变体中cAMP含量以及与cAMP信号途径关键基因的表达规律、突变对cAMP信号途径关键基因表达的影响,以及cAMP信号途径关键基因突变对表达的影响,确定与cAMP信号途径关键基因之间的关系,为阐明调控病菌生长、发育和致病力的分子机制打下基础。
1 材料与方法
试验于2017年在河北省植物生理与分子病理学重点实验室/河北农业大学真菌毒素与植物分子病理学实验室完成。
1.1 试验材料
灰葡萄孢野生型菌株BC22、的T-DNA插入突变体BCG183、回复菌株BCG183/、cAMP信号途径关键基因、、、、的RNAi突变体菌株,均由河北农业大学真菌毒素与植物分子病理学实验室保存并提供。
1.2 突变体对cAMP信号途径抑制剂的敏感性检测
在灭菌后的PDA培养基中加入cAMP信号途径特异性的抑制剂SQ22536母液,使SQ22536终浓度为10 μmol·L-1,然后接种培养7 d的灰葡萄孢野生型菌株BC22、的T-DNA插入突变体BCG183和的回复菌株BCG183/的菌盘(直径为5 mm),20℃条件下培养,观测病菌菌落的生长速率。同时,以在PDA培养基中加入与SQ22536母液等量的DMSO为空白对照。
1.3 突变体中cAMP的含量检测
分别提取灰葡萄孢野生型BC22、突变体BCG183和回复菌株BCG183/中的cAMP,利用HPLC检测各菌株中cAMP的含量。cAMP的提取方法:称取约0.1 g样本,加入液氮研磨后,加入1 mL水,并将其转移至1.5 mL离心管中,50℃水浴1 h并且振荡3—4次,8 000×离心10 min,取上清液,氮气吹干后定容至0.5 mL,涡旋振荡溶解,过滤后待测。HPLC液相条件:Agilent 1100高效液相色谱仪,Kromasil C18反相色谱柱(250 mm×4.6 mm,5 μm),流动相A:一定浓度的KH2PO4水溶液。流动相B:色谱级甲醇1 L,A﹕B=80﹕20。样品进样量10 μL,流速0.8 mL·min-1,柱温30℃,走样时间为20 min,紫外波长254 nm。
1.4 BcKMO与cAMP信号途径关键基因的表达规律分析
1.4.1 病菌不同发育阶段、不同部位的基因表达规律分析 分别收集野生型菌株BC22的菌丝生长时期、附着胞发育时期、分生孢子时期和菌核发育时期的菌丝、分生孢子和菌核,提取其RNA,反转录成cDNA。利用real-time PCR技术,以作为内参,分析和cAMP途径关键基因、、、、的表达规律。反应体系(10 μL):模板cDNA 1.0 μL、Mix(5 U·μL-1)5 μL、引物(10 μmol·L-1)0.2 μL。反应程序:95℃ 10 min;94℃ 30 s、58℃ 30 s、72℃ 30 s,循环数为35次,每个样品重复3次。
1.4.2 不同培养条件对和cAMP信号途径关键基因表达的影响 将灰葡萄孢野生型菌株BC22分别接种在含蔗糖、葡萄糖、果糖、甘油的YEB培养基中,在20℃黑暗条件下培养7 d,提取其RNA,反转录成cDNA。以作为内参,利用real-time PCR技术,分析、、、、的表达情况。具体反应体系同上。
1.5 BcKMO基因突变对cAMP信号途径关键基因表达的影响
利用real-time PCR技术,检测野生型菌株BC22、突变体BCG183、回复菌株BCG183/中cAMP信号途径关键基因的表达水平。以BC22、BCG183、BCG183/的cDNA为模板,以为内参,用cAMP信号途径关键基因的特异性引物(表1)进行荧光定量PCR检测。
1.6 cAMP信号途径关键基因突变对BcKMO表达的影响
利用real-time PCR技术,检测cAMP信号途径关键基因RNAi突变体中的表达水平。以cAMP信号途径关键基因RNAi突变体的cDNA为模板,为内参,用特异性引物(表1)进行荧光定量PCR检测。
2 结果
2.1 突变体对cAMP信号途径抑制剂的敏感性
检测灰葡萄孢野生型菌株BC22、的T-DNA插入突变体BCG183和回复菌株BCG183/对cAMP信号途径特异性抑制剂SQ22536的敏感性,发现突变体BCG183对抑制剂SQ22536的敏感性明显低于野生型和回复菌株,抑制率测定结果也表现出突变体BCG183受抑制的程度明显降低(图1)。
2.2 突变体中cAMP含量检测
利用HPLC方法,检测灰葡萄孢野生型BC22、突变体BCG183和回复菌株BCG183/中的cAMP含量。结果发现,突变体BCG183中cAMP含量明显低于野生型和回复菌株BCG183/(图2)。
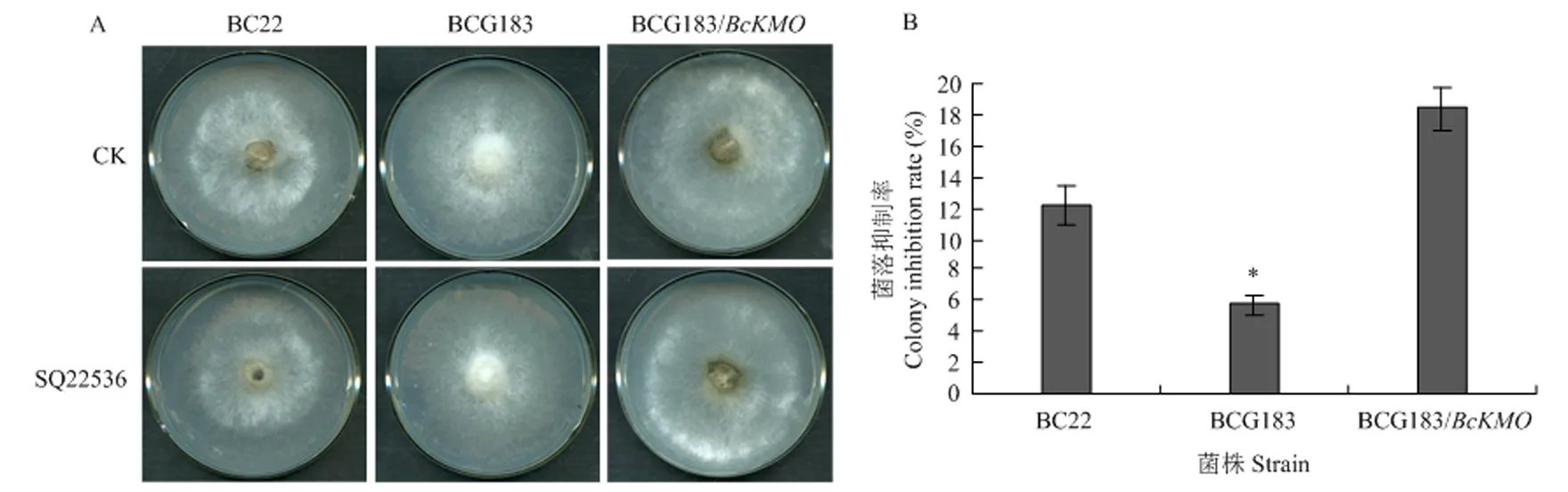
A:敏感性测定Sensitivity detection;B:抑制率检测Detection of inhibition rate
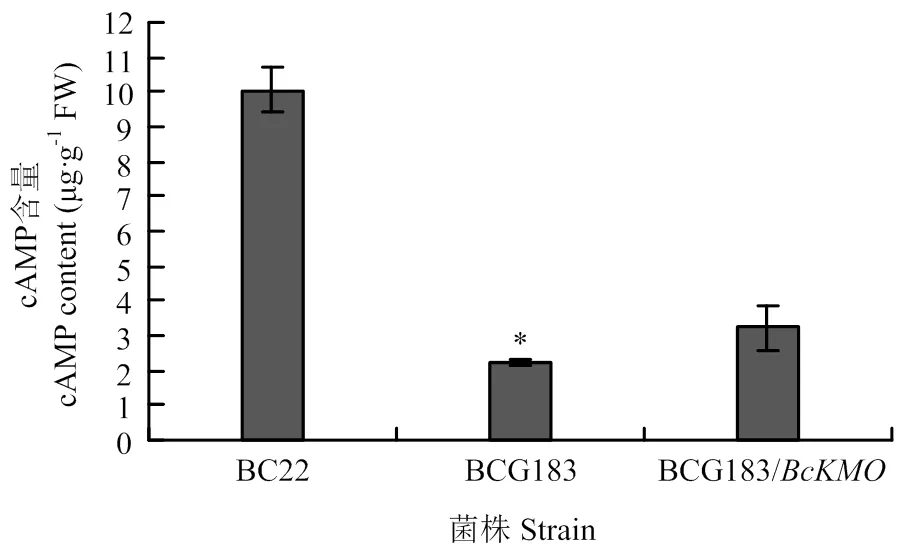
图2 突变体中cAMP含量的测定
2.3 BcKMO与cAMP信号途径关键基因的表达规律分析
2.3.1 病菌不同发育阶段、不同组织部位的基因表达分析 利用real-time PCR技术,以作为内参基因,检测在病菌不同发育阶段、不同部位和cAMP信号途径关键基因的表达情况。结果发现,和cAMP信号途径关键基因在菌丝、分生孢子和菌核中均有所表达,在6—8 d的菌丝和菌核中表达水平高;cAMP途径关键基因、、的表达规律与基本一致,均是在6、7 d的菌丝和菌核中表达水平高;cAMP途径关键基因、在6、7 d的菌丝中表达水平较高,但在菌核和分生孢子中的表达水平相对较低(图3)。

表1 Real-time PCR引物设计
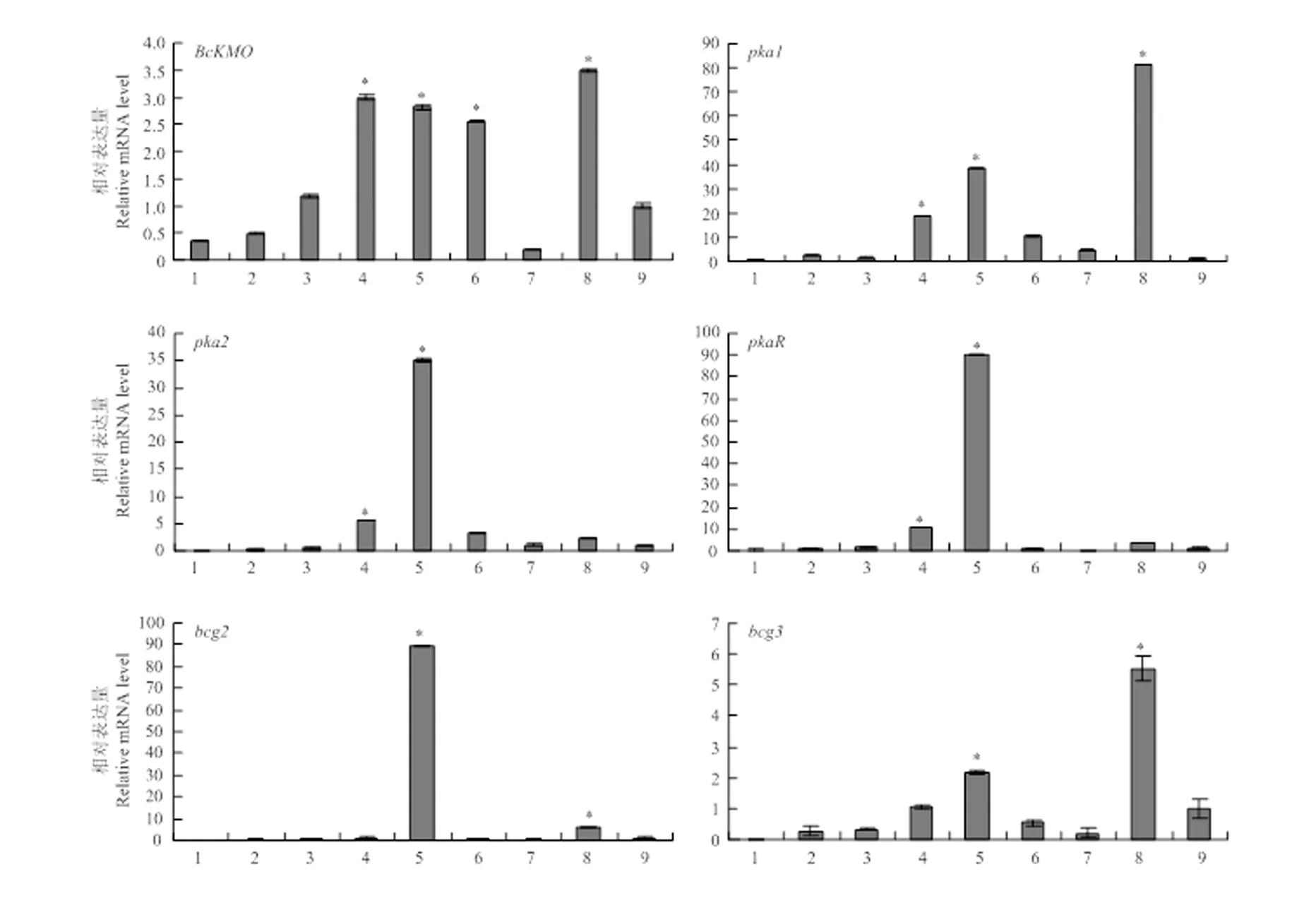
1—6:菌丝生长第3—8天 The 3rd to 8th day of mycelia growth;7:菌丝生长第15天 The 15th day of mycelia growth;8:菌核 Scleroia;9:分生孢子Conidia
2.3.2 不同培养条件对和cAMP信号途径关键基因表达的影响 提取不同培养条件下生长的野生型菌株BC22的总RNA,反转录成cDNA,利用real-time PCR技术,以作为内参基因,检测和cAMP信号途径关键基因的表达水平。结果发现,和cAMP信号途径关键基因均在含果糖的培养基培养的病菌中表达水平最高(图4)。
2.4 BcKMO基因突变对cAMP信号途径关键基因表达的影响
利用real-time PCR技术,检测野生型菌株BC22、突变体BCG183和回复菌株BCG183/中cAMP信号途径关键基因的表达情况。结果发现,野生型和回复菌株中cAMP信号途径关键基因表达水平基本一致,而在突变体BCG183中cAMP途径关键基因、、、、的表达水平均明显高于野生型和回复菌株(图5)。
2.5 cAMP信号途径关键基因突变对BcKMO表达的影响
利用real-time PCR技术,检测cAMP信号途径关键基因RNAi突变体中的表达水平。结果发现,、的RNAi突变体中表达水平明显高于野生型,而、、的RNAi突变体中表达水平明显低于野生型(图6)。
3 讨论
真菌的cAMP信号途径可以参与不同的生物进程,包括病菌的生长[18]、分生孢子形成[19]、分生孢子萌发[20-23]、次生代谢[24-25]、营养感知[26-27]、应激反应[18,23]、菌核发育[28]、致病性或毒力[29]。灰葡萄孢cAMP信号途径相关基因突变影响病菌的生长、发育和致病力,如[9-10]、[11]、[12]、[13]、、和[14]等基因突变均会影响病菌的生长、发育和致病力。
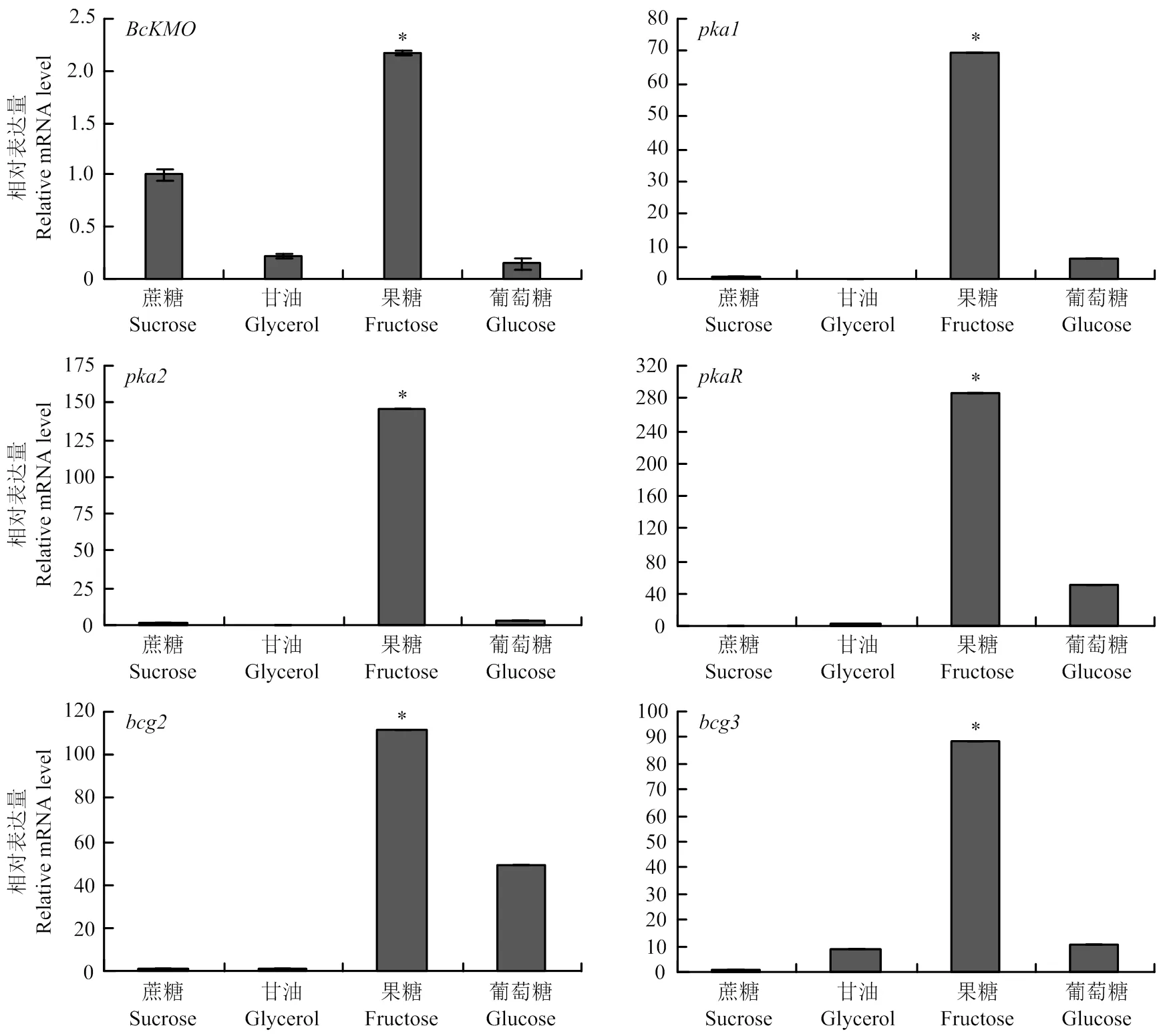
图4 不同培养条件对BcKMO和cAMP信号途径关键基因表达的影响
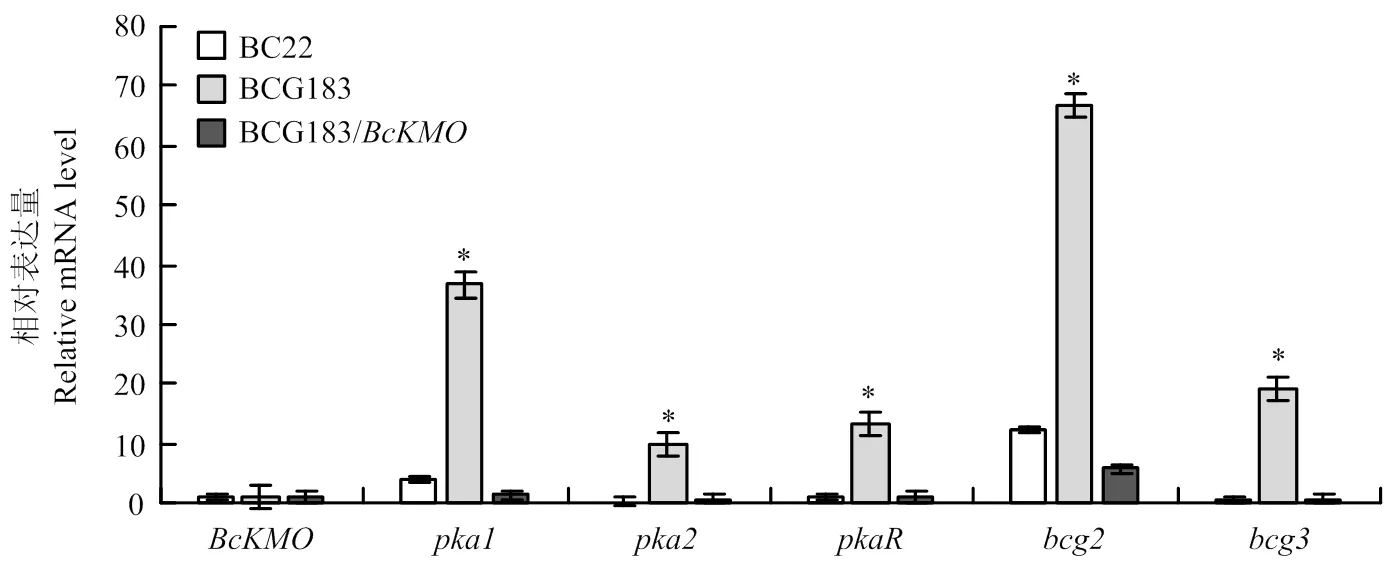
图5 突变体BCG183和BCG183/BcKMO中cAMP信号途径关键基因的表达分析
笔者实验室前期明确了正调控病菌的生长、发育,负调控病菌的致病力[15-16],但是该基因是否通过病菌的cAMP信号途径起作用,以及该基因与病菌cAMP信号途径关键基因之间的关系尚未明确。本研究发现的T-DNA插入突变体BCG183对cAMP信号途径特异性抑制剂SQ22536不敏感,其抑制率明显低于野生型和回复菌株;而回复菌株的抑制率明显高于野生型,这与回复菌株中的高水平表达相一致[16],表明的表达水平与菌株对抑制剂的敏感性呈正相关。突变体BCG183和回复菌株中的cAMP含量明显低于野生型,且突变体BCG183中的cAMP含量最低,表明菌株中的高水平表达和低水平表达均对体内cAMP含量造成影响。进一步研究发现,与cAMP信号途径关键基因在表达规律上存在一定的相关性,由此确定与病菌的cAMP信号途径密切相关,该基因通过病菌cAMP信号途径对病菌生长、发育和致病力的起调控作用。
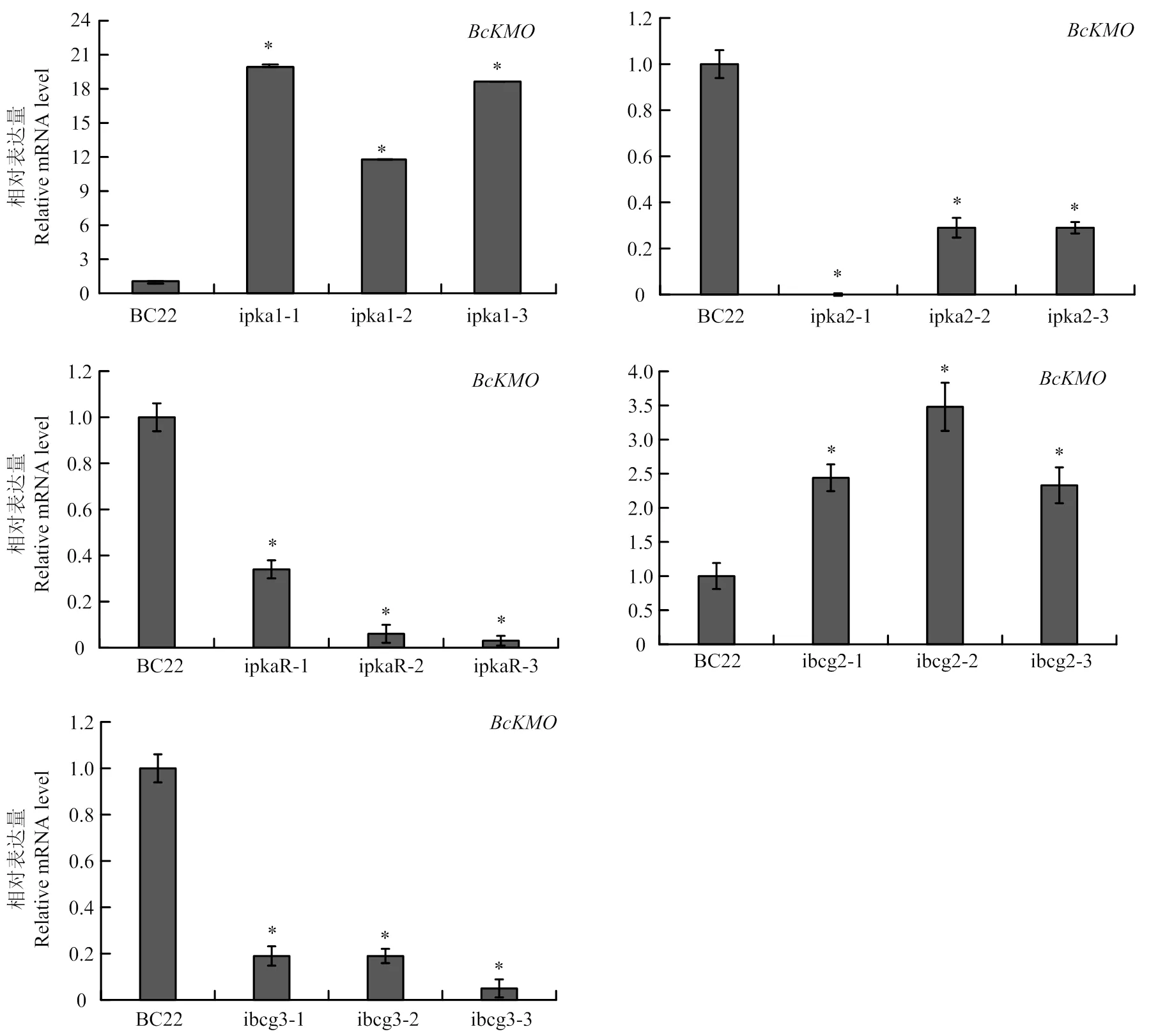
图6 cAMP途径关键基因的RNAi突变体中BcKMO表达分析
利用real-time PCR技术,检测突变体BCG183中cAMP信号途径关键基因的表达水平,发现突变体BCG183中cAMP途径关键基因、、、、的表达水平均明显高于野生型和回复菌株,这说明基因突变上调、、、、的表达,表明负调控病菌cAMP信号途径关键基因的表达。利用real-time PCR技术,检测cAMP信号途径关键基因、、、、的RNAi突变体中的表达水平,发现在、的RNAi突变体中上调表达,在、、的RNAi突变体中均下调表达,表明、负调控的表达,、、正调控的表达。
研究结果确定了与病菌cAMP信号途径密切相关,明确了与cAMP信号途径关键基因、、、、之间的调控关系,但是通过cAMP信号途径调控病菌生长、发育和致病力的分子机制尚未明确,需要进一步的深入研究。
4 结论
灰葡萄孢负调控cAMP途径关键基因、、、、的表达。cAMP途径关键基因、负调控的表达,而cAMP途径关键基因、、正调控的表达。
[1] Williamson B, Tudzynski B, Tudzynski P, van Kan J A.: The cause of grey mould disease., 2007, 8(5): 561-580.
[2] Elad Y, Williamson B, Tudzynski P, Delen N.spp., and diseases they cause in agricultural systems-an introduction//. DordrechtNetherlands: Kluwer Academic Publishers, 2007: 1-8.
[3] van Kan J A. Licensed to kill: The lifestyle of a necrotrophic plant pathogen., 2006, 11(5): 247-253.
[4] Rosslenbroich H J, Stuebler D.-history of chemical control and novel fungicides for its management., 2000, 19(8/10): 557-561.
[5] Tudzynski P, Kokkelink L.: Molecular aspects of a necrotrophic life style., 2009, 5: 29-50.
[6] Collado I G, Sanchez A J, Hanson J R. Fungal terpene metabolites: biosynthetic relationships and the control of the phytopathogenic fungus.,2007, 24: 674-686.
[7] Fillinger S, Amselem J, Artiguenave F, Billault A, Choquer M, Couloux A, Cuomo C, Dickman M, Fournier E, Gioti A, Giraud C, Kodira C, Kohn L, Legeai F, Levis C, Mauceli E, Pommier C, Pradier J M, Que´villon E, Rollins J, Se´gurens B, Simon A, Viaud M, Weissenbach J, Wincker P, Lebrun M H. The genome projects of the plant pathogenic fungiand//Jeandet P, Clement C, Conreux A., 2007: 125-133.
[8] Schumacher J, Kokkelink L, Huesmann C, Jimenez- Teja D, Collado I G, Barakat R, Tudzynski P, Tudzynski B. The cAMP-dependent signaling pathway and its role in conidial germination, growth, and virulence of the gray mold., 2008, 21(11): 1443-1459.
[9] Schulze G C, Schorn C, Tudzynski B. Identification ofgenes up-regulated during infection and controlled by the Galpha subunit BCG1 using suppression subtractive hybridization (SSH)., 2004, 17(5): 537-546.
[10] Schumacher J, Viaud M, Simon A, Tudzynski B. The Galpha subunit BCG1, the phospholipase C (BcPLC1) and the calcineurin phosphatase co-ordinately regulate gene expression in the grey mould fungus., 2008, 67(5): 1027-1050.
[11] Döhlemann G, Berndt P, Hahn M. Different signalling pathways involving a Galpha protein, cAMP and a MAP kinase control germination ofconidia., 2006, 59(3): 821-835.
[12] Gronover C S, Kasulke D, TudzynskiP, Tudzynski B. The role of G protein alpha subunits in the infection process of the gray mold fungus., 2001, 14(11): 1293-1302.
[13] Klimpel A, Gronover C S, Williamson B, Stewart J A, Tudzynski B. The adenylate cyclase (BAC) inis required for full pathogenicity., 2002, 3(6): 439-450.
[14] Choquer M, Fournier E, Kunz C, Levis C, Pradier J M, Simon A, Viaud M.virulence factors: new insights into a necrotrophic and polyphageous pathogen., 2007, 277(1): 1-10.
[15] 张玉净, 郝志敏, 郑蒙, 张金林, 董金皋. 灰葡萄孢产孢缺陷菌株的遗传分析. 华北农学报, 2011, 26(3): 86-89.
Zhang Y J, Hao Z M, Zheng M, Zhang J L, Dong J G. Genetic analysis of sporulation defective in., 2011, 26(3): 86-89. (in Chinese)
[16] 李培芬, 赵福鑫, 董丽萍, 郑会欣, 赵斌, 张靖, 司贺龙, 邢继红, 韩建民, 董金皋. 灰葡萄孢在病菌生长、发育和致病过程中的功能. 中国农业科学, 2014, 47(15): 2971-2979.
Li P F, Zhao F X, Dong L P, Zheng H X, Zhao B, Zhang J, Si H L, Xing J H, Han J M, Dong J G. Function analysis ofgene in growth, development and pathogenicity of., 2014, 47(15): 2971-2979. (in Chinese)
[17] 李培芬, 赵福鑫, 董丽萍, 郑会欣, 赵斌, 韩建民, 邢继红, 董金皋. 灰葡萄孢犬尿氨酸单氧酶基因调控病菌致病力的机制分析. 中国农业科学, 2014, 47(16): 3167-3173.
Li P F, Zhao F X, Dong L P, Zheng H X, Zhao B, Han J M, Xing J H, Dong J G. Mechanism analysis of kynurenine 3-monooxygenase genein regulation of pathogenicity in., 2014, 47(16): 3167-3173. (in Chinese)
[18] Ni M, Rierson S, Seo J A, Yu J H. Thegene encoding the secondary protein kinase A catalytic subunit has a synthetic lethal interaction with PkaA and plays overlapping and opposite roles in., 2005, 4(8): 1465-1476.
[19] Takano Y, Komeda K, Kojima K, Okuno T. Proper regulation of cyclic AMP-dependent protein kinase is required for growth, conidiation, and appressorium function in the anthracnose fungus., 2001, 14(10): 1149-1157.
[20] Fillinger S, Chaveroche M K, Shimizu K, Keller N, d’Enfert C. cAMP and Ras signaling independently control spore germination in the filamentous fungus.,2002, 44(4): 1001-1016.
[21] Liebmann B, Gattung S, Jahn B, Brakhage A A. cAMP signaling inis involved in the regulation of the virulence geneand in defense against killing by macrophages., 2003, 269(3): 420-435.
[22] Yamauchi J, Takayanagi N, Komeda K, Takano Y, Okuno T. cAMP-pKA signaling regulates multiple steps of fungal infection cooperatively with Cmk1 MAP kinase in., 2004, 17(12): 1355-1365.
[23] Zhao W, Panepinto J C, Fortwendel J R, Fox L, Oliver B G, Askew D S, Rhodes J C. Deletion of the regulatory subunit of protein kinase A inalters morphology, sensitivity to oxidative damage, and virulence., 2006, 74(8): 4865-4874.
[24] Roze L V, Beaudry R M, Keller N P, Linz J E. Regulation of aflatoxin synthesis by FadA/cAMP/protein kinase A signaling in., 2004, 158(2): 219-232.
[25] Shimizu K, Hicks J K, Huang T P, Keller N P. Pka, Ras and RGS protein interactions regulate activity of AflR, a Zn(II)2Cys6 transcription factor in., 2003, 165(3): 1095-1104.
[26] Bahn Y S, Xue C, Idnurm A, Rutherford J C, Heitman J, Cardenas M E. Sensing the environment: Lessons from fungi., 2007, 5: 57-69.
[27] Thevelein J M, Gelade R, Holsbeeks I, Lagatie O, Popova Y, Rolland F, Stolz F, Van de Velde S, Van Dijck P, Vandormael P, Van Nuland A, Van Roey K, Van Zeebroeck G, Yan B. Nutrient sensing systems for rapid activation of the protein kinase A pathway in yeast., 2005, 33(1): 253-256.
[28] Jurick W M, Rollins J A. Deletion of the adenylate cyclase (Sac1) gene affects multiple developmental pathways and pathogenicity in.,2007, 44(6): 521-530.
[29] Mehrabi R, Kema G H. Protein kinase A of the ascomycete pathogenregulate asexual fructification, filamentation, melanization, and osmosensing.,2006, 7(6): 565-577.
(责任编辑 岳梅)
Relationship between kynurenine 3-monooxygenase geneand cAMP signaling pathway in
YUAN Xuemei, WANG Min, ZANG Jinping, CAO Hongzhe, ZHANG Kang, ZHANG Jing, XING Jihong, DONG Jingao
(College of Life Sciences, Hebei Agricultural University/Key Laboratory of Hebei Province for Plant Physiology and Molecular Pathology/Mycotoxin and Molecular Plant Pathology Laboratory of Hebei Agricultural University, Baoding 071000, Hebei)
【Objective】The objective of this study is to analyze the relationship betweenand cAMP signaling pathway in, and to lay a foundation for clarifying the molecular mechanism of thein growth, development and pathogenicityin. 【Method】A specific inhibitor SQ22536 of cAMP signaling pathway was used to detect the sensitivity of the wild-type strain BC22, theT-DNA insertion mutant BCG183, and thecomplementing mutant BCG183/. The cAMP was extracted from the wild-type strain BC22, theT-DNA insertion mutant BCG183, and thecomplementing mutant BCG183/and detected by using HPLC assay, respectively. Real-time PCR technology was used to detectexpression pattern of the,the PKA catalytic subunit geneand, the PKA regulatory subunit gene, G-protein Gsubunits geneandBC22. The expression level of cAMP signaling pathway key genes,,,, andmutants BCG183 and BCG183/was detected by using real-time PCR technology. The expression levelofin RNAi mutantsof cAMP signaling pathway key genes,,,, andwas detected by using real-time PCR technology.【Result】TheT-DNA insertion mutant BCG183 was insensitive to the cAMP signaling pathway specific inhibitor SQ22536. The inhibition rate of the cAMP signaling pathway specific inhibitor SQ22536 to mutant BCG183 was significantly lower than the wild-type strain BC22and thecomplementing mutant BCG183. The cAMP content of the mutant BCG183 was significantly lower than that of the wild-type strain BC22 and the mutant BCG183/. The expression pattern of, the PKA catalytic subunit gene, G-protein Gsubunits geneandwas basically the same, and the expression level of,,, andwas higher in 7th day of mycelia and sclerotia of BC22. In addition,the expression level ofand the cAMP signaling pathway key genes,,,, andwas higher in BC22 cultured on medium with fructose. The expression level of cAMP signaling pathway key genes,,,,strains BC22 and BCG183/. Theexpression level in the RNAi mutants ofandwas obviously higher than that of BC22, theexpression level in the RNAi mutants of,, andwas obviously lower than that of BC22.【Conclusion】Thenegatively regulated the expression of,,,, and. Theandnegatively regulated theexpression, and the,, andpositively regulated theexpression.
;; cAMP signaling pathway
2018-01-23;
2018-03-02
河北省自然科学基金(C2018204045)、河北省高等学校科学技术研究项目(ZD2016001)、河北省留学人员科技活动择优资助项目(0316012)
袁雪梅,E-mail:2420788532@qq.com。王敏,E-mail:1546994436@qq.com。袁雪梅和王敏为同等贡献作者。
邢继红,E-mail:xingjihong2000@126.com。通信作者董金皋,E-mail:dongjingao@126.com
10.3864/j.issn.0578-1752.2018.13.006

