程序性死亡配体1在结直肠癌中的表达及作用
汤国军,胡丛岗,童骎,姚叶锋,杨伟东
(1. 浙江金华广福肿瘤医院 胃肠外科,浙江 金华 321000;2. 宁波市鄞州区第二医院,麻醉科 浙江 鄞州 315100)
结直肠癌的治疗方式主要以手术治疗为主,术后辅助放化疗及免疫治疗等,随着手术方式的改进、放射治疗及化疗药物种类的增多,及免疫治疗药物的研发,使结直肠癌的治疗取得巨大进步[1-2],但由于结直肠癌缺乏有效的早期诊断指标,使多数结直肠癌患者发现时已为结直肠癌晚期,错过了手术时机,预后比较差;对于结直肠晚期患者的治疗主要依赖分子靶向药物治疗和细胞因子制剂治疗[3-4],但结直肠癌的5年生存率仍比较低, 因此研究结直肠癌发病过程中的关键性分析对结直肠癌患者的诊治及开发新的分子靶向药物具有重要意义。程序性死亡配体1(PD-L1)在免疫耐受方面发挥重要作用,在多种恶性肿瘤中异常表达,和多种恶性肿瘤的预后和恶性程度有关[5-8]。本文对结直肠癌组织中PD-L1的表达情况及其对结直肠癌细胞生长的影响进行研究。
1 资料与方法
1.1 临床标本与细胞株
收集浙江金华广福肿瘤医院胃肠外科病理证实的结直肠癌标本100例、癌旁组织标本100例、结直肠腺瘤标本100例和正常结直肠组织标本100例,所有标本均经病理证实。排除标准:患其它部位原发恶性肿瘤者,消化道相关淋巴瘤者,手术前进行过放疗或化疗者,拒绝参与研究者。所有研究对象签署知情同意书,经浙江金华广福肿瘤医院伦理委员会审批。人结肠癌HCT116细胞株购自美国ATCC公司;兔抗人PD-L1单克隆抗体、免疫组化染色试剂盒购自英国ABCAM公司等。
1.2 实验方法
1.2.1 免疫组化检测 将上述结直肠癌、结直肠腺瘤、癌旁组织和正常结直肠组织标本进行石蜡包埋,经石蜡切片标本采用免疫组织化学SP法测定各结直肠组织中PD-L1含量,一抗为兔抗人PD-L1单克隆抗体,阴性对照一抗以PBS液代替,细胞膜上出现棕黄色或者棕褐色染色为PD-L1阳性细胞。
1.2.2 PD-L1干扰载体制备 由上海吉玛公司设计和合成PD-L1 siRNA,并设计与人类基因没有同源性的siRNA作为阴性对照序列。
1.2.3 实验分组 将HCT116细胞分为3组:PDL1 siRNA组(转染PD-L1 siRNA)、阴性对照组(转染阴性对照siRNA)、空白对照组(不进行转染)。
1.2.4 结直肠癌细胞转染 取生长良好的结直肠癌细胞接种到6孔板中,加入培养液培养,细胞达80%左右融合时进行细胞转染,转染后继续培养48 h后进行干扰效率检测。
1.2.5 细胞PD-L1蛋白的表达检测 采用Western blot法测定各组结直肠癌细胞中PD-L1蛋白的表达情况:提取各组结直肠癌细胞总蛋白质,进行蛋白电泳,对实验条带进行拍照观察,采用Image J软件对目的条带进行灰度值分析,以β-actin为内参照计算各组细胞中PD-L1蛋白的相对表达量。
1.2.6 直肠癌细胞增殖检测 胰蛋白酶消化生长良好的的各组结直肠癌制成细胞悬液,接种到96孔板中,每组设6个复孔,采用MTT法测定各组结直肠癌细胞7 d内的生长情况,酶标仪测定波长490 nm处吸光度值,结直肠癌细胞的增殖情况以波长490 nm处的吸光度值表示。

图1 PD-L1免疫组化染色(×200) A:结直肠癌组织中PD-L1阳性表达;B:结直肠腺瘤组织中PD-L1阳性表达;C:癌旁组织中PD-L1阳性表达;D:正常结直肠组织中PD-L1阴性表达
1.2.7 细胞凋亡检测 各组细胞转染48 h后,进行Annexin V/PI双染色,采用流式细胞术法测定各组结直肠癌细胞凋亡情况。
1.2.8 细胞侵袭能力检测 将各组结直肠癌细胞接种到6孔板中培养24 h,进行细胞转染,转染后培养48 h,采用Transwell法测定各组细胞的侵袭能力。
1.3 统计学处理
采用SPSS 20.0软件进行分析,率的比较采用χ2检验,均数比较采用方差分析,组内两两比较采用LSD检验,P<0.05为差异有统计学意义。
2 结 果
2.1 PD-L1在结直肠癌组织中的表达情况
免疫组化染色结果显示,PD-L1在结直肠癌组织、结直肠腺瘤组织、癌旁组织、正常结直肠组织中的阳性表达率分别为45.0%、33.0%、10.0%、0,差异有统计学意义(P<0.05)(图1)(表1)。

表1 各组标本中PD-L1的阳性表达率[n=100,n(%)]

图2 Western blot检测结果 A:各组PD-L1表达水平;B:siRNA PD-L1转染后不同时间
2.2 siRNA PD-L1对结直肠癌细胞中PD-L1的干扰效率
Western blot检测siRNA PD-L1对HCT116细胞中PD-L1的干扰效率,结果发现:siRNA PD-L1转染后HCT116细胞中PD-L1的表达明显降低,转染后2 d对HCT116细胞中PD-L1的干扰效率最高(图2)。
2.3 siRNA PD-L1对结直肠癌细胞增殖的影响
各组细胞第1天OD值比较差异无统计学意义(P>0.05);第3、7天,siRNA PD-L1组结直肠癌细胞OD值低于阴性对照组和空白对照组(均P<0.05),阴性对照组和空白对照组结直肠癌细胞各时间点OD值比较差异无统计学意义(均P>0.05)(表2)。
表2 各组结直肠癌细胞OD值比较(±s)

表2 各组结直肠癌细胞OD值比较(±s)
注:1)与空白对照组比较,P<0.05;2)与阴性对照组比较,P<0.05
组别 第1天 第3天 第7天空白对照组 0.513±0.121 1.585±0.194 2.416±0.231阴性对照组 0.505±0.114 1.523±0.187 2.321±0.232 siRNA PD-L1 组 0.497±0.102 1.242±0.1781), 2)1.532±0.1921), 2)F 0.325 4.636 30.245 P 0.921 0.021 0.000
2.4 siRNA PD-L1对结直肠癌细胞凋亡的影响
siRNA PD-L1组细胞凋亡率高于阴性对照组和空白对照组(均P<0.05),阴性对照组和空白对照组凋亡率比较差异无统计学意义(P>0.05)(表3)。
2.5 siRNA PD-L1对结直肠癌细胞侵袭能力的影响
siRNA PD-L1组侵袭细胞数低于阴性对照组和空白对照组(P<0.05),阴性对照组和空白对照组侵袭细胞数比较差异无统计学意义(P>0.05)(表4)。
表3 各组结直肠癌细胞凋亡率(%,±s)
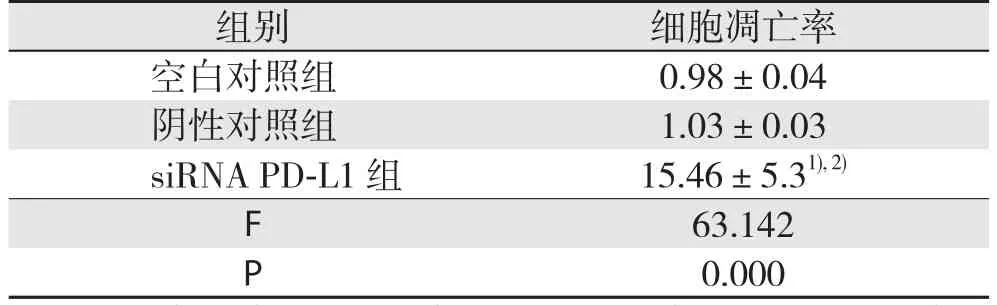
表3 各组结直肠癌细胞凋亡率(%,±s)
注:1)与空白对照组比较,P<0.05;2)与阴性对照组比较,P<0.05
组别 细胞凋亡率空白对照组 0.98±0.04阴性对照组 1.03±0.03 siRNA PD-L1 组 15.46±5.31), 2)F 63.142 P 0.000
表4 各组结直肠癌细胞侵袭细胞数(个,±s)
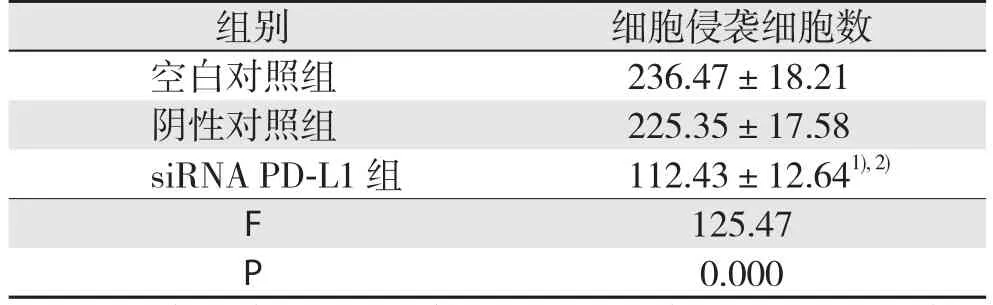
表4 各组结直肠癌细胞侵袭细胞数(个,±s)
注:1)与空白对照组比较,P<0.05;2)与阴性对照组比较,P<0.05
组别 细胞侵袭细胞数空白对照组 236.47±18.21阴性对照组 225.35±17.58 siRNA PD-L1 组 112.43±12.641), 2)F 125.47 P 0.000
3 讨 论
3.1 PD-L1在结直肠癌中的表达情况
PD-L1是B7家族成员,是程序性死亡分子1的配体,在巨噬细胞、树突状细胞、B细胞和T细胞中广泛表达,PD-L1在上述细胞上的表达受到干扰素-γ的刺激后进一步升高[9-11];提呈抗原细胞表面的PD-L1分子和T细胞表面的程序性死亡分子-1结合发挥作用[9-10],在免疫耐受的诱导和维持方面具有重要作用[11-14];PD-L1在多种恶性肿瘤细胞中也有异常表达[15-16],和恶性肿瘤细胞的预后和恶性程度有关,和肿瘤浸润淋巴细胞关系密切,PD-L1和肿瘤浸润淋巴细胞表达的程序性死亡分子1结合,从而对肿瘤浸润淋巴细胞的功能产生抑制作用,导致肿瘤免疫逃逸[17-19]。沈吟芳等[20]研究发现肺癌组织中PD-L1表达显著升高,调节性T细胞浸润也明显升高,肺癌组织中PD-L1水平和调节性T细胞浸润为正相关关系,梁姣姣等[21]研究发现结肠癌调节性T细胞上的PD-L1表达升高,调节性T细胞和PD-L1的升高可能是促进结肠癌免疫逃逸得重要因素。本研究结果发现:PD-L1在结直肠癌、结直肠腺瘤、结直肠癌旁组织细胞胞浆和胞膜中有表达,在正常结直肠组织中无PD-L1表达。结直肠癌组织和结直肠腺瘤组织中PD-L1阳性表达率高于正常结直肠组织,结直肠癌组织中PD-L1阳性表达率高于结直肠腺瘤组织,但差异无统计学意义。结直肠腺瘤被认为是结直肠癌的癌前病变,结直肠癌的发生经过结直肠腺瘤期,考虑PD-L1阳性在结直肠癌的发生发展中发挥一定作用。
3.2 PD-L1对结直肠癌细胞生长的影响
本研究发现:siRNA PD-L1转染后可降低结直肠癌细胞中PD-L1的表达,转染后2 d对HCT116细胞中PD-L1的干扰效率最高;第3、7天,siRNA PD-L1组细胞OD值低于阴性对照组和空白对照组;siRNA PD-L1组细胞凋亡率高于阴性对照组和空白对照组;siRNA PD-L1组侵袭细胞数低于阴性对照组和空白对照组,表明下调HCT116细胞中的PD-L1水平,可以抑制HCT116细胞的增殖,促进结凋亡,抑制癌细胞的侵袭能力。在结直肠癌组织中,PD-L1呈高表达,PD-L1水平的升高可能通过促进结直肠癌细胞增殖,抑制结直肠癌细胞凋亡,增加结直肠癌细胞的侵袭能力发挥促进结直肠癌发生发展的作用。PD-L1在结直肠癌的发生发展中可能不只作为程序性死亡分子1的配体,还可能抑制受体传递信号的作用,对肿瘤浸润T细胞的杀伤功能产生抑制,增加肿瘤细胞的恶性程度。
综上所述,结直肠癌组织中PD-L1水平升高,下调结直肠癌细胞中PD-L1的表达水平可以对结直肠癌细胞的生理功能产生影响,使结直肠癌细胞的恶性程度降低。
[1] Li XX, Liang L, Huang LY, et al. Standard chemotherapy with cetuximab for treatment of colorectal cancer[J]. World J Gastroenterol,2015, 21(22):7022–7035. doi: 10.3748/wjg.v21.i22.7022.
[2] Kim JH. Chemotherapy for colorectal cancer in the elderly[J].World J Gastroenterol, 2015, 21(17):5158–5166. doi: 10.3748/wjg.v21.i17.5158.
[3] Maus MK, Hanna DL, Stephens CL, et al. Distinct gene expression profi les of proximal and distal colorectal cancer: implications for cytotoxic and targeted therapy[J]. Pharmacogenomics J, 2015,15(4):354–362. doi: 10.1038/tpj.2014.73.
[4] Gill S, Dowden S, Colwell B, et al. Navigating later lines of treatment for advanced colorectal cancer - optimizing targeted biological therapies to improve outcomes[J]. Cancer Treat Rev,2014, 40(10):1171–1181. doi: 10.1016/j.ctrv.2014.10.002.
[5] Chen J, Jiang CC, Jin L, et al. Regulation of PD-L1: a novel role of pro-survival signalling in cancer[J]. Ann Oncol, 2016, 27(3):409–416. doi: 10.1093/annonc/mdv615.
[6] Loi S, Dushyanthen S, Beavis PA, et al. RAS/MAPK Activation Is Associated with Reduced Tumor-Infi ltrating Lymphocytes in Triple-Negative Breast Cancer: Therapeutic Cooperation Between MEK and PD-1/PD-L1 Immune Checkpoint Inhibitors[J]. Clin Cancer Res, 2016,22(6):1499–1509. doi: 10.1158/1078–0432.CCR-15–1125.
[7] 王胜, 张诗民, 李珍珍, 等. 程序性死亡分子1/程序性死亡分子1配体信号通路在肺癌细胞株上的表达及其生物学意义[J].中华实验外科杂志, 2016, 33(8):1893–1896. doi:10.3760/cma.j.issn.1001–9030.2016.08.002.Wang S, Zhang SM, Li ZZ, et al. The expression and biological significance of programmed death ligand 1 on lung cancer cell lines[J]. Chinese Journal of Experimental Surgery, 2016,33(8):1893–1896. doi:10.3760/cma.j.issn.1001–9030.2016.08.002.
[8] Vu HL, Rosenbaum S, PurwinTJ, et al. RAC1 P29S regulates PDL1 expression in melanoma[J]. Pigment Cell Melanoma Res, 2015,28(5):590–598. doi: 10.1111/pcmr.12392.
[9] Torous VF, Rangachari D, Gallant BP, et al. PD-L1 testing using the clone 22C3 pharmDx kit for selection of patients with non-small cell lung cancer to receive immune checkpoint inhibitor therapy:are cytology cell blocks a viable option?[J]. J Am Soc Cytopathol,2018, 7(3):133–141. doi: 10.1016/j.jasc.2018.02.003.
[10] Scheel AH, Schäfer SC. Current PD-L1 immunohistochemistry for non-small cell lung cancer[J]. J Thorac Dis, 2018, 10(3):1217–1219.doi: 10.21037/jtd.2018.02.38.
[11] Yu XY, Zhang XW, Wang F, et al. Correlation and prognostic significance of PD-L1 and P53 expression in resected primary pulmonary lymphoepithelioma-like carcinoma[J]. J Thorac Dis,2018, 10(3):1891–1902. doi: 10.21037/jtd.2018.03.14.
[12] Chen BJ, Chapuy B, OuyangJ, et al. PD-L1 expression is characteristic of a subset of aggressive B-cell lymphomas and virusassociated malignancies [J]. Clin Cancer Res, 2013, 19(13):3462–3473. doi: 10.1158/1078–0432.CCR-13–0855.
[13] La X, Zhang F, Li Y, et al. Upregulation of PD-1 on CD4+CD25+T cells is associated with immunosuppression in liver of mice infected with Echinococcus multilocularis[J]. Int Immunopharmacol, 2015,26(2):357–366. doi: 10.1016/j.intimp.2015.04.013.
[14] Lu W, Lu L, Feng Y, et al. Infl ammation promotes oral squamous carcinoma immune evasion via induced programmed death ligand-1 surface expression[J]. Oncol Lett, 2013, 5(5):1519–1526. doi:10.3892/ol.2013.1238
[15] Dacic S. Time is up for PD-L1 testing standardization in lung cancer[J].Ann Oncol, 2018, 29(4):791–792. doi: 10.1093/annonc/mdy069.
[16] Xie WB, Liang LH, Wu KG, et al. MiR-140 Expression Regulates Cell Proliferation and Targets PD-L1 in NSCLC[J]. Cell Physiol Biochem, 2018, 46(2):654–663. doi: 10.1159/000488634.
[17] Yokoyama S, Miyoshi H, Nakashima K, et al. Prognostic Value of Programmed Death Ligand 1 and Programmed Death 1 Expression in Thymic Carcinoma[J]. Clin Cancer Res, 2016, 22(18):4727–4734. doi: 10.1158/1078–0432.CCR-16–0434.
[18] Concha-Benavente F, Srivastava RM, Trivedi S, et al. Identifi cation of the Cell-Intrinsic and -Extrinsic Pathways Downstream of EGFR and IFNγ That Induce PD-L1 Expression in Head and Neck Cancer[J].Cancer Res, 2016, 76(5):1031–1043. doi: 10.1158/0008–5472.CAN-15–2001.
[19] Bishop JL, Sio A, Angeles A, et al. PD-L1 is highly expressed in Enzalutamide resistant prostate cancer[J]. Oncotarget, 2015,6(1):234–242. doi: 10.18632/oncotarget.2703
[20] 沈吟芳, 穆传勇, 陈延斌, 等. 肺癌中PD-L1表达和调节性T细胞浸润的关系及意义[J]. 临床与实验病理学杂志, 2015, 31(4):418–421. doi:10.13315/j.cnki.cjcep.2015.04.014.Shen YF, Mu CY, Chen YB, et al. Relationship between PD-L1 expression and regulatory T cell infi ltration in lung cancer tis-sues and their clinical signifi cance[J]. Chinese Journal of Clinical and Experimental Pathology,2015, 31(4):418–421. doi:10.13315/j.cnki.cjcep.2015.04.014.
[21] 梁姣姣, 居颂文, 高志欣. PD-L1在结肠癌患者CD4+CD25hiCD127low/-调节性 T 细胞中的表达及其临床意义[J]. 重庆医学, 2015, 44(31):4324–4326. doi:10.3969/j.issn.1671–8348.2015.31.002.Liang JJ, Ju SW, Gao ZX. The clinical expression significance of PD-L1 on the CD4+CD25hi CD127low/- Treg cells in the peripheral blood of colon cancer[J]. Chongqing Medicine, 2015,44(31):4324–4326. doi:10.3969/j.issn.1671–8348.2015.31.002.

