禾叶慈姑的人工繁殖
, , , ,
(1.沈阳农业大学生物科学技术学院全球变化与生物入侵重点实验室, 辽宁 沈阳 110866;2.沈阳农业大学林学院, 辽宁 沈阳 110866)
禾叶慈姑为泽泻科慈姑属的多年生水生草本植物,原产地为北美,在我国属于外来物种[1-2]。该种植物自发现以来引起了研究者极大的兴趣,主要原因为其在我国表现出较大的特殊性: 1) 研究者仅在辽宁省丹东市发现了自然生长的野生群落,属于辽宁省特有的外来水生植物[3]; 2) 仅生长于鸭绿江入海口淡海水混水区域; 3) 随潮间带地区潮水的涨落每昼夜2次完全出水和浸水[4]; 4) 形成明显的单优板块,基本不与同地区其他植物混生等。禾叶慈姑在我国发现得较晚,又鉴于其诸多特性均适宜作为水生入侵植物研究的优良材料,近年来相关研究逐渐增多,研究者尝试从多方面阐明其入侵途径、种群扩散方式及入侵机理等[5-7]。本研究室着重探讨禾叶慈姑入侵对水环境中微型生物群落的影响及其与微型生物的互作关系,研究前期为获得充足的植物材料,对禾叶慈姑的越冬方法进行了摸索和优化,旨在为该植物的研究提供参考。
禾叶慈姑作为观赏性植物也极具价值,我国的武汉植物园早在多年前就进行了人工引种。本研究室还发现了该种植物在水体净化方面的特殊作用。对禾叶慈姑开展多方面的研究具有较大的理论和应用价值。
1 材料与方法
1.1 材 料
1.1.1实验材料
禾叶慈姑(Sagittariagraminea)隶属于被子植物门,单子叶植物纲,沼生目,泽泻科、慈姑属。供试禾叶慈姑于2016年6月采集自辽宁省丹东市鸭绿江入海口月亮岛大桥栈道下(采集地中心经纬度[1]:40°5′30″ N,124°21′10″ E),于沈阳农业大学生物科学技术学院实验室、日光大棚及室外专用水泥池中进行繁殖培养至今。
1.1.2实验试剂
KMnO4、HCl、NaOH、KOH、GA、Hoagland’s营养液、蒸馏水等。
1.1.3实验设施、仪器、玻璃器皿及消耗性物品
日光大棚、恒温培养室、光照培养箱、体式显微镜、冰箱、电子天平、微量取样器、眼科镊、培养皿、烧杯、滤纸、枪头等。
1.2 方 法
1.2.1禾叶慈姑种子繁殖方法
1) 禾叶慈姑种子的收集、保存及选种。
当年移植回实验基地的禾叶慈姑花期过后于秋季进入休眠前期,该时期种子逐渐成熟,颜色逐渐由绿转褐,当发生自然开裂时及时采收。采收后的保存方法有2种:①放入透气的布袋或信封中,4 ℃进行冷藏保存;②放入盛有清洁蒸馏水的无盖容器中,4 ℃进行冷藏保存,蒸馏水应及时补充避免蒸发干燥。
繁殖前将种子于低温中取出,逐级升温至室温(20 ℃左右),置于体式显微镜下进行选种。选取时应用眼科镊逐一翻转轻敲,仔细选取个大而饱满的种粒。
2) 禾叶慈姑种子打破休眠的方法。
本试验前期试用了物理法、生物激素法和化学药物法。物理法(去除种皮)、生物激素(GA处理)和化学法中的碳酸钠、盐酸和氢氧化钠处理均未取得较好的结果(萌发率≤ 4% )。化学药物法中的KOH组结果较好,采用应激处理法,进一步设置了梯度剂量和梯度时间(表1、表2),应用纸皿法进行促进萌发实验,每日观察并记录种子萌发情况,7 d统计发芽势,21 d统计发芽率,并计算发芽指数。计算公式如下[8]:
发芽率(%)=正常发芽种子数/供试种子总数×100%;
发芽势(%)=规定时间内正常发芽的种子数/供试种子总数×100%;
发芽指数(GI)=∑(Gt/Dt),式中:Gt为时间内的发芽数,Dt为相应的发芽天数。
表1KOH促进禾叶慈姑种子萌发的实验条件

编号组别种子数(个)试剂类别浓度(%)处理时间(h)平行组数(组)温度(℃)1对照组25蒸馏水——3262实验组25KOH5~301,2,4,6,8326
表2KOH浓度和处理时间分组及编号

B:KOH处理时间(h)A:KOH浓度(%)510152025301A1B1A2B1A3B1A4B1A5B1A6B12A1B2A2B2A3B2A4B2A5B2A6B24A1B3A2B3A3B3A4B3A5B3A6B36A1B4A2B4A3B4A4B4A5B4A6B48A1B5A2B5A3B5A4B5A5B5A6B5
1.2.2禾叶慈姑球茎繁殖的处理方法
禾叶慈姑种子成熟并采收后(沈阳市9—10月)由休眠前期进入休眠期,该时期地上部分枯萎,根系形成球茎,于该时期将植物根部的污泥洗去放入盛有蒸馏水的容器中水培,即可数出球茎的数量,确定数量后将根部重新种植回土中,如在室内或大棚中培养需4 d补充一次水分,水面距泥面5 cm;如在室外培养,结冰之后则不需要补水,第2年春季来临冰雪融化时应及时补充水分。本实验设置2组实验(室外和室内)。
1.2.3数据处理
采用SPSS 22.0、Excel 2010软件处理数据,采用单因素方差分析单重和多重比较的方法进行显著性分析。
2 结果与分析
2.1 KOH促进禾叶慈姑种子萌发的结果
应用1.2.1方法用不同浓度的KOH溶液处理禾叶慈姑种子,每日观察记录萌发情况,结果见表3,根据表3数据绘制图1。表3和图1的结果表明:种子萌发和KOH溶液的浓度和处理时间相关性较大,处理时间较短的3组(AB 1组、AB 2组和AB 3组)的3项指标均较低,最高仅达到10.67%(A 1 B 2组);处理时间较长的AB 4组随KON浓度升高3项指标均升高,最高萌发率达到65.33%(A 6 B 4组),处理时间最长的AB 5组3项指标普遍较高,最高萌发率出现于A 4 B 5组(65.33%)。A 5 B 1组、A 6 B 1组和A 6 B 2组种子萌发被抑制。萌发率极显著高于对照组的共7组(A 5 B 4组、A 6 B 4组、A 2 B 5组、A 3 B 5组、A 4 B 5组、A 5 B 5组和A 6 B 5组)。
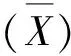
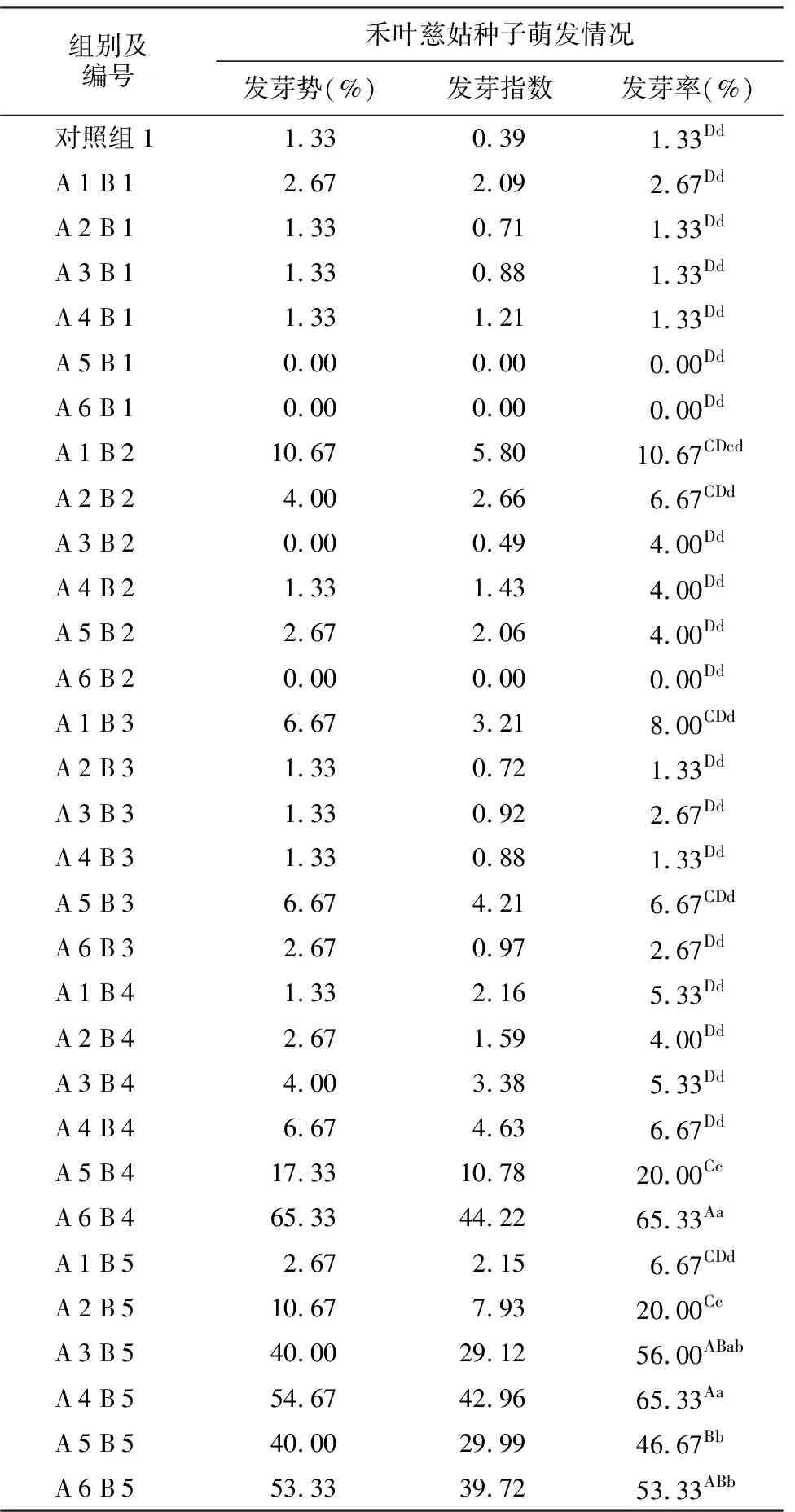
组别及编号禾叶慈姑种子萌发情况发芽势(%)发芽指数发芽率(%)对照组11.330.391.33DdA1B12.672.092.67DdA2B11.330.711.33DdA3B11.330.881.33DdA4B11.331.211.33DdA5B10.000.000.00DdA6B10.000.000.00DdA1B210.675.8010.67CDcdA2B24.002.666.67CDdA3B20.000.494.00DdA4B21.331.434.00DdA5B22.672.064.00DdA6B20.000.000.00DdA1B36.673.218.00CDdA2B31.330.721.33DdA3B31.330.922.67DdA4B31.330.881.33DdA5B36.674.216.67CDdA6B32.670.972.67DdA1B41.332.165.33DdA2B42.671.594.00DdA3B44.003.385.33DdA4B46.674.636.67DdA5B417.3310.7820.00CcA6B465.3344.2265.33AaA1B52.672.156.67CDdA2B510.677.9320.00CcA3B540.0029.1256.00ABabA4B554.6742.9665.33AaA5B540.0029.9946.67BbA6B553.3339.7253.33ABb
注:各组数据间,有一个相同字母的即为差异不显著,没有相同标记字母的即为差异显著(小写字母的差异为p<0.05,大写字母的差异为p<0.01)。
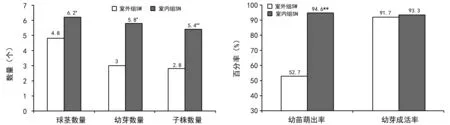
图2 不同条件下禾叶慈姑球茎繁殖的各项指标比较
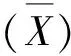
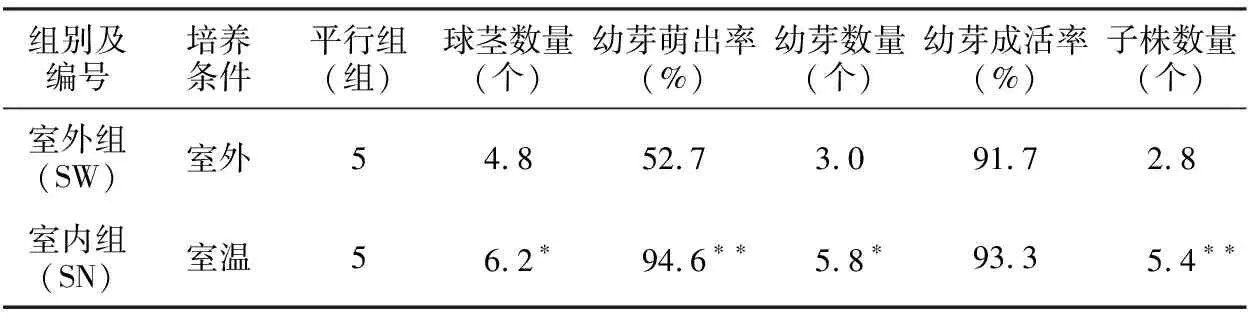
组别及编号培养条件平行组(组)球茎数量(个)幼芽萌出率(%)幼芽数量(个)幼芽成活率(%)子株数量(个)室外组(SW)室外 54.852.73.091.72.8室内组(SN)室温56.2∗94.6∗∗5.8∗93.35.4∗∗
注:球茎数量、幼芽数量和子株数量的计数方法为1株母株所增殖的数量。
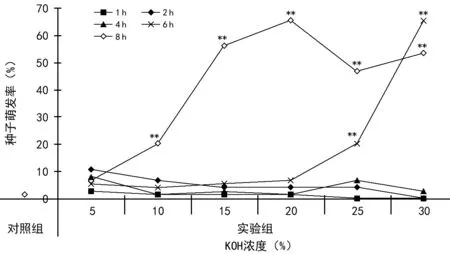
注:**为与对照组比较具有极显著差异(p<0.01)。图1 KOH处理后禾叶慈姑种子的萌发率
2.2 室内和室外条件下禾叶慈姑越冬球茎及幼芽萌发及生长状况
应用1.2.2方法于8月份观察和记录室内外禾叶慈姑球茎繁殖情况,结果见表4,根据表4结果绘制图2。结果表明:球茎及幼芽萌发的5项指标室外组(SW组)均低于室内组(SN组),其中差异不显著的为幼芽成活率(SW组为91.7%,SN组为93.3%);存在显著性差异的指标为球茎数量和幼芽数量,SW组分别为4.8个和3.0个,SN组分别为6.2个和5.8个;幼芽萌出率和子株数量存在极显著差异。
室温条件下球茎及幼苗的萌发均高于室外,球茎数量SW组为4.8个,SN组为6.2个;球茎的幼芽萌发率2组相差较大,SN组显著高于SW组(SW组为52.7%,SN组为94.6%)。
3 讨论与结论
种子繁殖和球茎繁殖是禾叶慈姑最主要的2种繁殖及越冬方式,如何在实验室获得较高的繁殖效率是进行后续试验的首要关键步骤,本研究针对这2种繁殖方式对其最适条件进行了摸索,得到了较为理想的繁殖条件。在进行种子繁殖试验时,预先选取了物理法(去除种皮)、生物激素(GA处理)和化学法中的碳酸钠[9]、盐酸和氢氧化钠等方法[10],这些方法均获得了不同程度的发芽率,但萌发率较低(最高萌发率≤10%),在需要植株较少的实验中也可以考虑使用。氢氧化钾处理获得了较好的萌发效果,这个结果与许多文献报道在多种植物萌发中取得的高萌发率相一致[11-13]。在氢氧化钾处理时,研究者并在处理方法上进行了最优筛选,从完全浸泡法改为了应激处理法,最终获得了较高的萌发效率和较好的幼芽成活率(另文报道)。表3和图1的结果表明:氢氧化钾溶液浓度和处理时间均与萌发效率关系较为密切,其中处理时间权重更大,这个趋势从8 h的处理结果上可以很好的显示出来;最适宜的处理时间区间应为8 h和6 h,其中8 h在设置的浓度梯度中获得了峰值(20%,萌发率65.33%),6 h处理中浓度与萌发率呈现线性关系(30%,65.33%),但由于氢氧化钾浓度过高,后期的幼芽成活率受到了一定的抑制(30%的幼芽成活率小于25%),因此在应用时不应选择过高的浓度;多数处理萌发效率较低(≤10),仅有6组与对照组相比较出现极显著性差异(p<0.01),所有的实验组中缺少具有显著性差异的处理(p<0.05),这种极端化的结果不利于后续试验及其他研究者选择萌发条件。
表4和图2结果表明:室内(SN组)自然条件下获得的各项指标均高于室外(SW组),仅幼芽成活率二者之间不存在显著性差异,其余4项指标均存在显著或极显著差异,室内和室外的光照条件较为相似(室内稍弱),因此造成该种结果的主要原因是温差,温差包括较长期的季节温差(球茎繁殖经历了北方秋、冬和春季)和短期的昼夜温差,较小的温差有利于球茎繁殖。
禾叶慈姑室内培养的成功从实验材料的获得方面具有较大意义,越冬时未经历室外冬季的冰冻状态,很大程度上解决了冬季实验材料的供给,这也是本研究的主要目的。

