黄芩素对多西他赛体外抗前列腺癌活性的影响
应 晓, 王育瑛, 王再红, 王振华
(1.衢州市中医医院检验科,浙江 衢州 324002;2.杭州市中医院检验科,浙江 杭州 310007)
在各类癌症中,前列腺癌是男性群体中发病率和死亡率都很高的恶性肿瘤,严重威胁男性健康[1]。对于早期的前列腺癌患者而言,手术和放疗是目前最有效的治疗方法,然而对于中晚期前列腺癌患者而言,化疗是必不可少的治疗手段[2]。多西他赛是用于前列腺癌治疗的一线化疗药物[3]。然而,由于肿瘤细胞的耐药性,有相当比例的前列腺癌患者对多西他赛治疗不敏感[4-5],因此寻找辅助治疗药物以降低前列腺癌细胞对多西他赛的抵抗性,提高其治疗效果,具有十分重要的意义。黄芩素是从天然药物黄芩根部提取的主要活性成分,具有抗过敏、抗菌、抗病毒的功效。近期有研究结果显示黄芩素有一定的肿瘤抑制作用,如黄芩素能通过抑制蛋白38(protein 38,p38)信号通路的活化抑制胃癌的侵袭转移,能靶向于前列腺癌细胞中的小窝蛋白-1/蛋白激酶B/雷帕霉素靶蛋白通路,抑制其生长和转移[6-7]。但黄芩素是否对前列腺癌的化疗有辅助治疗作用仍不清楚。有研究结果显示,将化疗药物与一些天然药物活性成分进行联合治疗能降低肿瘤细胞对化疗药物的抵抗性,有效提高化疗药物的疗效[8-9]。因此,本研究探讨了黄芩素对多西他赛体外抗前列腺癌活性的影响和机制。
1 材料和方法
1.1 试剂来源
多西他赛、噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、黄芩素、二甲亚砜和Annexin V-FITC凋亡检测试剂盒购自德国Sigma-Aldrich公司。Dulbecco改良Eagle培养基(Dulbecco's modified Eagle medium,DMEM)购自美国Gibco公司。细胞蛋白提取液、JC-1线粒体膜电位染料和线粒体分离试剂盒购自江苏碧云天生物科技有限公司。TRIzol试剂和逆转录试剂盒购自美国Invitrogen公司。鼠双微体2 (murine double minute 2,MDM2)、蛋白53(protein 53,p53)、受p53基因上调表达的凋亡调控基因(p53 upregulated modulator of apoptosis,Puma)、佛波醇-12-肉豆酸酯-13-乙酰基诱导蛋白1(phorbol-12-myriistate-13-acetate-induced protein 1,PMAIP1,又称Noxa)、半胱氨酸天冬氨酸特异性蛋白酶(cysteine-containing aspartatespecific protease,Caspase)-9、Caspase-3和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Cell Signaling公司。增强型化学发光底物(enhanced chemiluminescence,ECL)试剂盒购自美国Pierce公司。SYBR Green试剂盒购自大连TaKaRa公司。
1.2 细胞培养
人前列腺癌细胞系LNCaP购于美国模式培养物集存库(American Type Culture Collection,ATCC)。LNCaP细胞用含10%胎牛血清的DMEM在37 °C、5% CO2恒温培养箱中培养。
1.3 MDM2过表达质粒的构建和转染
人MDM2基因的开放阅读框架全长序列经聚合酶链反应(polymerase chain reaction,PCR)扩增后以分子克隆的方法与pcDNA3.1连接,构建成MDM2重组过表达质粒。MDM2过表达质粒采用脂质体2000进行转染,简要步骤如下:将2 μg/mL质粒用脂质体2000包裹后加入到无血清培养基中进行混合,将贴壁生长的LNCaP细胞置于该无血清培养基孵育6 h,弃去无血清培养基并加入新鲜的含10%胎牛血清的DMEM培养24 h。严格按试剂说明书进行操作。
1.4 方法
1.4.1 分组 将LNCaP细胞接种在96孔板(5×103/孔)上,按不同处理方式分为对照组、黄芩素组、多西他赛组、多西他赛+黄芩素组和多西他赛+黄芩素+MDM2质粒组。(1)对照组:空质粒转染的LNCaP细胞不加药物培养48 h;(2)多西他赛组:在空质粒转染的LNCaP细胞中加入1 nmol/L多西他赛培养48 h;(3)黄芩素组:在空质粒转染的LNCaP细胞中加入10 μmol/L黄芩素培养48 h;(4)多西他赛+黄芩素组:在空质粒转染的LNCaP细胞中加入1 nmol/L多西他赛和10 μmol/L黄芩素培养48 h;(5)多西他赛+黄芩素+MDM2质粒组:在MDM2质粒转染的LNCaP细胞中加入1 nmol/L多西他赛和10 μmol/L黄芩素培养48 h。
1.4.2 细胞活力检测 各组处理完毕后在各培养孔中加入20 μL 5 mg/mL MTT再培养4 h,小心吸去上清液,往培养孔中加入150 μL 二甲亚砜,充分震荡后在570 nm波长下用Sunrise Microplate Reader酶标仪 (瑞士TECAN公司)检测吸光度(A)值。LNCaP细胞活力抑制率计算公式:抑制率=(A值对照组-A值药物处理组)/A值对照组×100%。
1.4.3 细胞凋亡实验 将LNCaP细胞按2×106/孔接种在6孔板上,按上述分组处理完毕后将细胞用Annexin V染色孵育20 min,采用流式细胞术检测LNCaP细胞的凋亡,凋亡率用Annexin V阳性细胞数占总细胞数的百分比表示。严格按试剂盒说明书进行操作。
1.4.4 线粒体膜电位测定 将LNCaP细胞按2×106/孔接种在6孔板上,按上述分组处理完毕后将细胞用JC-1染料孵育20 min,孵育完毕后用流式细胞仪检测红色荧光,红色荧光强度越强,线粒体膜电位越高[10]。各处理组的相对线粒体膜电位由各处理组与对照组的红色荧光强度比值表示。严格按试剂盒说明书进行操作。
1.4.5 荧光定量PCR 将LNCaP细胞按2×106/孔接种在6孔板上,按上述分组进行处理。LNCaP细胞总RNA用Trizol试剂提取。cDNA采用逆转录试剂盒由总RNA合成。MDM2基因采用SYBR Green试剂盒进行定量PCR扩增,以GAPDH为内参,MDM2基因的相对表达量用2-△△CT法计算。严格按试剂盒说明书进行操作。
1.4.6 免疫印迹法 将LNCaP细胞按2×106/孔接种在6孔板上,按上述分组处理完毕后用蛋白提取液提取细胞总蛋白并用12.5%聚丙烯酰胺凝胶电泳进行分离。分离完毕后通过电转方法将蛋白质由分离胶转移到醋酸纤维素膜上,用MDM2、p53、Puma、Noxa、Caspase-9、Caspase-3、细胞色素c和GAPDH抗体孵育过夜,再用带辣根过氧化物酶的二抗孵育2 h,蛋白条带用ECL试剂盒显色发光。严格按试剂盒说明书进行操作。
1.4.7 线粒体分离 为了检测细胞色素c从线粒体释放到胞质中的水平,需除去LNCaP细胞的线粒体。将LNCaP细胞按2×106/孔接种在6孔板上,按上述分组处理完毕后用线粒体分离试剂盒将细胞的线粒体从胞质中分离。检测胞质中的细胞色素c蛋白水平,无线粒体的胞质中的细胞色素c蛋白水平越高,说明线粒体的细胞色素c的释放水平越高。严格按试剂盒说明书进行操作。
1.5 统计学方法
采用SPSS 16.0软件进行统计分析。所有实验均重复3次。呈正态分布的数据采用表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 黄芩素对多西他赛抗LNCaP细胞活性的影响
多西他赛+黄芩素组对LNCaP细胞活力的抑制率和LNCaP细胞凋亡率明显高于多西他赛+黄芩素+MDM2质粒组、多西他赛组、黄芩素组及对照组(P<0.05),多西他赛组、多西他赛+黄芩素+MDM2质粒组明显高于黄芩素组及对照组(P<0.05)。见表1、图1。
表1 各组LNCaP细胞的活力抑制率和凋亡率比较(%,±s )
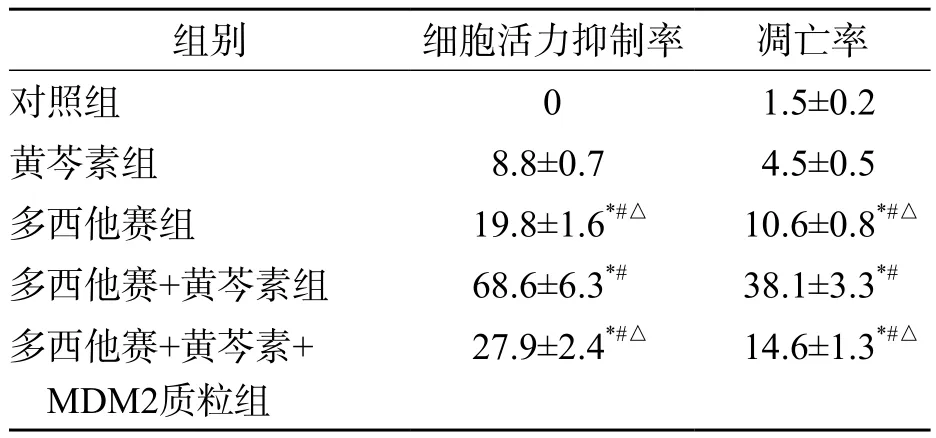
表1 各组LNCaP细胞的活力抑制率和凋亡率比较(%,±s )
注: 与对照组比较,*P<0.05;与黄芩素组比较,#P<0.05;与多西他赛+黄芩素组比较,△P<0.05
组别 细胞活力抑制率 凋亡率对照组 0 1.5±0.2黄芩素组 8.8±0.7 4.5±0.5多西他赛组 19.8±1.6*#△ 10.6±0.8*#△多西他赛+黄芩素组 68.6±6.3*# 38.1±3.3*#多西他赛+黄芩素+MDM2质粒组27.9±2.4*#△ 14.6±1.3*#△
2.2 黄芩素对LNCaP细胞表达MDM2的影响
黄芩素组和多西他赛+黄芩素组LNCaP细胞MDM2 mRNA和MDM2蛋白水平均低于多西他赛+黄芩素+MDM2质粒组、多西他赛组和对照组(P<0.05),而黄芩素组与多西他赛+黄芩素组之间、多西他赛组与对照组之间MDM2 mRNA和MDM2蛋白水平差异均无统计学意义(P>0.05)。见图2、图3。
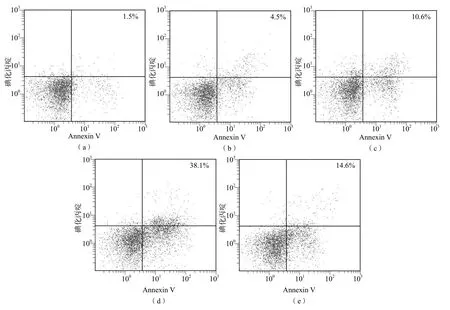
图1 各组LNCaP细胞的凋亡率比较
2.3 黄芩素对多西他赛诱导的凋亡信号的影响
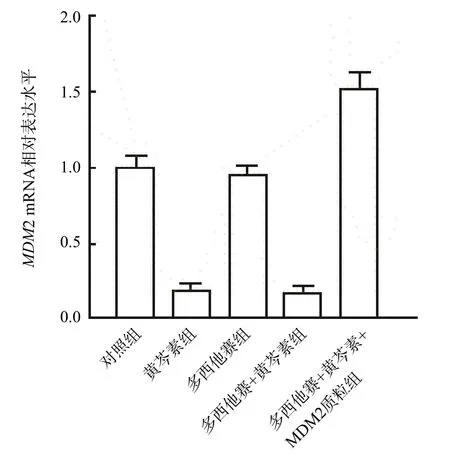
图2 黄芩素和多西他赛对LNCaP细胞MDM2 mRNA表达的影响
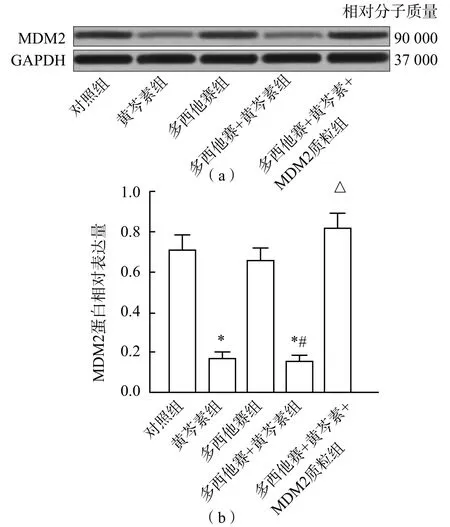
图3 黄芩素和多西他赛对LNCaP细胞MDM2蛋白表达的影响
多西他赛+黄芩素组p53蛋白水平、Puma蛋白水平、Noxa蛋白水平、细胞色素c释放水平及Caspase-9、Caspase-3活化水平均高于多西他赛+黄芩素+MDM2质粒组、多西他赛组、黄芩素组和对照组(P<0.05),而相对粒体膜电位则低于其他各组(P<0.05);多西他赛+黄芩素+MDM2质粒组、多西他赛组、黄芩素组和对照组之间各项指标差异均无统计学意义(P>0.05)。见图4~图6。
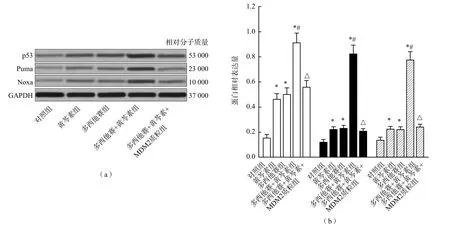
图4 黄芩素和多西他赛对p53依赖的凋亡相关蛋白表达的影响
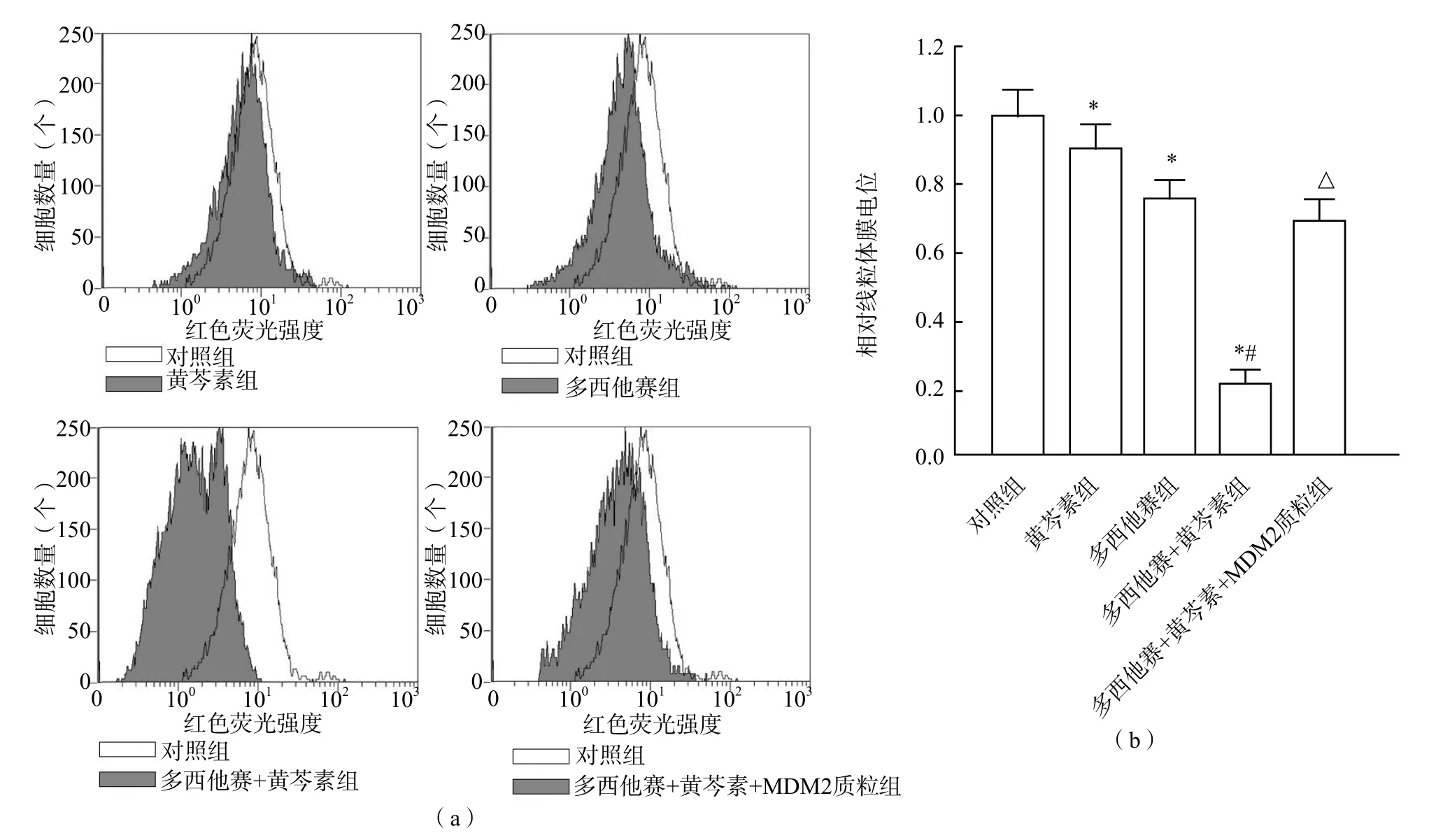
图5 多西他赛和黄芩素对LNCaP细胞线粒体膜电位的影响
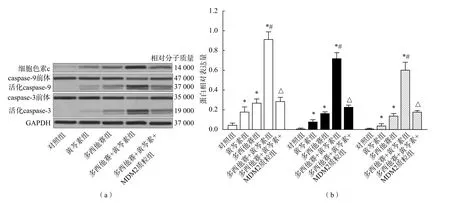
图6 黄芩素和多西他赛对LNCaP细胞Caspase-9、Caspase-3活化及细胞色素c释放的影响
3 讨论
多西他赛属于紫杉烷类化疗药物,能诱导前列腺癌、肺癌和乳腺癌等多种肿瘤细胞发生凋亡性死亡。在前列腺癌的治疗中,以多西他赛为代表的紫杉烷类化疗药物是目前治疗前列腺癌的一线治疗药物。这些药物能抑制肿瘤细胞骨架的合成,从而阻止其发生细胞分裂和增殖[11-13]。然而,在化疗过程中,常常会出现肿瘤细胞对多西他赛耐药。天然药物活性成分黄芩素具有一定的抗肿瘤活性,并且毒性较低,但黄芩素是否能提高前列腺癌细胞对多西他赛治疗的敏感性至今还不清楚。本研究预实验结果显示黄芩素单独治疗对LNCaP细胞的杀伤活性较弱,其半抑制浓度达到265 μmol/L,因此本研究尝试探讨低浓度黄芩素(10 μmol/L)对多西他赛化疗是否有协同效应。本研究结果显示黄芩素联合多西他赛处理能显著提高LNCaP细胞的活力抑制率和凋亡率,表明黄芩素是一种良好的化疗辅助治疗药物,能显著提高LNCaP细胞对多西他赛诱导的凋亡作用的敏感性。
野生型p53是一种重要的肿瘤抑制分子,能通过促进下游靶基因,如Puma和Noxa[14]的表达,诱导肿瘤细胞发生凋亡。然而,在多种肿瘤细胞中,p53基因会发生表达缺失或发生突变,使p53蛋白丧失对肿瘤的抑制作用。尽管如此,在多数前列腺癌细胞中,p53仍以野生型的形式存在并发挥抗肿瘤活性[15]。因此,在前列腺癌的治疗中,p53是一个潜在的重要靶点。在一般情况下,p53蛋白的稳定性和活性受MDM2蛋白的调控,细胞中的MDM2蛋白能与p53结合,从而抑制p53的生物活性并诱导其发生降解。因此,前列腺癌细胞中的p53蛋白水平会维持在一个较低水平。当前列腺癌细胞处于化疗药物作用下时,p53蛋白能从MDM2-p53复合物中游离出来,从而增加其稳定性和细胞内的水平[16-17]。由此可见,前列腺癌细胞中的p53蛋白水平受细胞中MDM2蛋白和化疗药物的调控。本研究结果显示,当LNCaP细胞单独用多西他赛处理时,细胞中的p53蛋白水平稍有升高;当用黄芩素和多西他赛联合处理时,LNCaP细胞中的p53蛋白水平明显升高。当LNCaP细胞转染MDM2质粒,使MDM2在LNCaP细胞中强制表达后,细胞中的p53蛋白水平明显下降,对LNCaP细胞活力的抑制率和LNCaP细胞凋亡率明显降低,表明黄芩素和多西他赛的协同抗前列腺癌活性受到了明显抑制。由此可见,黄芩素是通过抑制LNCaP细胞中MDM2的表达,间接增强了多西他赛对p53蛋白的活化,由此促进了多西他赛的抗前列腺癌活性。
Puma和Noxa是MDM2/p53信号通路的下游蛋白。本研究结果显示黄芩素与多西他赛联合处理能明显上调LNCaP细胞中Puma和Noxa蛋白的表达。同时,还发现黄芩素能明显促进多西他赛对LNCaP细胞线粒体途径凋亡的诱导,使细胞线粒体膜电位发生改变,促使线粒体发生肿胀,释放其中的凋亡活性物质细胞色素c,从而使凋亡执行蛋白Caspase-9和Caspase-3发生活化,最终导致细胞凋亡的发生。
综上所述,黄芩素能通过MDM2/p53途径提高多西他赛的体外抗前列腺癌活性,为增强多西他赛的化疗疗效提供了新的思路和理论依据。
[1] SIEGEL R L,MILLER K D,JEMAL A. Cancer statistics,2015[J]. CA Cancer J Clin,2015,65(1):5-29.
[2] KUMAR S S,PACEY S. The role of chemotherapy and new targeted agents in the management of primary prostate cancer[J]. J Clin Urol,2016,9(2 Suppl):30-37.
[3] GRAFF J N,BEER T M. Should docetaxel be administered earlier in prostate cancer therapy?[J].Expert Rev Anticancer Ther,2015,15(9):977-979.
[4] WANG Y,LIEBERMAN R,PAN J. miR-375 induces docetaxel resistance in prostate cancer by targeting SEC23A and YAP1[J]. Mol Cancer,2016,15(1):70.
[5] GANJU A,YALLAPU M M,JAGGI M,et al.Nanoways to overcome docetaxel resistance in prostate cancer[J]. Drug Resist Updat,2014,17(1-2):13-23.
[6] YAN X,RUI X,ZHANG K. Baicalein inhibits the invasion of gastric cancer cells by suppressing the activity of the p38 signaling pathway[J]. Oncol Rep,2015,33(2):737-743.
[7] GUO Z,HU X,XING Z,et al. Baicalein inhibits prostate cancer cell growth and metastasis via the caveolin-1/AKT/mTOR pathway[J]. Mol Cell Biochem,2015,406(1-2):111-119.
[8] 黄晔,廖阳,沈杨炳,等. 槲皮素通过抑制c-Jun的表达水平增强5-氟尿嘧啶对胃癌细胞凋亡的诱导活性[J]. 中国病理生理杂志,2018,34(2):206-211.
[9] 黄志平,邵立龙,阮阳平,等. 雷公藤红素通过ROS/JNK途径诱导Saos-2细胞发生caspase依赖的凋亡[J]. 中国病理生理杂志,2015,31(8):1457-1461.
[10] PRATHAPAN A,VINEETHA V P,RAGHU K G. Protective effect of Boerhaavia diffusa L. against mitochondrial dysfunction in angiotensin Ⅱ induced hypertrophy in H9c2 cardiomyoblast cells[J]. PLoS One,2014,9(4):e96220.
[11] ALSHAKER H,WANG Q,KAWANO Y,et al.Everolimus(RAD001) sensitizes prostate cancer cells to docetaxel by down-regulation of HIF-1α and sphingosine kinase 1[J]. Oncotarget,2016,7(49):80943-80956.
[12] TAO L,HUANG G,CHEN Y,et al. DNA methylation of DKK3 modulates docetaxel chemoresistance in human nonsmall cell lung cancer cell[J]. Cancer Biother Radiopharm,2015,30(2):100-106.
[13] ZHANG H D,SUN D W,MAO L,et al. MiR-139-5p inhibits the biological function of breast cancer cells by targeting Notch1 and mediates chemosensitivity to docetaxel[J]. Biochem Biophys Res Commun,2015,465(4):702-713.
[14] PARK S Y,JEONG M S,JANG S B.In vitrobinding properties of tumor suppressor p53 with PUMA and NOXA[J]. Biochem Biophys Res Commun,2012,420(2):350-356.
[15] FENG F Y,ZHANG Y,KOTHARI V,et al.MDM2 inhibition sensitizes prostate cancer cells to androgen ablation and radiotherapy in a p53-dependent manner[J]. Neoplasia,2016,18(4):213-222.
[16] DUFFY M J,SYNNOTT N C,MCGOWAN P M,et al. p53 as a target for the treatment of cancer[J].Cancer Treat Rev,2014,40(10):1153-1160.
[17] LIU C,ZHU Y,LOU W,et al. Functional p53 determines docetaxel sensitivity in prostate cancer cells[J]. Prostate,2013,73(4):418-427.

