简易微流控芯片技术在生理流动条件下体外动态分析阿司匹林和氯吡格雷对健康志愿者血小板黏附聚集的影响
陈 静,丁 玲,何 翠,陈 丹,邓素容,龚 放,李 远
1重庆医科大学附属永川医院中心实验室,重庆 402160 2重庆市血液中心永川分中心,重庆 402160
血小板作为外周血中一类重要无核血细胞参与了人体众多生理、病理及药理过程[1]。在生理性凝血过程中,受损血管处细胞外基质蛋白暴露在流动血液中,在高流动剪切力条件下,少量血小板通过血小板糖蛋白(glycoprotein,GP)Ⅰb-Ⅸ-Ⅴ和假性血友病因子(von Willebrand factor,VWF)相互作用黏附在细胞外基质蛋白表面,随后血小板被激活,通过自分泌二磷酸腺苷(adenosine diphosphate,ADP)和血栓烷素A2(thromboxane A2,TXA2)等凝血因子从血液中募集其他血小板,启动血小板聚集级联事件形成血小板聚集体,实现初步止血和防止血液损失[2];在病理条件下,血管壁表面血小板黏附聚集功能亢进导致血栓形成,增加心肌梗死和中风等疾病发病风险[3];临床上抗血小板药物常通过靶向血小板聚集的信号通路,进而抑制血小板黏附聚集效应,实现对血栓性疾病的远期预防和治疗[4]。因此,血小板黏附聚集功能评价对于血栓性疾病临床诊断及抗血小板药物药效评价具有重要意义。尽管临床上已开发出诸如光电比浊法[5]、全血电阻法[6]、PL-11®血小板分析仪[7]、PFA- 100®血小板功能仪[8]、Verifynow®[9]等体外血小板功能评价方法和系统,但上述测试系统均为在静止或与体内无关的剪切力条件下进行测试,与体内血小板发生黏附聚集所处的流动环境存在较大差异。同时,在体内生理相关流动条件下抗血小板药物对血小板黏附聚集行为影响的确切机制目前尚未十分清楚。
基于微加工技术制备的微流控芯具有样品试剂低消耗、易于集成、高通量高内涵分析等优点,目前已受到学术界和工业界的广泛关注[10]。此外,微流控芯片可提供与体内微血管尺寸和结构相似的微通道结构并具有精确调控的流体动力学行为,因此可作为理想的体外微血管模型,用于探索凝血、血小板等相关生理病理机制,如剪切力调控下的血小板聚集[11]和血小板—内皮细胞相互作用[12],但相关微流控芯片的结构、加工、流场分布及结果分析均相对复杂。为推广微流控芯片在血小板功能分析中的研究和临床应用,本课题组前期发展了一种在可控流体剪切力环境下分析血小板黏附聚集的简易微流控芯片技术[13]。在此基础上,本研究将进一步分析了生理流动条件下两类抗血小板药物—阿司匹林和氯吡格雷对健康志愿者血小板黏附聚集的影响,比较了不同生物学个体间对两类抗血小板药物的响应行为差异。
材料和方法
试剂和仪器鼠尾Ⅰ型胶原蛋白、乙酰水杨酸(acetylsalicylic acid, ASA)、5-磷酸-2-甲基硫代腺苷酸(2-methylthioadenosine 5’-monophosphate triethylammonium salt,2-MeSAMP)(美国Sigma Aldrich公司),Sylgard 184 聚二甲基硅氧烷(美国Dow Corning公司),Calcein AM荧光染料(美国Invitrogen公司),USP级DMSO(德国WAK-Chemie Medical GmbH公司),3.2%柠檬酸钠静脉血液真空采集管(山东威高集团有限公司),其他常规试剂(长江化工);RSP01-CS双向推拉型精密注射泵(嘉善瑞创电子科技有限公司),IX71倒置荧光显微镜(日本奥林巴斯公司),单色制冷相机(加拿大QICAM公司),Streampix 5.0视频录制软件(加拿大Norpix公司)。
血液样品采集和处理血液样品采集自重庆市血液中心永川分中心于2017年8月至9月间随机招募的12名健康成年志愿者(男女各6名),入选标准:志愿者1个月内无服药史、手术史和酗酒史,血细胞压积、血小板数量、凝血功能(APTT、PT)及血栓弹力图仪(R、K、Angle、MA、CI)指标检测均在正常参考值范围。本研究经重庆医科大学附属永川医院伦理委员会批准(批准号:20170318- 12),所有受试者均签署情同意书。采用真空采集静脉血液样品,全血样品以1∶9(v/v)3.2%柠檬酸钠抗凝,室温放置,2 h内使用。
ASA是阿司匹林体内代谢后的活性产物,血液中体外加入ASA能获得与口服阿司匹林相同的抗血小板功效[14]。2-MeSAMP是一种ADP P2Y12受体拮抗剂,体外加入血液中可模拟氯吡格雷的体内活性代谢产物功效[15]。为体外研究阿司匹林和氯吡格雷对血小板聚集的抑制作用,将每位志愿者抗凝血液均分为4份,其中3份为试验组:分别为ASA处理组、2-MeSAMP处理组、ASA和2-MeSAMP联合处理组,另一份为对照组。ASA处理组制备流程:用二甲基亚砜(DMSO)溶解ASA配成浓度为200 mmol/L的存储液,使用前用生理盐水按1∶1000(v/v)稀释ASA存储液配制成浓度为200 μmol/L的ASA工作液,按血液∶工作液9∶1(v/v)混合(即血液样品中ASA终浓度20 μmol/L)。2-MeSAMP处理组制备流程:用生理盐水溶解2-MeSAMP配置浓度为500 μmol/L的工作液,按血液∶工作液9∶1(v/v)混合(即血液样品中2-MeSAMP终浓度50 μmol/L)。ASA和2-MeSAMP联合处理组制备流程:按血液∶ASA工作液∶2-MeSAMP工作液8∶1∶1(v/v/v)混合(即血液样品中ASA终浓度20 μmol/L,2-MeSAMP终浓度50 μmol/L)。对照组按血液∶生理盐水9∶1(v/v)混合。最后,将浓度为1 mmol/L Calcein AM荧光染料按1∶500(v/v)加入到4组血液样品中,轻轻摇匀,37 ℃静止孵育30 min。其中,Calcein AM是一种活细胞荧光染料,能够穿透细胞膜进入细胞后被细胞内酯酶剪切形成Calcein发出强绿色荧光,可实现对血液样品中血小板进行荧光标记。

血小板黏附聚集动力学行为分析分析前,在微流控芯片微通道注入200 μg/mlⅠ型胶原蛋白溶液,室温(~25℃)静置孵育4 h,随后注入1% BSA溶液室温孵育1 h封闭活性位点。将荧光标记的血液样品加入样品池中,利用注射泵控制血液在微通道内以固定剪切率流动时,采用Streampix 5.0软件控制相机以1帧/5 s记录荧光标记血小板在胶原蛋白表面黏附聚集影像(物镜×20),记录5 min获得60张序列荧光图像。利用开源ImageJ软件(NIH)对采集的序列图像进行分析,计算出不同流动时间血小板聚集体表面覆盖率,获得血小板黏附聚集动力学曲线。其中,表面覆盖率量化基于图像分割和二值化处理的图像算法,即将图像中荧光强度高于设定阈值的像素设为1,低于设定阈值的像素设为0,血小板表面覆盖率定义为像素值为1的像素数量与图像所有像素数量之比,图像处理示意图如图1E所示。微流控芯片实验稳定性和可重复性验证结果如下:同一志愿者血液样品采集后室温分别放置0~5 h后在1000 s-1剪切率条件下血小板黏附聚集动力学曲线和流动300 s血小板覆盖率如图1F所示,结果显示放置时间≤4 h,流动300 s平均血小板覆盖率为(25.7±1.4)%,变异系数(variation coefficient,CV)值约为0.05;同一志愿者血液样品在相同微通道内前、中、后3个不同区域流动300 s血小板覆盖率CV值约为0.08,如图1G所示;同一志愿者分3次采集血液样品进行微流控芯片分析获得的流动300 s血小板覆盖率CV值约为0.14。

A.微流控芯片结构示意图;B.微流控芯片实物图,橘色染料指示微流控芯片的样品池、微通道和出口;C.分析系统操作原理示意图;D.分析系统实物图;E.血小板覆盖率的图像分析流程示意图;F.血液样品放置时间对血小板黏附聚集行为的影响;G.微通道不同区域的血小板表面覆盖率
A.structure diagram of chip;B.photograph of chip;the orange dye indicates the sample pool,microchannel,and outlet on the chip;C.operation principle diagram of microfluidic analysis system;D.photograph of microfluidic analysis system;E.image analysis flow diagram for calculating platelet coverage;F.effect of blood storage time on platelet adhesion and aggregation;G.platelet coverage rate calculated from three different regions in one microchannel
图1血小板黏附聚集行为微流控芯片分析系统
Fig1Microfluidic system for assaying platelet adhesion and aggregation
统计学处理采用SPSS 13.0统计软件,计量资料以均数±标准差表示,组间血小板聚集体覆盖率均值比较采用单因素重复测量设计资料方差分析,数据是否符合正态分布采用Shapiro-Wilk检验,因变量方差协方差矩阵是否相等采用Mauchly’s球型假设检验,采用post hoc test进行两两均数比较,以经Bonferroni法修正后的P<0.05表示差异有统计学意义。
结 果
抗血小板药物对血小板黏附聚集行为的影响在1000 s-1动脉生理性相关流体剪切率条件下,对照组血小板在胶原蛋白表面符合体内预期正常凝血过程,即在流动前期(≤100 s)血液中少量血小板黏附在胶原蛋白表面形成均匀分布血小板微聚集体,随着流动时间延长(100~300 s),在血小板初始黏附位点聚集更多血小板,血小板聚集体覆盖面积快速增加,且流动实验中血小板聚集体稳定黏附于胶原蛋白表面,未见脱落现象;ASA处理组和2-MeSAMP处理组血小板表现为与对照组相似的黏附聚集动态过程,但在流动后期(200~300 s),ASA处理组血小板聚集体荧光强度低于对照组,而2-MeSAMP处理组血小板聚集增长速率低于对照组;ASA和2-MeSAMP联合处理组血小板黏附聚集图像则与其余3组相比呈明显改变,即:流动中前期(≤150 s),血小板初始黏附数量少于其余3组,而在流动后期(200~300 s),血小板聚集体稳定性变差,开始从胶原蛋白表面脱落,血小板聚集体数量和覆盖面积降低(图2)。
抗血小板药物对血小板黏附聚集动力学曲线的影响在1000 s-1动脉生理性相关剪切率条件下,在流动中前期(≤200 s),4组的血小板黏附聚集动力学曲线无明显区别;在流动后期(200~300 s),ASA处理组和2-MeSAMP处理组血小板覆盖率增速均低于对照组,2-MeSAMP处理组低于ASA处理组,而ASA联合2-MeSAMP处理组血小板覆盖率则呈缓慢下降趋势。流动300 s时,对照组、ASA处理组、2-MeSAMP处理组和ASA联合2-MeSAMP处理组血小板覆盖率分别为(25.93±1.05)%、(21.26±1.71)%、(20.01±1.55)%和(10.0±1.27)%,差异有统计学意义[F=69.194(1.743,19.173),P<0.01];其中,ASA处理组与对照组差异无统计学意义(t=2.98,P=0.075),2-MeSAMP处理组血小板覆盖率较对照组降低5.917%(t=4.25,P=0.008),ASA联合2-MeSAMP处理组较对照组降低15.928%(t=12.665,P<0.01);2-MeSAMP处理组与ASA处理组差异无统计学意义(t=1.86,P=0.543),ASA联合2-MeSAMP处理组较ASA处理组显著降低(t=11.77,P<0.01);ASA联合2-MeSAMP处理组显著低于2-MeSAMP处理组(t=14.91,P<0.01)(图3)。
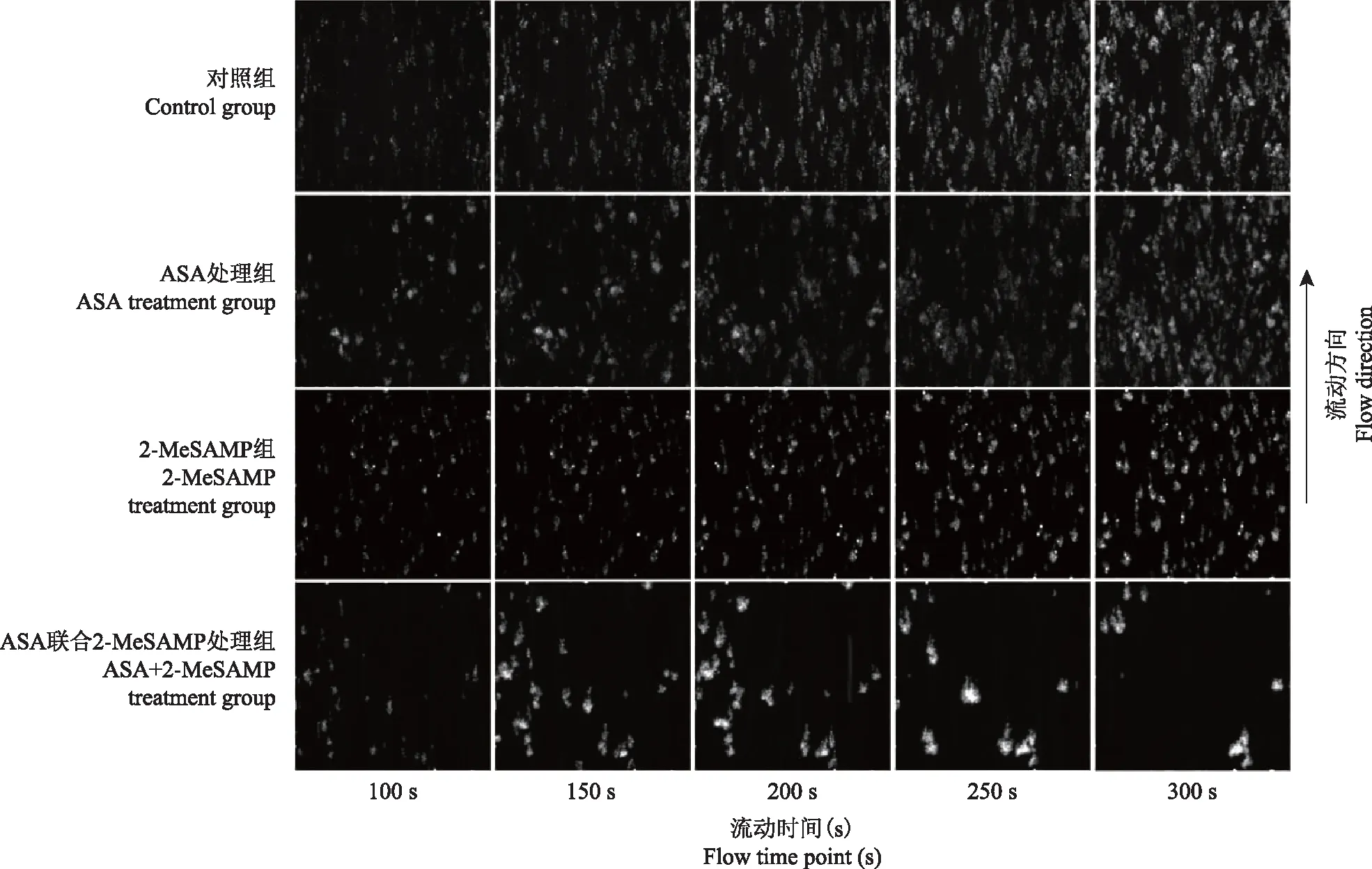
ASA:乙酰水杨酸;2-MeSAMP:5-磷酸-2-甲基硫代腺苷酸
ASA:acetylsalicylic acid;2-MeSAMP:2-methylthioadenosine 5’-monophosphate triethylammonium salt
图21000 s-1动脉生理相关剪切率条件下流动不同时间点血小板黏附聚集的典型荧光图像
Fig2Typical fluorescence images of platelet aggregation at different time points under the flow condition of 1000 s-1arterial physiological related shear rate
生物个体对抗血小板药物响应表型分析以1000 s-1剪切率流动300 s时血小板覆盖率为量化指标,结果显示:ASA处理后,12名志愿者中有8名血小板覆盖率降低,4名不变或增加(图4A);2-MeSAMP处理后,10名志愿者血小板覆盖率降低,2名增加(图4B);ASA联合2-MeSAMP处理后,12名志愿者血小板覆盖率均降低(图4C)。对ASA和2-MeSAMP有良好抑制响应的典型志愿者血小板黏附聚集动力学曲线如图4D所示,对ASA无抑制响应的典型志愿者血小板黏附聚集动力学曲线如图4E所示。
讨 论
大量临床及体外研究结果业已证实,血小板黏附聚集及血小板介导的血栓形成均依赖于流体剪切力[16]。随着微纳米加工技术的成熟,越来越多的研究显示,微流控芯片在体外研究血小板黏附聚集行为中具有独特优势[17- 19],包括:流体剪切力环境的精确控制、血液及血管壁相互作用的体内局部结构特征的精确模拟,与血小板聚集和血栓形成中相关联因素(血管内皮细胞、细胞外基质)的引入和控制、采用全血
进行分析、降低血液样品用量等。尽管如此,当前研究报道的微流控芯片结构、加工及分析流程相对复杂,一定程度上限制了微流控芯片技术在血小板功能分析中的临床推广和应用。为此,本研究采用本课题组前期发展并验证的一种在流体剪切力环境下分析血小板黏附聚集的简易微流控芯片技术[13],进一步观察了两类抗血小板药物对血小板黏附聚集动力学行为的影响,以增强对流动环境下抗血小板药物抑制血小板黏附聚集行为的了解,同时为下一步微流控芯片在血小板功能临床诊断及抗血小板药物药效评价的临床应用提供基础研究数据。基于上述研究目的,同时结合研究周期、成本、样品采集方便程度以及排除其他疾病对研究结果的影响,本研究选择了12名健康志愿者作为研究对象。
血小板是血栓性疾病发生发展中的关键因素之一,临床研究显示抗血小板药物阿司匹林和氯吡格雷能有效预防血栓事件发生率和降低血栓性疾病死亡率[20]。其中,阿司匹林通过不可逆抑制血小板环氧合酶- 1(cyclooxygenase- 1,COX- 1)活性,降低花生四烯酸(arachidonic acid,AA)向TXA2的转变达到抗血小板功效[14];氯吡格雷则通过其活性代谢产物封闭血小板二磷酸腺苷(adenosine diphosphate,ADP)受体P2Y12抑制血小板活化和聚集[20]。尽管阿司匹林和氯吡格雷抗血小板机制已十分清楚,但在体内流动条件下阿司匹林和氯吡格雷对抑制血小板黏附聚集行为的确切机制还未十分清楚。本研究采用微流控芯片在流动条件下分析血小板聚集体的显微荧光图像和血小板黏附聚集动力学曲线时发现,在1000 s-1动脉生理相关剪切率流动条件下,阿司匹林或氯吡格雷单独处理未能明显改变血小板中前期(≤200 s)血小板黏附聚集,但抑制血小板后期(200~300 s)黏附聚集,推测其原因在于流动条件下血小板初期黏附聚集主要由VWF调控,阿司匹林和氯吡格雷则分别通过AA-COX-TXA2和ADP-P2Y12途径抑制后期血小板聚集,该结果与血小板聚集体显微荧光图像结果相符,同时与预期理论相符。相反,在流动条件下,阿司匹林和氯吡格雷联合处理则通过降低血小板聚集体稳定性实现血小板黏附聚集抑制,推测其原因是由于TXA2和P2Y12综合抑制后改变了血小板GP Ⅱb-Ⅲa活性构型,从而降低血小板聚集体稳定性所致[21]。

aP<0.05
A.血小板黏附聚集动力学曲线(n=12);B.流动300 s血小板表面覆盖率统计箱图
A.kinetic curves of platelet adhesion and aggregation(n=12);B. statistical boxplot of platelet coverage rate flowed for 300 s
图3抗血小板药物对血小板黏附聚集行为的影响
Fig3Effects of antiplatelet drugs on platelet adhesion and aggregation behaviors

A.ASA处理降低血小板覆盖率的变化曲线;B.2-MeSAMP处理降低血小板覆盖率变化曲线;C. ASA联合2-MeSAMP处理降低血小板覆盖率变化曲线;D.对ASA和2-MeSAMP均正常响应的典型血小板黏附聚集动力学曲线;E.ASA抵抗的典型血小板黏附聚集动力学曲线
A.change curves of platelet coverage rate after ASA treatment;B.change curves of platelet coverage rate after 2-MeSAMP treatment;C.change curves of platelet coverage rate after ASA and 2-MeSAMP combination treatment;D.typical kinetic curves of platelet adhesion and aggregation for normal responder of ASA and 2-MeSAMP ;E. typical kinetic curves of platelet adhesion and aggregation for ASA resistance responder
图412名志愿者对抗血小板药物抑制血小板聚集效应的表型分析
Fig4Phenotypic analysis of platelet aggregation-inhibiting effect in 12 volunteers treated with antiplatelet drugs
为进一步比较不同抗血小板药物处理功效,本研究采用流动300 s血小板面积覆盖率作为血小板聚集速度和稳定性的综合量化指标。结果显示,相比对照组,ASA处理组降低血小板聚集体面积覆盖率无统计学意义,说明阿司匹林单独处理在降低血小板聚集体覆盖率方面药效不显著。其原因推测如下:(1)流动条件下通过阿司匹林特异性的AA-COX-TXA2途径调控血小板黏附聚集效应较弱;(2)流动条件下血小板残留的COX-2途径诱导血小板黏附聚集效应增强;(3)阿司匹林的COX- 1抑制效应可能依赖于流体剪切率;(4)考虑了血小板聚集体的二维覆盖面积,未考虑血小板聚集体三维体积参数。值得注意的是,ASA处理组血小板聚集体荧光强度低于对照组,提示阿司匹林可能通过降低血小板聚集体高度和/或体积来实现血小板黏附聚集抑制功效,该结果验证了Li等[14]报道的口服阿司匹林降低流动条件下沉积在胶原表面血小板聚集体的荧光强度的结果。此外本研究结果显示,2-MeSAMP处理组血小板面积覆盖率较对照组显著降低,但ASA组与2-MeSAMP处理组间无明显差异,推测其原因可能与氯吡格雷抑制P2Y12受体不依赖流体剪切率有关,同时该结果也提示以二维血小板覆盖率为量化指标,微流控芯片技术可检测出氯吡格雷对血小板抑制效应,但无法区别阿司匹林和氯吡格雷对血小板黏附聚集抑制功效强弱。本研究还发现,ASA联合2-MeSAMP处理能明显降低血小板聚集体稳定性,导致流动300 s时血小板面积覆盖率较对照组、ASA处理组和2-MeSAMP处理组均明显降低,提示阿司匹林和氯吡格雷在抑制血小板黏附聚集行为方面具有协同效应,该结果与大量临床研究报道的血小板双抗治疗在改善血栓疾病临床疗效方面阿司匹林或氯吡格雷/噻吩吡啶的单抗治疗的结果相符[22]。同时,本结果也与传统平板流动腔的体外实验结果相符[23- 24]。
生物学个体对抗血小板药物响应的异质性是个性化用药关注的焦点,研究显示,患者对抗血小板治疗的低响应性/抵抗和治疗后残留的高血小板活性与支架内血栓形成、心血管疾病死亡等不良事件紧密相关[25]。本研究对12名志愿者外周血体外经不同抗血小板药物处理,通过微流控芯片分析流动300 s血小板覆盖率变化曲线发现,不同志愿者对阿司匹林和氯吡格雷的响应存在差异,其中有4名健康志愿者个体存在阿司匹林非响应性(33.3%),2名健康志愿者个体存在氯吡格雷非响应性(16.7%),该结果与大规模系统评价给出的0.4%~65%的阿司匹林低响应性发生率和4%~30%的氯吡格雷低响应性发生率相符[19]。值得关注的是,12名志愿者对ASA和2-MeSAMP联合处理存在显著的血小板黏附聚集抑制功效,提示只有在COX- 1和P2Y12两条信号通道被综合抑制时才能显示出充分的血小板黏附聚集抑制表型。此外,本课题组发展的微流控芯片技术具有实时分析流动过程中血小板黏附聚集行为的优点,因此可获得不同抗血小板药物效应表型的动力学曲线,相比现有的终点法可获得更多抗血小板药物效应的相关信息。
综上,本研究采用一种简易微流控芯片技术,在1000 s-1动脉生理相关剪切率条件体外动态分析了两类常用抗血小板药物—阿司匹林和氯吡格雷对血小板黏附聚集行为的影响,结果显示,阿司匹林和氯吡格雷对血小板黏附聚集行为和动力学曲线的影响存在差异,阿司匹林和氯吡格雷联和处理对血小板黏附聚集行为抑制具有协同效应。同时,利用微流控芯片初步呈现不同生物学个体间对阿司匹林和氯吡格雷抑制血小板黏附聚集响应的差异性以及抗血小板药物处理时的抵抗现象。当前,以临床患者为研究对象,在更接近于临床应用环境对抗血小板药物功效的微流控芯片分析和多种方法学检测结果的比对正在进行中。本研究展示的血小板黏附聚集功能微流控芯片分析技术在进一步标准化后,可用于出/凝血功能临床诊断及抗血小板药物个性化用药分析。
[1] Gurney D. Platelet function testing:from routine to specialist testing[J]. Br J Biomed Sci,2016,73(1):10- 20. DOI:10.1080/09674845.2016.1156865.
[2] Lundblad RL,White GC. The interaction of thrombin with blood platelets[J]. Platelets,2005,16(7):373- 385. DOI:10.1080/09537100500123568.
[3] Levi M. Platelets in critical illness[J]. Semin Thromb Hemost,2016,42(3):252- 257. DOI:10.1055/s- 0035- 1570080.
[4] Metharom P,Berndt MC,Baker RI,et al. Current state and novel approaches of antiplatelet therapy[J]. Arterioscler Thromb Vasc Biol,2015,35(6):1327- 1338. DOI:10.1161/ATVBAHA.114.303413.
[5] Pedersen SB,Grove EL,Nielsen HL,et al. Evaluation of aspirin response by multiplate whole blood aggregometry and light transmission aggregometry[J]. Platelets,2009,20(6):415- 420. DOI:10.1080/09537100903100643.
[6] Park IJ,Ahn S,Kim YI,et al. Performance evaluation of Samsung LABGEO(HC10) Hematology Analyzer[J]. Arch Pathol Lab Med,2014,138(8):1077- 1082. DOI:10.5858/arpa.2013- 0439- OA.
[7] 张有涛,赵益明,季顺东,等. 血小板聚集功能的新检测方法和仪器的性能评价及临床应用[J]. 中国实验血液学杂志,2013,21(3):674- 677. DOI:10.7534/j.issn.1009- 2137.2013.03.027.
[8] Bartels A,Sarpong Y,Coberly J,et al. Failure of the platelet function assay(PFA)- 100 to detect antiplatelet agents [J]. Surgery,2015,158(4):1012- 1018. DOI:10.1016/j.surg.2015.07.011.
[9] Cui H,Lin S,Chen X,et al. Correlation between SNPs in candidate genes and verify now-detected platelet responsiveness to aspirin and clopidogrel treatment[J]. Cardiovasc Drugs Ther,2015,29(2):137- 146. DOI:10.1007/s10557- 015- 6585- 6.
[10] Garg S,Heuck G,Ip S,et al. Microfluidics:a transformational tool for nanomedicine development and production[J]. J Drug Target,2016,24(9):821- 835. DOI:10.1080/1061186X.2016.1198354.
[11] Nesbitt WS,Westein E,Tovar-Lopez FJ,et al. A shear gradient-dependent platelet aggregation mechanism drives thrombus formation[J]. Nat Med,2009,15(6):665- 673. DOI:10.1038/nm.1955.
[12] Zilberman-Rudenko J,Sylman JL,Garland KS,et al. Utility of microfluidic devices to study the platelet-endothelium interface[J]. Platelets,2017,28(5):449- 456. DOI:10.1080/09537104.2017.1280600.
[13] 黎洋,丁玲,邓素容,等. 在生理流动条件下分析血小板黏附聚集的简易微流控芯片技术[J]. 军事医学,2017,41(7):586- 593. DOI:10.7644/j.issn.1674- 9960.2017. 07.008.
[14] Li R,Fries S,Li X,et al. Microfluidic assay of platelet deposition on collagen by perfusion of whole blood from healthy individuals taking aspirin[J]. Clin Chem,2013,59(8):1195- 1204. DOI:10.1373/clinchem.2012.198101.
[15] Mendolicchio GL,Zavalloni D,Bacci M,et al. Variable effect of P2Y12 inhibition on platelet thrombus volume in flowing blood[J]. J Thromb Haemost,2011,9(2):373- 382. DOI:10.1111/j.1538- 7836.2010.04144.x.
[16] Bark DL Jr,Para AN,Ku DN. Correlation of thrombosis growth rate to pathological wall shear rate during platelet accumulation[J]. Biotechnol Bioeng,2012,109(10):2642- 2650. DOI:10.1002/bit.24537.
[17] Jain A,Graveline A,Waterhouse A,et al. A shear gradient-activated microfluidic device for automated monitoring of whole blood haemostasis and platelet function[J]. Nat Commun,2016,7(1):10176- 10186. DOI:10.1038/ncomms10176.
[18] Li M,Ku DN,Forest CR. Microfluidic system for simultaneous optical measurement of platelet aggregation at multiple shear rates in whole blood[J]. Lab Chip,2012,12(7):1355- 1362. DOI:10.1039/c2lc21145a.
[19] Li R,Diamond SL. Detection of platelet sensitivity to inhibitors of COX- 1,P2Y1,and P2Y12 using a whole blood microfluidic flow assay[J]. Thromb Res,2014,133(2):203- 210. DOI:10.1016/j.thromres.2013.10.043.
[20] Sambu N,Curzen N. Monitoring the effectiveness of antiplatelet therapy:opportunities and limitations[J]. Br J Clin Pharmacol,2011,72(4):683- 696. DOI:10.1111/j.1365- 2125.2011.03955.x.
[21] Goto S,Tamura N,Ishida H,et al. Dependence of platelet thrombus stability on sustained glycoprotein Ⅱb/Ⅲa activation through adenosine 5’-diphosphate receptor stimulation and cyclic calcium signaling[J]. J Am Coll Cardiol,2006,47(1):155- 162. DOI:10.1016/j.jacc.2005.08.055.
[22] Davis KA,Miyares MA,Dietrich E. Dual antiplatelet therapy with clopidogrel and aspirin after ischemic stroke:A review of the evidence[J]. Am J Health Syst Pharm,2015,72(19):1623- 1629. DOI:10.2146/ajhp140804.
[23] Stephens G,He M,Wong C,et al. Development of a perfusion chamber assay to study in real time the kinetics of thrombosis and the antithrombotic characteristics of antiplatelet drugs[J]. Thromb J,2012,10(1):11- 21. DOI:10.1186/ 1477- 9560- 10- 11.
[24] Lucitt MB,O’Brien S,Cowman J,et al. Assaying the efficacy of dual-antiplatelet therapy:use of a controlled-shear-rate microfluidic device with a well-defined collagen surface to track dynamic platelet adhesion[J]. Anal Bioanal Chem,2013,405(14):4823- 4834. DOI:10.1007/s00216- 013- 6897- y.
[25] Agayeva N,Topcuoglu MA,Arsava EM. The interplay between stroke severity,antiplatelet use,and aspirin resistance in ischemic stroke [J]. J Stroke Cerebrovasc Dis,2016,25(2):397- 403. DOI:10.1016/j.jstrokecerebrovasdis.2015.10.011.

