恙虫病严重程度与血清降钙素原水平的相关性
李久荣,刘 群,陈春成,马爱平
1厦门大学附属第一医院呼吸内科,福建厦门 361003 2厦门大学附属中山医院病理科,福建厦门 361004
恙虫病是由恙虫病东方体感染引起的自然疫源性疾病,主要分布在东亚、东南亚及澳大利亚北部地区[1- 2],我国主要分布于福建、云南、海南、广东、广西等地[3]。以鼠类为主要传染源,经恙螨幼虫叮咬而传人。其临床特征主要表现为发热、皮疹、焦痂或溃疡形成、淋巴结肿大及肝脾肿大,可引起多器官功能受损、衰竭,甚至死亡[4]。降钙素原(procalcitonin,PCT)是降钙素前体,是一种在临床上主要用于细菌感染监测的生物指标[5]。有研究显示,PCT与恙虫病的发生存在一定关联[6],但关于恙虫病严重程度与血清PCT水平之间的关系,目前鲜有报道。本研究回顾性分析了58例恙虫病患者的临床资料,探讨了恙虫病严重程度与血清PCT水平之间的关系。
资料和方法
资料来源2016年1月至2017年10月在厦门大学附属第一医院住院并具有完整临床资料的恙虫病患者58例,均经厦门市疾病预防控制中心确诊,收集患者的基本信息、生命体征、实验室检查(血常规、尿常规、肝肾功能、心肌酶谱、动脉血气分析)及辅助检查(胸片或胸部CT),其中,实验室检查和相关辅助检查均在患者入院后24 h内进行,抽血检查部分在30 min至2 h内完成。本研究经厦门大学附属第一医院伦理委员会批准,所有患者均豁免知情同意。
诊断标准参照中国疾病预防控制中心颁布的恙虫病诊断标准:流行季节、流行地区发病季节,草地等野外活动史,临床表现为发热、淋巴结肿大、皮疹、特征性焦痂或溃疡,血清外斐试验阳性或间接免疫荧光试验阳性,多西环素类药物治疗后24 h体温下降[7]。
血清PCT检测采用电化学发光法,使用罗氏Cobas6000自动分析仪及原装PCT试剂盒(货号:17750604),检测范围为0.02~100.00 ng/ml,PCT≥0.05 ng/ml为阳性。
血清恙虫病抗体检测清晨采患者外周静脉血3 ml,置于干燥促凝管,送厦门市疾病预防控制中心以胶体金法检测(伤寒、副伤寒及变形菌OX19,OX2、OXK诊断菌液,货号:20160801)。
恙虫病严重程度评估参照文献[8],将恙虫病病情分为4级:Ⅰ级:仅有发热症状;Ⅱ级:发热伴有1、2种临床征象;Ⅲ级:发热伴有3、4种临床征象;Ⅳ级:发热伴5种临床征象。其中,临床征象包括血小板降低、肝功能损害、蛋白尿、肺和循环功能损害等。
统计学处理采用SPSS 23.0统计软件,服从正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用q检验;不服从正态分布的计量资料以M(Q1,Q3)来表示,多组间的比较采用Kruskal-Wallis法秩和检验,两两比较使用Wilconxon秩和检验;相关性分析采用Spearman相关分析,P<0.05为差异有统计学意义。
结 果
一般情况58例患者中,男41例,女17例,平均年龄(45.5±16.8)岁(4~79岁)。58例患者均出现发热症状,其中,咳嗽5例,咳痰3例,胸闷3例,呼吸困难1例,头痛3例,腹泻2例,呕吐2例,浮肿1例,皮疹5例,焦痂22例,机械通气9例,死亡4例。
各级别恙虫病患者资料58例患者中,Ⅰ、Ⅱ级均为17例,Ⅲ级11例,Ⅳ级13例;有4例死亡,其中1例为Ⅲ级,3例为Ⅳ级;各级别组均为男性多于女性,各级别组患者在年龄(F=0.618,P=0.606)、出现症状至医院就诊时间(F=1.744,P=0.169)和住院天数(F=0.398,P=0.755)方面差异均无统计学意义(表1)。
PCT水平58例患者的PCT水平在0.03~100.00 ng/ml间,其中,男性中位PCT水平为0.59(0.20,1.36)ng/ml,女性中位PCT水平为0.33(0.24,0.96)ng/ml;Ⅳ级患者的中位PCT水平为2.60(1.33,61.08)ng/ml,明显高于Ⅰ级患者的0.24(0.10,0.33)ng/ml(Z=-4.63,P=0.000)、Ⅱ级患者的0.29(0.21,0.51)ng/ml(Z=-4.63,P=0.000)和Ⅲ级患者的1.33(0.89,2.41)ng/ml(Z=-2.09,P=0.040);Ⅲ级患者的PCT水平亦明显高于Ⅰ级患者(Z=-4.16,P=0.000)和Ⅱ级患者(Z=-3.83,P=0.000);I级和II级患者之间差异没有统计学意义(Z= -1.37,P=0.170)。Spearman相关分析结果显示,PCT水平与恙虫病严重程度呈显著正相关性(r=0.804,P=0.000)(图1)。
讨 论
我国自从1948年报道首例恙虫病以来,流行强度呈逐年增加的趋势[9- 10]。恙虫病是发热性疾病中一个很重要的组成部分,当患者缺乏典型的焦痂临床表现时,常被广大医务者忽视[11- 12]。恙虫病如果治疗不及时,往往会发生多器官功能衰竭,严重者甚至会死亡[13]。因此,对于恙虫病的诊治需要及时。目前临床上常用的实验室诊断方法有凝集法、胶体金法及间接免疫荧光检测恙虫病抗体,凝集法敏感度和特异度不高,而间接免疫荧光检测尽管敏感度及特异度较高,但对仪器及检验人员要求较高,受限条件较多,不易普及。胶体金法具有方便快捷、特异敏感、稳定性强、不需要特殊设备等优点,故而特别适合于广大基层检验人员以及大批量检测和大面积普查等,是我国恙虫病诊断的推荐方法。因此,对于发热患者,如果是在恙虫病流行季节、流行地区(如福建省为夏季),患者有草地等野外活动史,那么,即使患者没有典型的焦痂或溃疡,也应该考虑恙虫病的可能,及时抽取血液标本送检。由于恙虫病的基本病理改变是广泛的小血管炎,导致组织器官充血、水肿,细胞变性坏死,临床上表现为不同程度的器官功能损害、衰竭。本研究根据患者器官受累数量及程度,分为不同级别,其中较重患者中出现不同程度血小板下降,呼吸功能衰竭从而需要机械通气,这可能与小血管炎有关。因此,需要早期识别恙虫病患者严重程度,但目前临床上缺乏相关客观指标。有研究认为,PCT与恙虫病的发生存在一定的关联[6]。

PCT:降钙素原
PCT:procalcitonin
图1PCT水平与恙虫病严重程度相关性分析(r=0.804,P=0.000)
Fig1Correlation analysis between PCT level and the severity of scrub typhus (r=0.804,P=0.000)
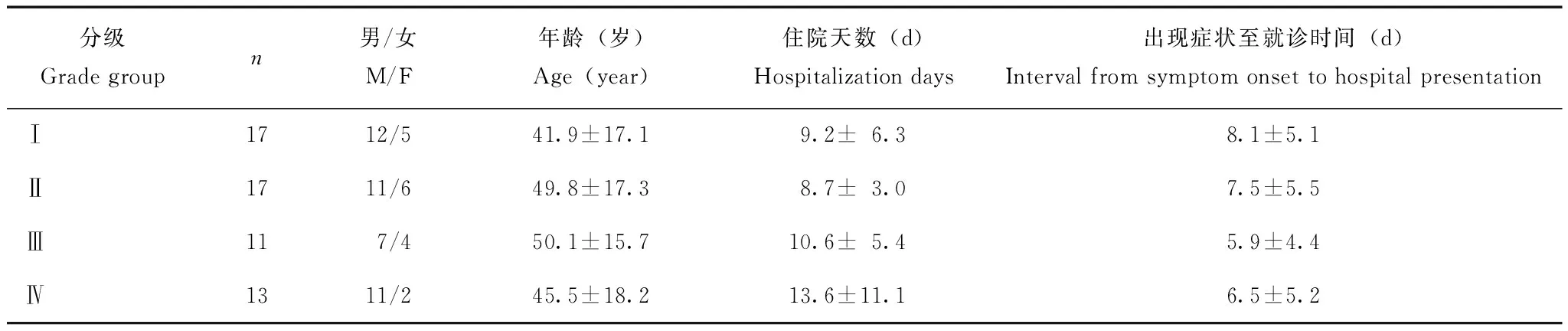
表 1 各级别恙虫病患者基本资料Table 1 Baseline characteristics of scrub typhus patients in different grade groups
PCT是降钙素的前体,是由116个氨基酸组成的糖蛋白,由甲状腺C细胞分泌产生。正常机体血浆中PCT含量极低,一般低于0.1 ng/ml[14]。细菌感染时,血清PCT在4 h后开始升高,8~24 h达到高峰[15]。本研究所有患者的PCT送检血液标本均在入院后30 min至2 h内完成,可最大程度降低因标本采集时间不同而导致患者PCT水平差异。恙虫病患者血清PCT亦可以升高。国内有学者报道48例恙虫病患者,所有患者血清PCT明显升高[16]。印度学者分析了86例恙虫病患者,其中PCT>2 ng/ml者59例[17]。
本组资料中,男性所占比例较高,推测可能与男性更喜欢野外活动有关。临床检查主要表现在血小板降低、转氨酶升高、肌酐升高、蛋白尿、心肌酶升高、肺部受累等。将恙虫病病情分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级4级后发现,分级越高,患者血清PCT水平越高,分级与PCT水平呈显著正相关,其中Ⅳ级患者较其他3级患者均明显升高,提示血清PCT水平与恙虫病患者的病情严重程度相关,血清PCT水平可作为评估恙虫病患者病情严重程度的潜在指标。印度一项研究报道,危重恙虫病患者死亡率达23.8%[17]。本研究Ⅳ级患者中,有3例患者死亡,死亡率达23.1%,与之类似。因此,对于PCT水平较高的患者,即使在没有出现严重并发症的情况下,也应该引起医务人员及患者家属的重视,从而最大程度降低死亡率。
本研究存在以下局限性:(1)回顾性研究,难免会产生信息偏倚。(2)研究对象人数有限,得出的结论可能不全面。今后尚需进一步研究来验证PCT在恙虫病病情评价中的作用。
[1] Koh GC,Maude RJ,Paris DH,et al.Diagnosis of scrub typhus[J]. A J Trop Med Hyg,2010,82(3):368- 370.DOI:10.4269/ajtmh.2010.09- 0233.
[2] Graves S,Stenos J.Rickettsioses in Australia[J].Ann N Y Acad Sci,2009,1166(1):151- 155. DOI:10.1111/j.1749- 6632.2009.04530.x.
[3] 李静,李晓燕,刘运喜.我国恙虫病流行病学及其传播媒介研究进展[J].实用预防医学,2005,12(5):1251- 1253. DOI:10.3969/j.issn.1006- 3110.2005.05.133.
[4] 李兰娟,任红.传染病学[M].8版.北京:人民卫生出版社,2013:140- 144.
[5] Uzzan B,Cohen R,Nicolas P,et al.Procalcitonin as a diagnostic test for sepsis in critically ill adults and after surgery or trauma:A systematic review and meta-analysis[J].Crit Care Med,2006,34(7):1996- 2003.DOI:10.1097/01.CCM.0000226 413. 54364.36.
[6] 黄志泳.血浆内降钙素原水平变化对诊断恙虫病的应用[J].中国医药指南,2013,11 (14):602- 603. DOI:10.3969/j.issn.1671- 8194.2013.14.470.
[7] 中国疾病预防控制中心.恙虫病预防控制技术指南(试行)[S/OL]. [2009- 01- 05]. https://www.chinacdc.cn/tzgg/200901/t20090105_40136.htm.
[8] Kim SJ,Chung IK,Chung IS,et al.The clinical significance of upper gastrointestinal endoscopy in gastrointestinal vasculitis related to scrub typhus[J].Endoscopy,2000,32(12):950- 955. DOI:10.1055/s- 2000- 9621.
[9] 张萌,王显军,赵仲堂.中国恙虫病流行态势及预防控制[J].中华流行病学杂志,2011,32(4):419- 423. DOI:10.3969/j.issn.1671- 8194.2013.14.470.
[10] 张鲁燕,毕振旺,赵仲堂.我国恙虫病东方体分子流行病学研究进展[J].中华流行病学杂志,2014,35(1):88- 92. DOI:10.3760/cma.j.issn.0254- 6450.2014.01.021.
[11] Mayxay M,Castonguay VJ,Chansamouth V,et al. Causes of non-malarial fever in Laos:a prospective study[J].Lancet Glob Heal,2013,1(3):e46- e54. DOI:10.1016/S2214- 109X(13)70008- 1.
[12] Paris DH,Shelite TR,Day NP,et al.Unresolved problems related to scrub typhus:a seriously neglected life-threatening disease[J].Am J Trop Med Hyg,2013,89(2):301- 307. DOI:10.4269/ajtmh.13- 0064.
[13] 郭恒彬,操敏.恙虫病并发多脏器损害的临床表现、误诊原因分析及对策[J].中国人兽共患病杂志,2005,21(7):628- 631. DOI:10.3969/j.issn.1002- 2694.2005.07.024.
[14] 徐静,陈伟庆.降钙素原在临床疾病诊治中的新进展[J].现代医药卫生,2016,32(1):77- 79. DOI:10.3969/j.issn.1009- 5519.2016.01.026.
[15] Kibe S,Adams K,Barlow G.Diagnostic and prognostic biomarks of sepsis in critical care[J].J Antimicrob Chemother,2011,66 (Suppl 2):ii33- ii40. DOI:10.1093/jac/dkq523.
[16] 薛聃,魏琼英,林琼.恙虫病患者血清降钙素原水平的变化及其临床意义[J].中华传染病杂志,2015,33(3):166- 167.DOI:10.3760/cma.j.issn.1000- 6680.2015.03.012.
[17] Peter JV,Karthik G,Ramakrishna K,et al.Elevated procalcitonin is associated with increased mortality in patients with scrub typhus infection needing intensive care admission[J].India J Care Med,2013,17(3):174- 177.DOI:10.4103/0972- 5229.117063.

