冷凝集血细胞假性减少的解决对策探讨
卢万辉 叶潇鸣
530000 广西南宁,南宁市第二人民医院五象分院检验科(叶潇鸣)
全自动血细胞分析仪分析计数血细胞时,冷凝集血液易导致一种或几种血细胞同时假性减少。为得到正确的血细胞分析结果,需排除冷凝集干扰,而患者不同,解决方法也可能不同。我们将最近2例冷凝集血液细胞假性减少的解决对策报告如下。
1 标本采集情况
1.1 病例1 患者女性,75岁,咳嗽8 d,于2018年4月18日入院治疗。入院时体温38.7 ℃,临床诊断为慢性支气管肺炎。16 ℃室温采集上午静脉血标本,约1 h后标本送达实验室,实验室室温为23 ℃。
1.2 病例2 患者女性,67岁,为每年例行体检者。主诉20多年来每逢天冷下地干活手脚会出现麻木,严重时甚至出现紫黑色,但经热水浸泡约0.5 h后会恢复正常。患者血标本采集后即置于冷链箱内保存,在检测前曾置于室温超过0.5 h。
2 冷凝集血标本在室温的特点
2.1 全自动血液细胞分析仪首次测得的红细胞计数(red blood cell count,RBC)结果显著偏低,与血红蛋白(hemoglobin,Hb)降低程度不成正比,且平均红细胞血红蛋白量(mean corpuscular hemoglobin,MCH)、平均红细胞血红蛋白浓度(mean corpuscular hemoglobin contentration,MCHC)明显升高,见图 1A、1C,图 2A、2C,表 1。
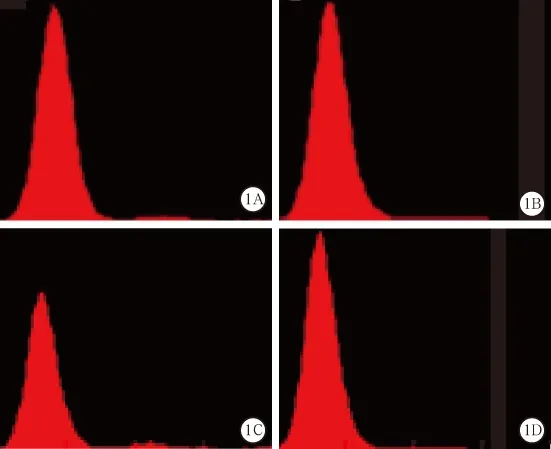
图1 2个病例血标本排除冷凝集干扰前后的RBC集散程度(图1A~B为病例1排除干扰前,图1C~D为病例2排除干扰后)
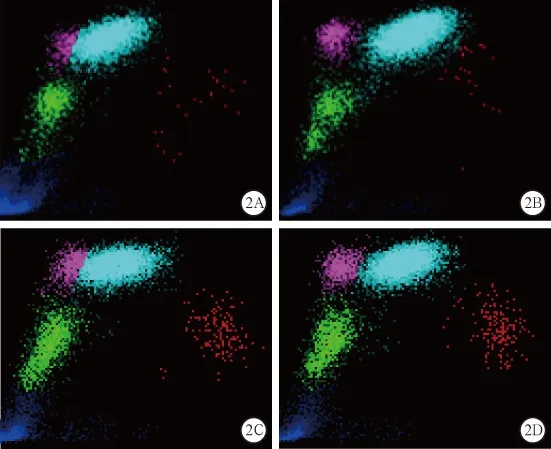
图2 2个病例血标本排除冷凝集干扰前后的WBC散点图(图2A~B为病例1排除干扰前,图2C~D为病例2排除干扰后)
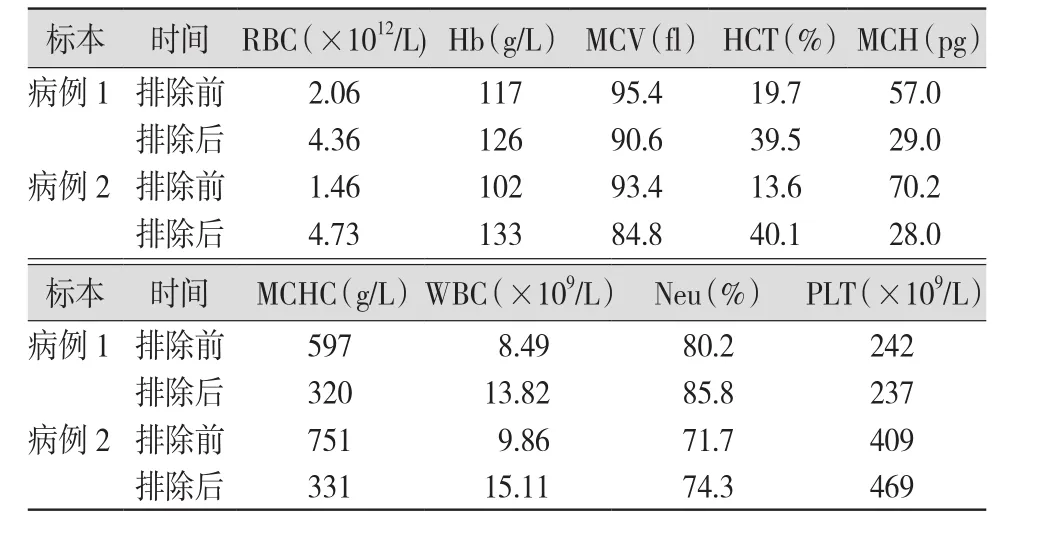
表1 2例血标本排除冷凝集干扰前后血细胞分析结果比较
2.2 血液试管倒转后,管壁上均附着有砂样血凝块颗粒,载玻片涂开血滴,血凝块清晰,见图3。但例1血标本的血凝块颗粒较例2血标本小。

图3 载玻片上(左)和血容器内壁(右)的冷凝集颗粒
2.3 血涂片吉姆萨染色镜检可见大量RBC凝集团块包绕白细胞(white blood cell,WBC)和血小板(blood platelet,PLT),同时也见散在 RBC、WBC 和PLT,见图4。2例血标本置于37 ℃水浴箱30 min后,试管倒转后管壁上未附着颗粒。
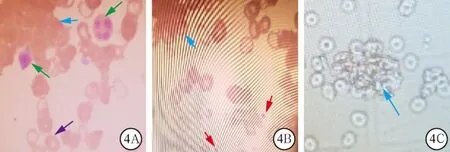
图4 2个病例冷凝集吉姆萨染色镜检结果(图4A~B);病例2改良Neubaure血细胞计数板RBC凝集(图4C)
3 检测方法及解决对策
3.1 检测方法 首先使用mry-5390全自动血细胞分析仪分析EDTA-K2抗凝静脉血的血细胞,RBC结果显著降低的标本经下述处理后,再采用细胞分析仪检测与传统手工检测相结合的方式进行复检。
3.2 温度纠正法 将EDTA-K2抗凝血置于37 ℃水浴箱中孵育约25 min,同时吸取新鲜生理盐水(normal saline,NS)1.99 mL备用。手持试管上端,使试管下端约1/3浸在水中,摇动试管约5 min,帮助RBC解聚。肉眼观察试管内无凝块后,立即用细胞分析仪检测血细胞,随后吸取10 μL血液注入1.99 mL备用NS中混匀,然后将细胞混悬液充入计数板的计数池内,观察计数池内有无RBC凝集。若无RBC凝集,则进行RBC计数,比较细胞分析仪检测细胞结果;若有RBC凝集,则表示此法检测结果不可信,应采用其他排除方法。例1血标本经上述方法处理后,再次使用细胞分析仪检测,其RBC数值与手工计数吻合,表示温度纠正法成功排除例1血标本的冷凝集干扰,细胞分析仪再次检测的结果准确(见图1B,2B)。而例2血标本的细胞混悬液在计数板的计数池内仍出现RBC凝集,RBC数值明显偏低,说明必须采用其他方法排除冷凝集素干扰(见图4C)。
3.3 置换血浆法 目的是降低血浆中冷凝集素的效价至1:32以下,使冷凝集素不与RBC发生凝集反应[1]。例2血标本置换血浆的操作过程: 取2支干净试管,其中1支加入1.99 mL NS,1支加入6 mL NS,后者与血标本同时置于37 ℃水浴箱中孵育30 min,吸取1 mL温浴NS沿血标本容器内壁注入,加塞试管盖后迅速颠倒5次,立即置于水平式离心机离心5 min(×450 g),离心后吸取血浆1 mL,再加入1 mL NS孵育离心,重复上述步骤,直至观察不到血凝块。最后一次吸取1 mL稀释血浆,混匀标本后上机检测;同时吸取10 μL血标本注入1.99 mL NS中稀释混匀,吸取细胞混悬液充入计数板的计数池内,观察RBC是否凝集。例2血标本连续置换血浆3次后,标本不再出现RBC凝集,上机测得RBC、WBC和PLT数值与手工计数一致,RBC与Hb、MCH、MCHC配比合理,所以按该数据作为最终报告。见图1D,2D。
4 讨论
血液冷凝集是由于血浆中冷凝集素过高而导致血液在体外低温条件下产生RBC自凝。其特点:① 血液离体后,25 ℃以下就会引起RBC凝集反应,摇动试管时可见血凝块出现,管壁附着斑块样凝集颗粒;② 冷凝集素在血浆中处于4 ℃时滴度最高,冷凝集最强,37 ℃以上时RBC凝集现象消失[2],所以RBC冷凝集是可塑的。这点与正常血液在体外生理性自然凝固的不可逆性(包括抗凝剂不足或抗凝剂与血液未充分混匀而产生血凝)有根本区别。
由于冷凝集血标本在体外常温下具有凝血倾向,血标本在离心过程中应保证温度在30 ℃以上,同时又要求血细胞完全下沉至管底,因此离心时间一般每次控制在5 min内为宜;同时为避免血细胞变形或被破坏,相对离心力也不宜过大,一般控制在450 g左右为宜。有研究显示,置换血浆法会导致溶血,其原因可能是相对离心力过大[3]。血标本离心前应先加入1 mL NS,以保证吸嘴在吸取血浆时与血细胞层保持足够的距离,避免血细胞被吸走;吸取稀释血浆时,吸嘴应保持在液面下3~5 mm,随液面缓慢下降,最后吸嘴距RBC层上缘应≥1 cm。有研究显示,置换血浆法会造成WBC和PLT假性偏低,可能是由于吸取血浆时,吸嘴尖深入细胞层吸走WBC和PLT所致[4]。根据以往排除多例冷凝集素干扰的血标本的效果分析,上述处理方法有效可靠。
冷凝集现象导致血细胞分析结果错误的病例并不少见,在以往相关研究中,许多研究仅将血标本置于 37 ℃水浴箱孵育后测定[2,5],结果的准确度不一定达到要求。有学者认为,部分特殊情况的冷凝集现象可以采取其他试验方法,以求更接近准确结果,无固定模式[1]。因此若例2的血标本经3次血浆置换后仍出现RBC聚集,则必须继续置换血浆或采取别的方法排除冷凝集素干扰。虽然全自动血液细胞分析仪分辨计数血细胞的技术已经很高,但在用其分析计数异常血液标本(如冷凝集血标本)时,还必须采用传统的显微镜镜检方法进行验证。
据文献报道,某些病例的冷凝集血液上机检测后,Hb、WBC和PLT可出现明显变化,因为RBC可将WBC或PLT凝集在一起,导致计算结果错误[6]。本研究采用吉氏染液染色镜检冷凝集血涂片,可见RBC大量凝集,WBC被包裹或散在分布,同时也可见PLT散在分布,与上述观点相符。冷凝集现象引起RBC聚集,在血型鉴定时很容易误判,也可引起交叉配血不合。因此,在采供血工作中应规范操作,用NS置换血浆,洗涤RBC 3次,配制成3%~5%RBC悬液,用于血型鉴定更稳妥[7]。
有学者认为,冷凝集素效价增高主要见于原发性冷凝集素综合征,也可见于非特异性炎症、间质性肺炎、自身免疫性疾病、多发性骨髓瘤、非霍奇金淋巴瘤、特发性或继发性淋巴组织系统恶性肿瘤、支气管肺炎及传染性单核细胞增多症等[1]。因基层卫生院检验科条件有限,未能开展冷凝集实验和免疫球蛋白等相关检查,对病例分析不足,实为缺憾。
1 张时民.一例严重冷凝集样本的血常规检验解决方案[J].实用检验医师杂志,2011,3(2):122-124.
2 孙宝旗,张庆.冷凝集素对2例血常规检测多项参数干扰分析[J].河北医药,2010,32(15):2109-2110.
3 朱名超.一例冷凝集患者引发的思考[EB/OL].http://www.360doc.com/content/18/0509/12/42726593_752416909.shtml
4 范红平,忽胜和.红细胞冷凝集对全血细胞计数影响分析[J].实验与检验医学 2015,33(6):737-739.
5 乐家新,马骏龙,徐菡,等.红细胞冷凝集对不同类型血细胞分析仪检测结果的影响探讨[J].医疗卫生装备,2009,30(2):69-71.
6 魏寿忠,李晓红,林列.冷凝集素引起血液分析仪测定结果异常及处理[J].中国医学检验杂志,2004,5(4):351-352.
7 刘成玉,林发全.临床检验基础(第3版)[M].中国医药科技出版社,2015.

