群体感应抑制活性深海细菌的分离与筛选
,,,, ,2
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江工业大学 长三角绿色制药协同创新中心,浙江 杭州 310014)
细菌感染一直威胁着人类的健康,十九世纪三四十年代,青霉素的发现及其在临床治疗中的使用,开启了抗生素治疗细菌感染的新时代.过去的几十年里,以青霉素为代表的抗生素治愈了许多细菌感染病例[1].然而,抗生素在治疗细菌感染时会直接杀死细菌,加重对病原菌的自然选择压力,从而加速抗生素耐药性或抗生素耐药性细菌的出现和蔓延,降低其临床价值[2-3].随着抗生素在临床上的大量使用,细菌耐药性问题越来越严重.新抗生素发现速度的放缓伴随着多重耐药菌株在世界范围内迅速增加,迫使人类急需开发新的、有效的抗菌策略[4].据报道[5],许多病原菌,比如铜绿假单胞菌(Pseudomonasaeruginosa)会通过群体感应系统调控毒力因子的表达和生物被膜的形成[6],使细菌能逃避抗生素、杀菌素或者宿主免疫系统的清除作用,在宿主体内分泌大量的毒素,并最终导致疾病的发生.群体感应(Quorum sensing, QS)是微生物的一种细胞密度依赖的信号传感系统.它可以通过其自身分泌的信号分子感知细胞密度的变化,一旦细胞密度达到阈值时,会启动其调控的基因表达调控微生物群体的行为,如生物发光、生物膜形成、群集运动、色素产生以及毒素产生等[7-8].破坏病原菌群体感应系统可以显著降低其毒力因子的表达水平,而不影响其生长繁殖,理论上不会导致耐药性的形成.因此,群体感应系统可以作为研究抗菌治疗的目标系统,阻断或干扰群体感应有望成为抗感染治疗的有效策略[5,9].
海洋独特的生存环境造就了海洋来源微生物遗传代谢的多样性[10],能够产生结构独特的活性次级代谢产物[11].Teasdale等[12]从海洋细菌Halobacillussalinus中分离到了2个苯乙酰胺类群体感应抑制剂(Quorum sensing inhibitors, QSIs),能够抑制群体感应系统控制的哈维氏菌(Vibrioharveyi)的生物发光现象和紫色杆菌(Chromobacteriumviolaceum)的群体感应系统.C.violaceum是一种革兰氏阴性菌,其紫色杆菌素的产生受群体感应系统的严密调控,可以作为群体感应抑制活性的筛选模型[13].C.violaceumATCC12472是一种野生型紫色杆菌,它可以自主产生信号分子调控紫色杆菌素的产生.而C.violaceumCV026是C.violaceumATCC31532的mini-Tn5的突变体,不能自主产生信号分子,因此不会产生紫色杆菌素,只有当添加外源信号分子时,才能启动其群体感应系统并产生紫色杆菌素[14].笔者以野生型C.violaceumATCC12472和突变型C.violaceumCV026建立的双菌株筛选模型,采用双层平板打孔法从东太平洋深海沉积物中分离具有群体感应抑制活性的深海细菌.
1 材料与方法
1.1 材 料
1.1.1 样品来源
研究所用深海沉积物样品由国家海洋局第二海洋研究所提供,采集于东太平洋海域深海海泥层.
1.1.2 菌 株
实验所用的报告菌株C.violaceumATCC12472以及C.violaceumCV026由美国罗德岛大学David C.Rowley教授馈赠.
1.1.3 培养基
1) 海水LB培养基:酵母提取物5 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂15~20 g/L(固体),海盐33.3 g/L,pH 7.4.
2) 淡水LB培养基:酵母提取物5 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂15~20 g/L(固体),pH 7.4.
1.2 方 法
1.2.1 深海细菌的分离
取深海沉积物5 g,在研钵中加适量无菌海水研磨成细,置于预先装有灭菌LB液体培养基的锥形瓶中,30 ℃,180 r/min振荡培养12 h,获得深海沉积物富集液.取1 mL富集液用无菌海水10 倍梯度稀释至10-9~10-1.分别取各稀释度的沉积物富集液100 μL涂布于LB平板上,30 ℃恒温培养箱中培养24 h,挑取生长形态不同的单菌落划线分离纯化,观察并排重.将分离得到的细菌分别进行命名和保藏.
1.2.2 深海细菌的发酵和粗提物制备
将上述分离纯化得到的细菌分别接种到含有100 mL海水LB液体培养基的250 mL锥形瓶中,30 ℃,180 r/min振荡培养3 d发酵至稳定期结束.发酵液8 000 r/min离心10 min,弃去菌体,取上清液加入等体积的乙酸乙酯,充分振荡萃取3次,取上层有机相用旋转蒸发仪浓缩至干,称重后以甲醇定溶至50 mg/mL,备用.
1.2.3 深海细菌乙酸乙酯提取物群体感应抑制活性的初筛
C.violaceumATCC12472过夜活化2次,将灭菌LB固体培养基(质量分数为1.5%的琼脂)冷却至40 ℃左右,加入10%活化后的C.violaceumATCC12472种子液,混匀后倒在新鲜LB平板(质量分数为2%的琼脂)上形成双层平板.待平板凝固后,于30 ℃恒温培养箱中培养1 h.将培养好的平板用打孔器打孔(打孔时只打到上、下层培养基的接触面),每个孔内分别加入0.2,0.4,0.6,0.8,1.0 mg上述各个菌株的乙酸乙酯粗提物,并由10 μL甲醇作为阴性对照,每个样品做3组平行样.30 ℃恒温培养箱中培养24 h,观察实验结果.重复筛选实验3次,排除偶然误差.若菌液具有群体感应抑制活性,则加样孔周围应有浑浊且不透明的色素抑制圈,直径越大则活性越强.而透明的环圈是抑菌圈,说明该粗提物样品会抑制报告菌株生长,不是群体感应抑制剂.测量其直径并记录.
1.2.4 C.violaceum CV026平板复筛
C.violaceumCV026过夜活化2次,将灭好菌的LB固体培养基(质量分数为1.5%的琼脂)冷却至40 ℃左右,加入10%活化后的C.violaceumCV026种子液以及终浓度为5 μmoL/L的信号分子N-hexanoyl-L-homoserinelactone(HHL)和质量浓度为20 mg/L的卡那霉素,混匀后倒在新鲜LB平板(质量分数为2%的琼脂)上形成双层平板.待平板凝固后,于30 ℃恒温培养箱中培养1 h.将培养好的平板用打孔器打孔(打孔时只打到上、下层培养基的接触面),每个孔内分别加入0.2,0.4,0.6,0.8,1.0 mg上述各个菌株的乙酸乙酯粗提物,并以10 μL甲醇作为阴性对照,每个样品做3 组平行样.30 ℃恒温培养箱中培养24 h,观察实验结果,测量其直径并记录.
2 结 果
2.1 深海细菌的分离及粗提物制备
从采集的深海沉积物样品中总共分离到海洋来源的细菌50株,部分菌株的平板形态如图1.50株细菌的发酵液经乙酸乙酯萃取,减压旋干,得到对应质量浓度为50 mg/mL的细菌发酵粗提物50份.

图1 部分分离到的深海细菌Fig.1 Part of deep-sea bacterial isolates
2.2深海细菌乙酸乙酯提取物群体感应抑制活性的初筛
对上述细菌发酵粗提取物进行C.violaceumATCC12472平板初筛,结果如表1所示.筛选的50株菌株中有9株具有不同程度的紫色杆菌素抑制作用,其中有8株抑制圈呈现浑浊、半透明状,1株抑制圈呈现透明状.因此,通过C.violaceumATCC12472初筛,初步筛选得到8株具有群体感应抑制活性的菌株.
表1深海细菌乙酸乙酯提取物群体感应抑制活性初筛结果
Table1Preliminaryscreeningresultsofethylacetateextractfromdeep-seabacteriaisolates

菌株群体感应抑制活性0.2 mg0.4 mg0.6 mg0.8 mg1.0 mgDC5-++++++++DS1252-Pan29-++++++++++DS1257-+++++++DS1265透明圈透明圈透明圈透明圈透明圈XC2298--++++XC22913++++++++++++XC22915--+++XC22918+++++XC22919+++++++++++
注:-为没有群体感应抑制活性;+为活性较弱;++为活性一般;+++为活性较好.
对出现紫色杆菌素半透明抑制圈的8株深海细菌进行重复实验,得到具有群体感应抑制活性及稳定性较好的3株细菌,分别为深海细菌分离株DS1252-Pan29,XC22913,XC22919.从图2,3可以看出:深海细菌XC22919群体感应抑制活性最好,XC22913和DS1252-Pan29的活性相当,3株活性菌株紫色杆菌素抑制圈的直径与加入粗提物的量均呈现较好的浓度依赖性.

0—20 μL甲醇;1—0.2 mg粗提物;2—0.4 mg粗提物;3—0.6 mg粗提物;4—0.8 mg粗提物;5—1.0 mg粗提物 图2 三株活性深海细菌提取物对C.violaceum ATCC12472紫色杆菌素产生的抑制 Fig.2 Inhibition effect on violacein production in C.violaceum ATCC12472 by ethyl acetate extract of three active deep-sea bacteria isolates
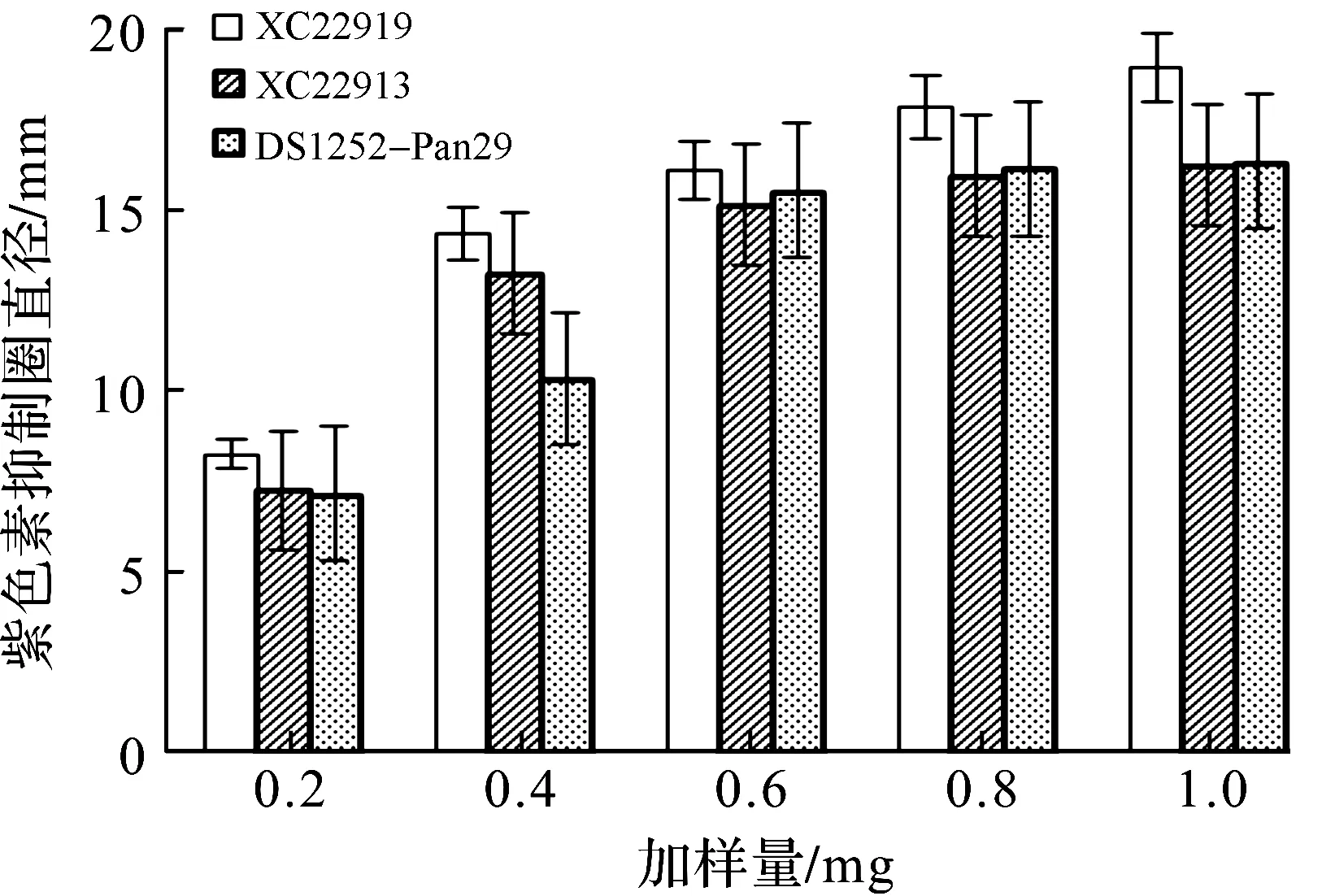
图3 三株活性深海细菌粗提物对C.violaceum ATCC12472产生的紫色菌素抑制圈直径Fig.3 Diameter of violacein inhibition zone by three active deep-sea bacteria isolates extract against C.violaceum ATCC12472
2.3 C.violaceum CV026平板复筛
选用能自主合成信号分子的紫色杆菌突变菌株C.violaceumCV026为报告菌株,加入外源信号分子HHL,诱导其群体感应系统产生紫色杆菌素,对3株初筛活性较好的深海细菌进行紫色杆菌素抑制的复筛,结果如图4,5所示.实验结果表明:初筛获得的3株深海细菌的乙酸乙酯提取物可以抑制C.violaceumCV026紫色杆菌素的生成,紫色杆菌素抑制圈的直径随着深海细菌粗提物加样量增加而增大,呈现明显的浓度依赖性.

0—20 μL甲醇;1—0.2 mg粗提物;2—0.4 mg粗提物;3—0.6 mg粗提物;4—0.8 mg粗提物;5—1.0 mg粗提物 图4 三株活性深海细菌提取物对C.violaceum CV026紫色杆菌素产生的抑制 Fig.4 Inhibition effect on violacein production in C.violaceum CV026 by ethyl acetate extract of three active deep-sea bacteria isolates
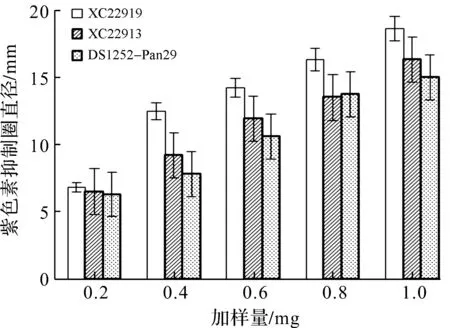
图5 三株活性深海细菌粗提物对C.violaceum CV026产生的紫色菌素抑制圈直径 Fig.5 Diameter of violacein inhibition zone by three active deep-sea bacteria isolates extract against C.violaceum CV026
3 结 论
本实验首先对来自东太平洋的深海沉积物样品采用10倍梯度稀释涂布法和划线法,分离纯化得到了50株海洋来源的细菌,接着利用野生型菌株C.violaceumATCC12472和突变型菌株C.violaceumCV026双菌株模型,经初筛和复筛得到了3株具有群体感应抑制活性的深海细菌.其中利用C.violaceumCV026对初筛得到的菌株进行复筛,既可以利用实验的重现性筛选出更加稳定的群体感应抑制活性菌株,又可以初步确定活性菌株并非是通过抑制报告菌株信号分子的合成或降解信号分子这两种方式来干扰或阻断群体感应通路.经分析,可能是因为活性菌株的次级代谢产物中产生了能和信号分子竞争性结合受体的群体感应抑制因子.因此,后续可以对这3株深海细菌进行更为深入的研究,从中寻找新颖、高效的小分子群体感应抑制剂,为以群体感应为靶点,通过结构修饰开发新型抗菌药物提供前体化合物.
参考文献:
[1] LING L L, SCHNEIDER T, PEOPLES A J, et al. A new antibiotic kills pathogens without detectable resistance[J].Nature,2015,520(7547):455-459.
[2] BUSETTI A, SHAW G, MEGAW J, et al. Marine-derived quorum-sensing inhibitory activities enhance the antibacterial efficacy of tobramycin againstPseudomonasaeruginosa[J].Marine drugs,2015,13(1):1-28.
[3] 隋洪楠.香草精油作为抗菌剂的应用[J].发酵科技通讯,2014,43(2):46-49.
[4] BOUCHER H W, TALBOT G H, BRADLEY J S, et al. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America[J].Clinical infectious diseases,2009,48(1):1-12.
[5] RUTHERFORD S T, BASSLER B L. Bacterial quorum sensing: its role in virulence and possibilities for its control[J].Cold spring harbor perspectives in medicine,2012,2(11):705-709.
[6] 陈小春,严银春,张甲生,等.太平洋杆菌对铜绿假单胞菌毒力因子的抑制作用[J].发酵科技通讯,2017,46(1):25-29.
[7] JIANG T Y, LI M Y. Quorum sensing inhibitors: a patent review[J].Expert opinion on therapeutic patents,2013,23(7):867-894.
[8] GALLOWAY W R, HODGKINSON J T, BOWDEN S, et al. Applications of small molecule activators and inhibitors of quorum sensing in gram-negative bacteria[J].Trends in microbiology,2012,20(9):449-458.
[9] GRAY B, HALL P, GRESHAM H. Targeting agr-and agr-like quorum sensing systems for development of common therapeutics to treat multiple gram-positive bacterial infections[J].Sensors,2013,13(4):5130-5166.
[10] 乔苗,王海栋.海洋微生物的活性研究进展[J].发酵科技通讯,2012,41(3):43-46.
[11] 杨凯琳,程文胜,侯峰,等.海洋微生物次级代谢产物及其抑菌活性研究进展[J].中国海洋药物,2013,32(3):71-81.
[12] TEASDALE M E, LIU J, WALLACE J, et al. Secondary metabolites produced by the marine bacteriumHalobacillussalinusthat inhibit quorum sensing-controlled phenotypes in gram-negative bacteria[J].Applied and environmental microbiol,2009,75(3):567-572.
[13] DANIEL M, GILLES G, URS S, et al. Effects of natural and chemically synthesized furanones on quorum sensing inChromobacteriumviolaceum[J].BMC microbiology,2004,4(1):1-10.
[14] MOROHOSHI T, KATO M, FUKAMACHI K, et al. N-acylhomoserine lactone regulates violacein production inChromobacteriumviolaceumtype strain ATCC 12472[J].Fems microbiology letters,2008,279(1):124-130.

