猪极体的排出与退化规律及其活性保存
徐小波, 章熙霞, 王公金, 谭小东, 周晓龙
(1.江苏省农业科学院畜牧研究所/农业部种养结合重点实验室,江苏 南京 210014; 2.南京市畜牧家禽研究所,江苏 南京 210036)
哺乳动物卵母细胞第一次减数分裂产生1个卵母细胞和第一极体(PbⅠ),第二次减数分裂产生1个卵母细胞和第二极体(PbⅡ),极体(Pb)排出后一般几小时至十几小时便退化,部分第一极体会继续分裂为2个小极体。之前,人们认为极体只是退化的没有生物学功能的染色质,很少有人对其进行研究,直到1995年,Evsikov等[1]发现小鼠极体可以参与受精卵发育,从而证明了极体中的染色质具有与卵母细胞中染色体一样的功能。随后,极体作为含有与卵母细胞相近遗传物质的特殊细胞,其生物学功能和利用价值得到人们的重新认识与重视。有学者利用PbⅡ和PbⅠ的遗传物质重组卵母细胞,得到能正常繁殖的小鼠后代[2-3]。人卵母细胞PbⅠ的排出与否及其形态与卵母细胞本身的质量和发育率有关,而与能否受精无关[4-5]。国内科学家对极体的研究起步较晚,大多是将极体作为一种生物信号或标记,而针对极体的生物学功能及如何保存与利用的研究报道很少。其中,兰宗宝等[6]发现猪卵母细胞是否排出PbⅠ直接影响胚胎早期发育,鲍时华等[7]发现通过小鼠卵母细胞PbⅠ的形态可预测受精卵质量。在人类医学临床实践中,极体的染色体已成功应用于人类的基因诊断,以降低遗传缺陷的发生率[8-9]。李澎涛等[10]发现,PbⅠ与人卵母细胞的受精和发育能力有关,可根据PbⅠ的形态来预知卵母细胞的发育情况。谷瑞环等[11]认为,根据受精后PbⅡ出现的比例可一定程度预知体外受精结果,并且发现早出现PbⅡ的卵母细胞质量或质核成熟同步化较好。刘芳等[12]也发现,人卵母细胞受精后3~5 h出现PbⅡ且 18~20 h形成2个原核的胚胎发育潜能较好。本研究拟对猪卵母细胞和受精卵在体外培养条件下PbⅠ和PbⅡ的排出与退化规律进行观察与判定,对其形态学以及不同保存条件下的活性进行鉴定与评价,以期为极体功能的深入研究提供优质材料。
1 材料与方法
1.1 猪卵巢和卵母细胞的采集
于生猪屠宰场挑选年龄在6月龄左右,体质量 95~110 kg的杜长大或杜大长育肥猪中的未阉割母猪,摘取生产线上刚屠宰开膛后温热胴体的猪卵巢,置于盛有生理盐水的 28~37 ℃保温瓶中。于2 h内,在无菌室用注射器抽吸直径 3~5 mm卵泡的卵泡液,在实体显微镜下,检出有3层以上颗粒细胞包围的卵丘卵母细胞复合体(COCs),转移至平衡2 h以上的TCM-199液滴中,清洗 2~3次,进行体外成熟培养(5% CO2的空气,饱和湿度,39 ℃, 24~72 h)。
1.2 极体的排出与采集
不同时间段取体外成熟培养的COCs,将卵母细胞周围的颗粒细胞除去,每隔4 h观察一次PbⅠ 的排出情况。精卵共孵育在改进型Tris缓冲液(mTBM)中进行,完成后转入北卡莱罗纳州立大学-23培养基中,每隔4 h观察一次PbⅡ的排出情况。PbⅠ和PbⅡ的采集均采用显微操作法:选择含有 1~2级PbⅠ和PbⅡ的卵母细胞或受精卵,以显微操作仪固定针固定卵母细胞或受精卵,用内径 20~25 μm的拔尖去核针刺入透明带,伸入卵周隙,吸取PbⅠ和PbⅡ。
1.3 极体的形态学分级和活性鉴定
PbⅠ和PbⅡ的形态学评估标准参照Ebner等[13]的方法进行,根据外形、胞质均匀度、膜表面平滑度和完整度分为5个等级。
PbⅠ和PbⅡ的活性鉴定参照刘文华等[14]的方法进行,即通过台盼蓝染色的方法进行鉴定,有活性的胞质不染色,无活性的呈蓝色。
1.4 极体的体外保存
本试验主要探讨39 ℃、4 ℃、-20 ℃、-196 ℃ 4种温度条件下Pb的保存情况。
1.4.1 常温及低温保存 根据形态分级选取含 1~2级PbⅠ的卵母细胞和含 1~3级PbⅡ的受精卵,放入预平衡的组织培养液-199(TCM-199)微滴培养系统中,分别在4 ℃及39 ℃下保存,在设定时间取部分卵母细胞或受精卵对Pb进行活性鉴定。
1.4.2 冷冻和超低温冷冻保存 将含有PbⅠ的卵母细胞和含有PbⅡ的受精卵装入含乙二醇40(EG40)冷冻保护液的微管中(直径 200~300 μm),置于-20 ℃冰箱中冷藏或直接投入液氮(-196 ℃)中冷冻保存。在设定时间取样,解冻并对Pb进行活性鉴定。
1.5 数据分析
卵丘扩散率、极体排出率、保存成活率及形态学差异等数据采用SPSS16.0进行统计,采用多重比较检验数据的差异性。
2 结果与分析
2.1 极体的排出时间
2.1.1 PbⅠ 表1显示,体外成熟培养过程中卵丘细胞呈现不同程度的扩散,培养 32~36 h开始排出PbⅠ,培养40 h时卵丘细胞扩散率(86.8%)最高,PbⅠ排出率(66.7%)也达到最高。培养 40~52 h,卵丘细胞慢慢脱落,扩散率有所降低。
2.1.2 PbⅡ 2批610枚(第一批310枚,第二批300枚)受精卵培养观察结果(表2)显示,卵母细胞受精后4 h就有少量的PbⅡ排出,16 h排出量迅速增加,20 h的排出率(49.5%)最高,24 h部分PbⅡ出现退化或消失,排出率开始下降。

表1 不同培养时间PbⅠ排出率
同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
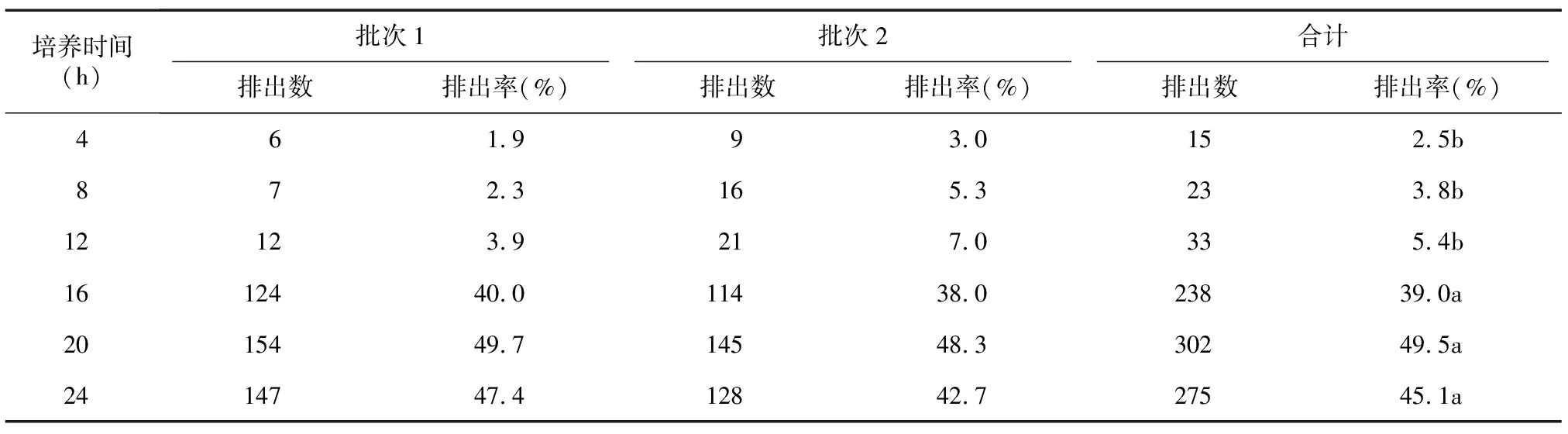
表2 受精后不同培养时间PbⅡ排出率
同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
2.2 不同排出时间极体的形态与活性
2.2.1 Pb Ⅰ 表3显示,卵母细胞体外培养32 h至36 h开始有Pb Ⅰ排出,并发现开始排出的Pb Ⅰ中1~2级的比例(37.5%)不是很高。培养40~44 h排出的Pb Ⅰ较多,其中培养40 h的1~2级的比例高达51.7%,3级的比例30.7%,4~5级的比例只有17.6%。培养44~52 h,1~2级Pb Ⅰ的比例下降,而4~5级的比例升高,到52 h时1~2级Pb Ⅰ只有14.8%。形态分级与活性鉴定结果表明,1~2级Pb Ⅰ大多具有生物活性, 3级Pb Ⅰ的活性相对较差,4~5级Pb Ⅰ基本没有活性。
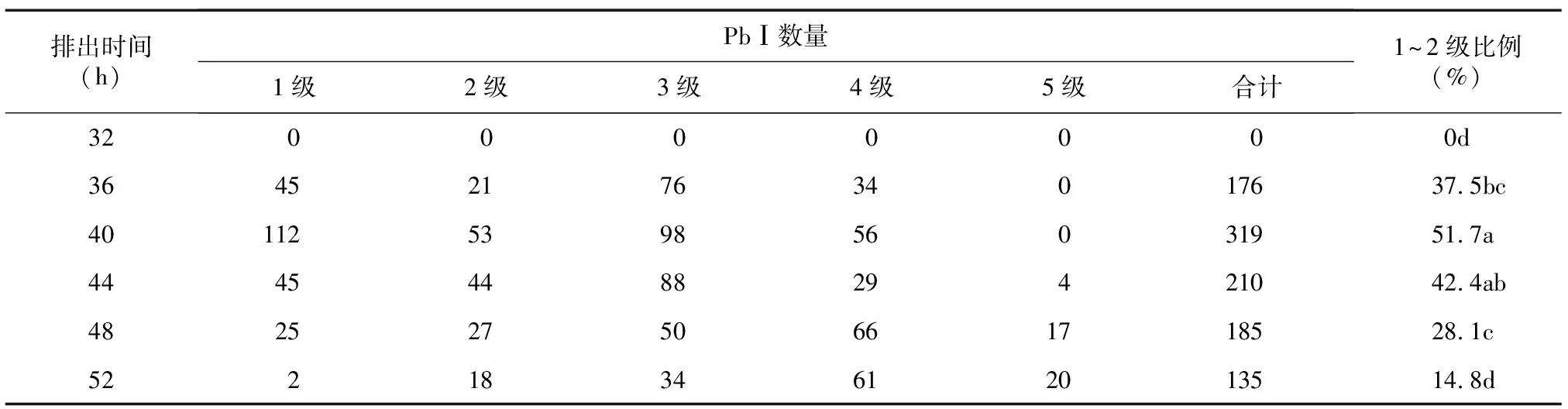
表3 不同排出时间PbⅠ形态分级
同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
2.2.2 PbⅡ 表4显示,受精后4~20 h排出的PbⅡ中1~2级所占比例均高于50%,受精后24 h 1~2级PbⅡ所占比例明显下降。其中受精后16 h和20 h排出的PbⅡ1~2级的比例分别保持在50.4%和58.9%,结合前述受精后不同时间PbⅡ的排出率结果(受精后20 h排出率最高,49.5%), 确定受精后20 h左右是猪PbⅡ最佳的采集时间。活性鉴定结果表明,PbⅡ在形态与活性的相关性方面与PbⅠ一致。
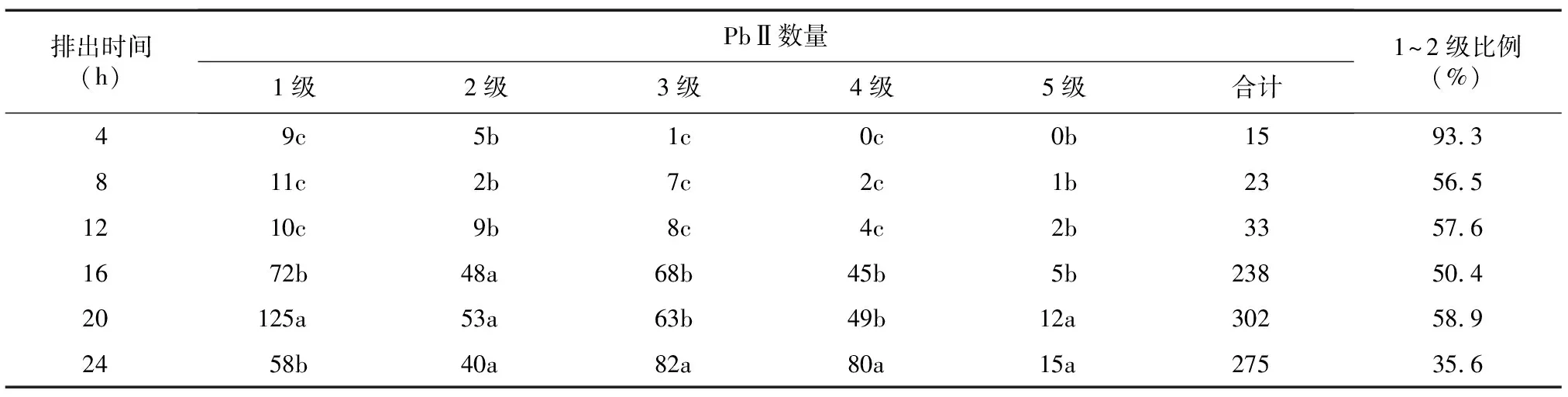
表4 受精后不同排出时间PbⅡ的形态分级
同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
2.3 不同保存温度对极体形态与活性的影响
2.3.1 PbⅠ 表5显示,39 ℃下保存2 h,PbⅠ的形态正常且存活率较高,保存4 h时形态尚正常,但存活率显著下降,保存6 h形态不正常,并且存活率只有18.2%。4 ℃条件保存 20~40 h,PbⅠ仍然保持良好的形态与较高的存活率,但保存60 h时,PbⅠ开始崩解或消失(形态正常率30.5%),完全丧失活性(存活率为0)。-20 ℃冷冻保存168 h,PbⅠ形态正常率为98.3%,存活率为95.0%。-196 ℃超低温冷冻保存1 344 h,PbⅠ形态正常率(97.8%)和存活率(89.1%)均保持在较高水平。

表5 不同保存温度下PbⅠ的形态与活性
同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
2.3.2 PbⅡ 表6显示,受精卵中的PbⅡ在39 ℃下保存12 h仍有75.9%的存活率,保存16 h存活率显著下降,为34.5%。4 ℃下保存30 h,PbⅡ的存活率为87.5%,保存60 h时,存活率仅有8.3%,形态正常率为25.0%。-20 ℃冷冻保存240 h,PbⅡ的存活率为84.6%,保存360 h时,PbⅡ的存活率为69.2%,保存480 h时,PbⅡ的存活率为23.1%。-196 ℃超低温冷冻保存1 344 h后,PbⅡ的形态正常率和存活率分别为95.7%和87.0%。
3 讨 论
不同哺乳动物极体的排出时间有很大差异。小鼠注射人绒毛膜促性腺激素后12 h得到的PbⅠ数量最多[14],与公鼠交配后24 h,PbⅡ排出率最高,达到79.7%[15]。在体外成熟培养过程中,牛卵母细胞PbⅠ的排出高峰出现在16 h,排出率为37.0%,培养24 h时排出率达74.5%[16]。孙青原等[17]发现,牛受精后5 h时PbⅡ被排出。用乙醇对体外成熟培养 26~30 h的延边黄牛卵母细胞进行预激活(5~7 min),培养 2~3 h后第二极体大量排出[18]。华再东等[19]发现,猪COCs培养时间不足38 h时,虽能看到极体,但激活后卵裂率极低,说明卵母细胞并未真正成熟。本研究中,猪卵母细胞体外培养36 h时出现PbⅠ,40 h排出率达66.7%。受精后4 h就有少量的受精卵排出PbⅡ,受精后16 h PbⅡ排出率显著增加,20 h时达到最高。另外,本研究发现,猪PbⅠ和PbⅡ的排出时间不同,这可能与屠宰场所取卵巢周期不同以及采卵所选卵泡成熟度不一致造成卵母细胞发育不同步有关,有待进一步研究。
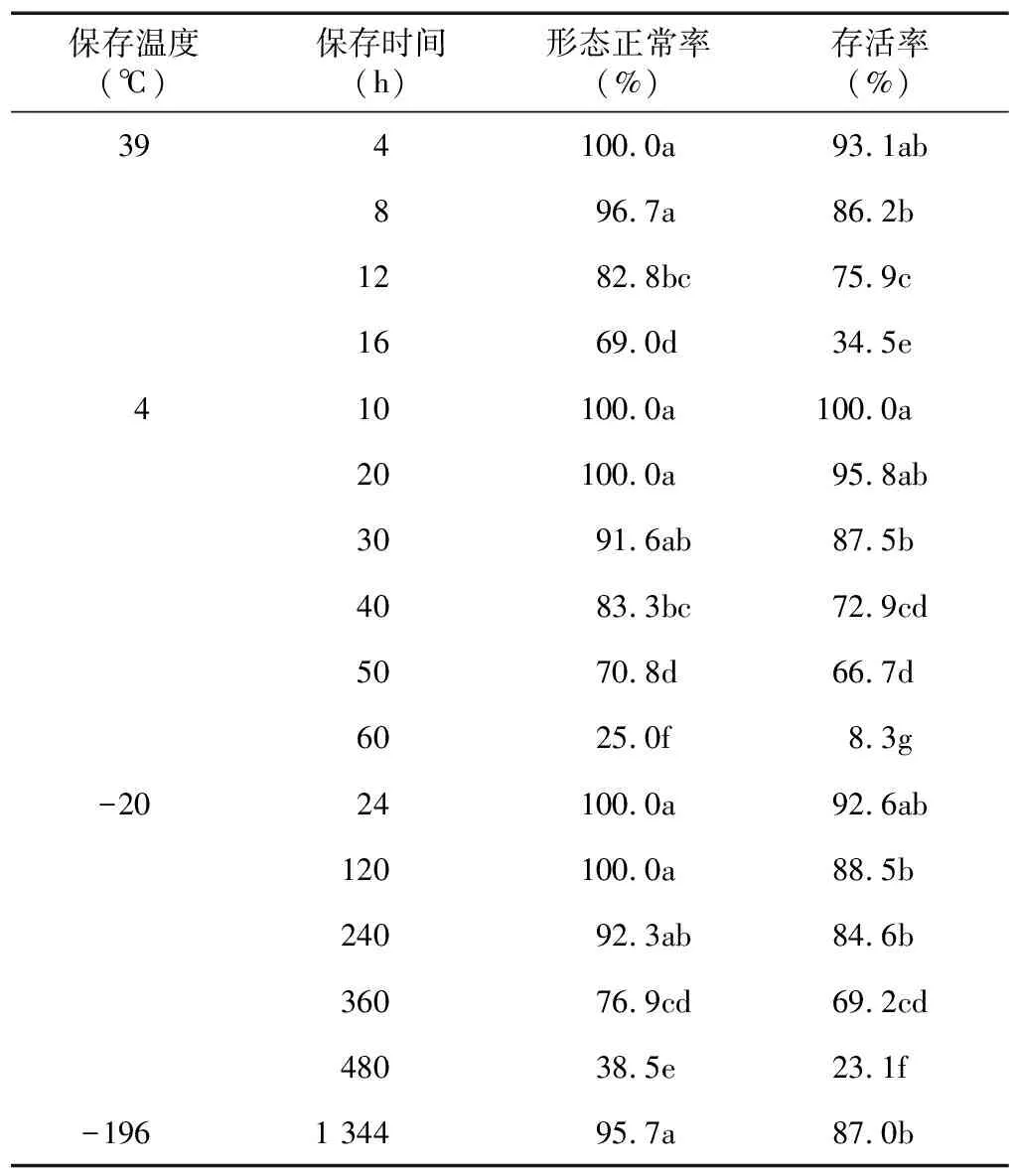
表6 不同保存温度下PbⅡ的形态与活性
同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
人的PbⅠ排出后可存活20 h[20],而小鼠的PbⅠ排出后仅仅存活 6~12 h[1]。刘文华等[14]将小鼠PbⅠ第二次减数分裂中期的卵母细胞在4.0 ℃、室温和37.5 ℃下进行保存观察,发现在室温和37.5 ℃下PbⅠ从细胞核排出后6 h完全失活,而在4.0 ℃下PbⅠ排出后12 h存活率为90%,排出后48 h存活率约为70%。39 ℃下猪极体(包括PbⅠ和PbⅡ)活性很快丧失,随着保存温度降低,其存活时间相应延长,在超低温(-196.0 ℃)条件下,极体的活性保持时间相对较长,保存1 344 h的PbⅠ和PbⅡ存活率仍保持在89.1%和87.0%。说明,降低卵母细胞极体在体外保存的环境温度,可有效延缓极体的退化与凋亡。同时还发现PbⅡ在39.0 ℃下的存活时间比PbⅠ长,-196.0 ℃低温冷冻保存下PbⅠ的存活率高于PbⅡ。
PbⅠ和PbⅡ遗传物质的全能性已被证实并得到公认[21]。极体中胞质很少,主要是细胞核,因此与精子一样易于冷冻长期保存。极体的冷冻保存为哺乳动物(特别是珍稀动物)雌性种质资源的保存开辟了新途径,在猪的雌配子(卵母细胞)或受精卵的冷冻保存研究方面虽已获得成功,但猪卵母细胞脂肪含量高,所以冷冻解冻后的成活率很低。猪极体冷冻保存的成功,绕过猪卵母细胞冷冻的困难,实现了猪雌配子遗传物质的长期保存。
参考文献:
[1] EVSIKOV A V, EVSIKOV S V. The first and second polar bodies in mouse oogenesis[J]. Ontogenez, 1995, 26(3): 196-200.
[2] FENG Y L, HALL J L. P-050 birth of normal mice after electrofusion of the second polar body with the male pronucleus: a possible treatment for oocyte-factor infertility[J]. Fertility and Sterility, 1997, 68: S116-S117.
[3] WAKAYAMA T, YANAGIMACHI R. The first polar body can be used for the production of normal offspring in mice[J]. Biology of Reproduction, 1998, 59(1): 100-104.
[4] EBNER T, YAMAN C, MOSER M, et al. Prognostic value of first polar body morphology on fertilization rate and embryo quality in intracytoplasmic sperm injection[J]. Human Reproduction, 2000, 15(2): 427-430.
[5] EBNER T, MOSER M, SOMMERGRUBER M, et al. First polar body morphology and blastocyst formation rate in ICSI patients[J]. Human Reproduction, 2002, 17(9): 2415-2418.
[6] 兰宗宝,何若钢,莫品方,等. 猪卵母细胞第一极体排出与否对其早期胚胎发育的影响[J]. 西南师范大学学报(自然科学版), 2008, 33(5):64-68.
[7] 鲍时华,彭弋峰. 卵细胞第一极体形态与受精卵及胚胎质量关系的研究[J]. 皖南医学院学报, 2003, 22(2):86-88.
[8] VERLINSKY Y, GINSBERG N, LIFCHEZ A, et al. Analysis of the first polar body: preconception genetic diagnosis[J]. Human Reproduction, 1990, 5(7): 826-829.
[9] MUNNÉ S, DAILEY T, SULTAN K M, et al. The use of first polar bodies for preimplantation diagnosis of aneuploidy[J]. MHR: Basic Science of Reproductive Medicine, 1995, 1(2): 94-100.
[10] 李澎涛,王 娜,殷晨星,等. 卵母细胞第一极体形态对受精结局的影响[J]. 广东医学, 2016, 37(24):3732-3734.
[11] 谷瑞环,孙贻娟,陆小溦,等. 第二极体排出时间在预测体外受精结局中的价值[J]. 中华临床医师杂志(电子版), 2011, 5(14):4127-4132.
[12] 刘 芳,王 莹,金 锐,等. 常规IVF短时授精第2极体排出及原核形成与胚胎发育潜能的相关性研究[J]. 宁夏医学杂志, 2013, 35(9):799-802.
[13] EBNER T, MOSER M, YAMAN C, et al. Elective transfer of embryos selected on the basis of first polar body morphology is associated with increased rates of implantation and pregnancy[J]. Fertility and Sterility, 1999, 72(4): 599-603.
[14] 刘文华,孙 洁,王公金,等. 小鼠卵母细胞第一极体的采集与保存[J]. 江苏农业学报, 2006, 22(1):42-45.
[15] 张世生. 小鼠第二极体发育潜力研究[D]. 重庆:西南农业大学, 2004.
[16] PARK Y S, KIM S S, KIM J M, et al. The effects of duration ofinvitromaturation of bovine oocytes on subsequent development, quality and transfer of embryos[J]. Theriogenology, 2005, 64(1): 123-134.
[17] 孙青原,秦鹏春,刘国艺,等.牛体外授精的程序及超微结构研究[J].动物学报,1996,42(3):303-308.
[18] 林 涛,李晓霞,刁云飞,等. 延边黄牛卵母细胞激活后第二极体排出的研究[J]. 畜牧与兽医, 2008, 40(8):50-52.
[19] 华再东,郑新民,魏庆信,等. 猪分级卵母细胞体外成熟时间规律的研究[J]. 中国畜牧兽医, 2011, 38(3):155-159.
[20] ORTIZ M E, LUCERO P, CROXATTO H B. Postovulatory aging of human ova: II. spontaneous division of the first polar body[J]. Molecular Reproduction and Development, 1983, 7(3): 269-276.
[21] 范必勤. 哺乳动物第一和第二极体的研究[J]. 农业生物技术学报, 2000, 8(2):103-105.

