NDM-5阳性大肠杆菌裂解性噬菌体的生物学特性
葛展霞, 钟希娜, 朱炳海, 何 涛, 魏瑞成, 王 冉
(1.江苏省农业科学院农产品质量安全与营养研究所/省部共建重点实验室——食品质量安全实验室/江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210014; 2.山东省阳信县动物卫生监督所,山东 滨州 251800)
新德里金属β-内酰胺酶(NDM)是2009年发现的一种新型金属β-内酰胺酶, 该酶从发现之初就备受关注。携带有该酶的菌株对包括碳青霉烯类在内的多类抗菌药物同时表现为高度耐药,并且耐药菌可以呈洲际传播,所以被称为“超级细菌”,令全世界为之恐慌[1]。NDM基因的主要宿主菌为大肠杆菌和肺炎克雷伯氏菌,包括NDM-1到NDM-12几个亚型,其中动物源(如鸡源和奶牛源)大肠杆菌上NDM-5基因的流行率呈递增趋势[2-3]。目前临床上针对NDM阳性细菌的感染,主要采取的治疗措施仍是抗生素疗法,即选择对该菌敏感的非β-内酰胺类药物进行治疗,但是抗生素长期使用亦可能激发或诱导病原菌的进一步超乎人类想象的变异,产生更为可怕的多重耐药或泛耐药细菌,因此,寻找一种有效的抗生素替代疗法成为摆在全球科学工作者面前的重要科学问题。
噬菌体是一种杀灭细菌的病毒,寄生于细菌并利用细菌来复制繁殖,最后将细菌裂解致死,由于其天然的杀菌特性,被科学家认为是潜在的“超级细菌的有效克星”,而噬菌体因具有对宿主细菌的高特异性,强大的裂解能力以及对人类和动物(产品)没有毒副作用,不会产生药物残留等优势而显示出比抗生素更加广阔的应用前景和价值[4-5]。在2000 年度Everygreen 噬菌体国际会议上,研究者报道的试验结果表明,噬菌体是有效、安全的病原体治疗和生态环境净化生物制剂[6]。本研究拟以1株携带NDM-5基因的鸡源大肠杆菌为宿主菌,从养殖场污水中分离针对该耐药大肠杆菌的裂解性噬菌体,并对其进行生物学特性分析,以期为NDM-5阳性大肠杆菌的防控提供新的技术手段。
1 材料与方法
1.1 试验材料
1.1.1 菌种与污水 试验所用多株NDM-5阳性大肠杆菌为江苏宿迁肉鸡养殖场的鸡粪便中分离得到,经PCR检测和测序确定其携带NDM-5基因,选择其中1株细菌SQ-C-E5作为噬菌体分离用宿主菌。同时采集该养殖场的污水样本用于分离噬菌体。
1.1.2 培养基及试剂
1.1.2.1 LB(Luria broth)液体培养基(1 L) 蛋白胨10 g,酵母粉5 g,NaCl 10 g,加ddH2O至1 L,调节pH至7.0,121 ℃,20 min高压灭菌。
1.1.2.2 0.6% LB半固体培养基(1 L) 蛋白胨10 g,酵母粉5 g,NaCl 10 g,琼脂粉6 g,加ddH2O至1 L,调节pH至7.0,121 ℃,20 min高压灭菌。
1.1.2.3 1.2% LB固体培养基(1 L) 蛋白胨10 g,酵母粉5 g,NaCl 10 g,琼脂粉12 g,加ddH2O至1 L,调节pH至7.0,121 ℃,20 min高压灭菌后,冷却至50 ℃,倾倒平板,冷却凝固后,倒置备用。
1.1.2.4 SM缓冲液(1 L) 称取6.055 g Tris-HCI(pH为7.5)定容至100 ml,加入5.800 g NaCl,2.000 g MgSO4后,加入ddH2O定容至1 L。
1.1.2.5 脑心浸液肉汤培养基(BHI)(1 L) 称取37 g脑心浸液肉汤培养基粉末(青岛海博生物技术有限责任公司产品)于1 000 ml蒸馏水中,加热煮沸至完全溶解,121 ℃高压灭菌15 min,冷却备用。
1.1.2.6 伊红美蓝培养基(EMB)(1 L) 称取37.5 g伊红美蓝培养基粉末(北京陆桥技术有限责任公司产品)于1 000 ml蒸馏水中,加热煮沸至完全溶解,121 ℃高压灭菌15 min,冷却至55 ℃左右,混匀后倾注平板备用。
1.1.2.7 DNA试剂盒 由天根生化科技有限公司生产。
1.1.3 主要仪器 试验中主要用到的试验仪器和设备见表1。

表1 试验主要仪器和设备
1.2 方法
1.2.1 噬菌体的分离及纯化 将污水样10 000 r/min离心之后取上清液,在无菌环境下经0.22 μm滤膜过滤之后,取10 ml加入11 ml处于对数生长期(1×108CFU/ml)的大肠杆菌SQ-C-E5菌液中37 ℃培养12 h,将共培养液10 000 r/min离心10 min,经0.22 μm滤膜过滤后得到的液体,即噬菌体原液。
采用双层平板法[7]进行噬菌体的鉴定,取0.1 ml原液于0.9 ml SM稀释液中稀释,依次向后作10倍梯度稀释,稀释倍数至105、106后,取0.1 ml稀释液于0.1 ml细菌中混合,静置15 min,加入3.5 ml约50 ℃的0.6% LB半固体培养基,混匀后倒入1.2% LB固体培养基中,倒置于恒温培养箱中,37 ℃培养12 h,观察是否有噬菌斑出现。挑选有噬菌斑的平板进行初步纯化,从有噬菌斑的平板中挑取单个形态清晰的噬菌斑,并将其溶解于0.9 ml SM稀释液中,振荡均匀后,取0.1 ml液体稀释,进行双层平板试验,重复该操作,直至噬菌斑的大小均一,得到较纯的噬菌体液。
1.2.2 噬菌体效价测定 采用双层平板法,每个稀释度2个重复,计数时选取噬菌斑个数为30~300的平板计数,记录噬菌斑个数,计算噬菌体的效价。噬菌体效价(PFU/ml)=噬菌斑个数×稀释倍数/所取样品体积。
1.2.3 噬菌体的电镜形态观察 根据余静丹[8]的方法,将处理好的用SM稀释液溶解的噬菌体样20 μl滴于铜网中,自然沉降15 min后,用滤纸吸取多余的水分,加1滴2%的磷钨酸于铜网中染色,待样品干燥后,于透射电子显微镜下观察形态。
1.2.4 噬菌体基因组分析 将纯化后的噬菌体液按DNA试剂盒中的方法依次进行操作,用RNase A水溶液溶解的液体置于-20 ℃冰箱中待用。
将提取的核酸用DNase I、RNase A和Mung Bean Nuclease进行处理和判断噬菌体基因组的类型,用限制性核酸内切酶EcoR I和Hind Ⅲ 酶切,根据酶切后电泳的DNA条带大小进行基因组分子量大小的估算。
1.2.5 最佳感染复数测定 最佳感染复数的定义为噬菌体与宿主菌数量的比值。根据Lu等[9]的方法,首先,将处于对数生长期(1×108CFU/ml)的宿主菌用新鲜的 LB 液体培养液洗涤,然后将细菌数量调整为1.0×108CFU/ml。按照感染复数(MOI)分别为 0.01、0.10、1.00、10.00 和 100.00 的比例,将相应数量的噬菌体液加入到已准备好的菌液中,混匀, 37 ℃,160 r/min 震荡培养5 h。将混合培养物10 000 r/min离心1 min,得到裂解液。用双层琼脂平板法测定裂解液中噬菌体的效价,产生最高效价的感染复数即为最佳感染复数(MOI)。同样条件下设置3组重复试验,每组2个平行。
1.2.6 一步生长曲线绘制 噬菌体液与宿主菌液以最佳感染复数的比例加入到新鲜的LB液体培养基中,37 ℃孵育15 min,10 000 r/min离心1 min,弃掉上清液,用新鲜的LB液体洗涤2次。加入等体积37 ℃预热的LB液体培养基,充分混匀,迅速置于37 ℃摇床中振荡培养。同时开始计时,在0 min和每隔10 min取样1次,采用双层琼脂平板法测定噬菌体的效价。以感染时间为横坐标,噬菌体效价为纵坐标,绘制噬菌体的一步生长曲线。同样条件下设置3组重复试验,每组2个平行。
1.2.7 杀菌效力测定 将过夜培养的宿主菌用培养液稀释至 1×107CFU/ml,取18根试管,宿主对照组中加入1.5 ml稀释后的宿主菌和1.5 ml LB培养液,其他试验组中加入1.5 ml稀释后的宿主菌和1.5 ml不同效价的噬菌体,使其MOI值依次为0.01、0.10、1.00、10.00 和 100.00 ,每个MOI值做3个平行,每30 min测定1次OD600,测定10次。
1.2.8 热稳定性测定 将噬菌体放于30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃水浴锅中,分别持续 30 min和60 min 后,利用双层平板法,待平板凝固后放于37 ℃下培养12 h,观察结果。同样条件下设置3组重复试验,每组2个平行。
1.2.9 pH稳定性测定 调整LB液体培养基的pH值分别为2、3、4、5、6、7、8、9、10、11、12,取不同pH值浓度的LB液体100 μl,加入100 μl噬菌体液混匀,37 ℃作用2 h。从每管中各取100 μl,铺双层琼脂平板,37 ℃培养过夜,进行噬菌斑计数,测定噬菌体的效价。同样条件下设置3组重复试验,每组2个平行。
1.2.10 宿主谱分析 采用点样法,测定噬菌体对不同大肠杆菌菌株的裂解情况。将30株来自江苏宿迁3个不同鸡养殖场的大肠杆菌培养至对数生长期,其中包括了13株NDM-5阳性菌株,17株NDM-5阴性菌株,分别取100 μl涂布至1.2%固体LB培养基上,晾干后,将10 μl的噬菌体点样至平板上,37 ℃过夜培养后,观察其对不同菌株的裂解情况。
2 结果与分析
2.1 噬菌体的分离及噬菌斑特征
采用双层平板法,多次重复试验步骤,得到纯化后的噬菌斑,最终获得的噬菌斑呈圆形,且噬菌斑透亮,无晕圈(图1),由噬菌斑可知,该噬菌体为裂解性噬菌体,将其命名为vB_EcoM_Bp5。
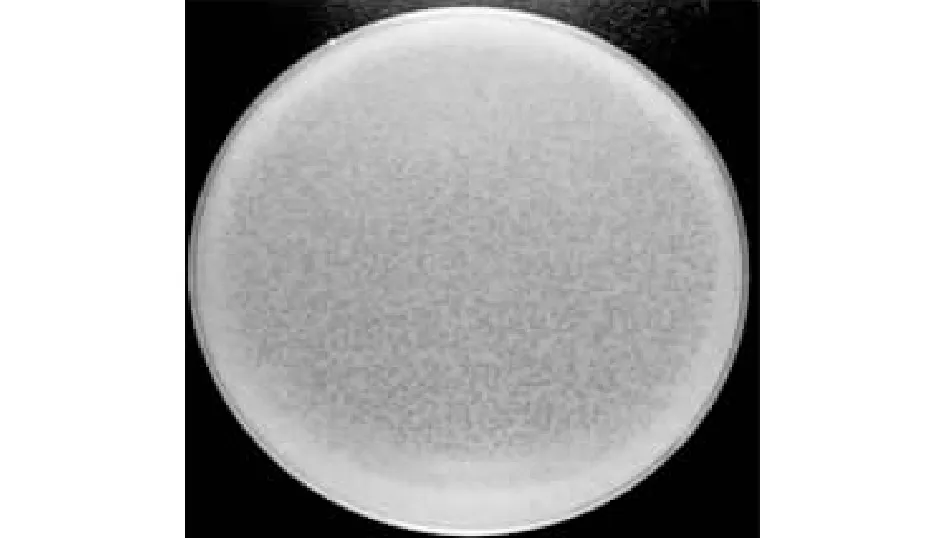
图1 噬菌体vB_EcoM_Bp5噬菌斑Fig.1 Plaques of bacteriophage vB_EcoM_Bp5
2.2 噬菌体透射电镜形态
噬菌体vB_EcoM_Bp5经负染后,于电镜下观察后的电镜图见图2,该噬菌体的头部为多面体,直径约80 nm,有可伸缩长尾,尾部长约90 nm,直径约为20 nm,有少量尾丝清晰可见,按国际病毒分类委员会分类规则[10],将其归为有尾噬菌体目,肌尾病毒科。
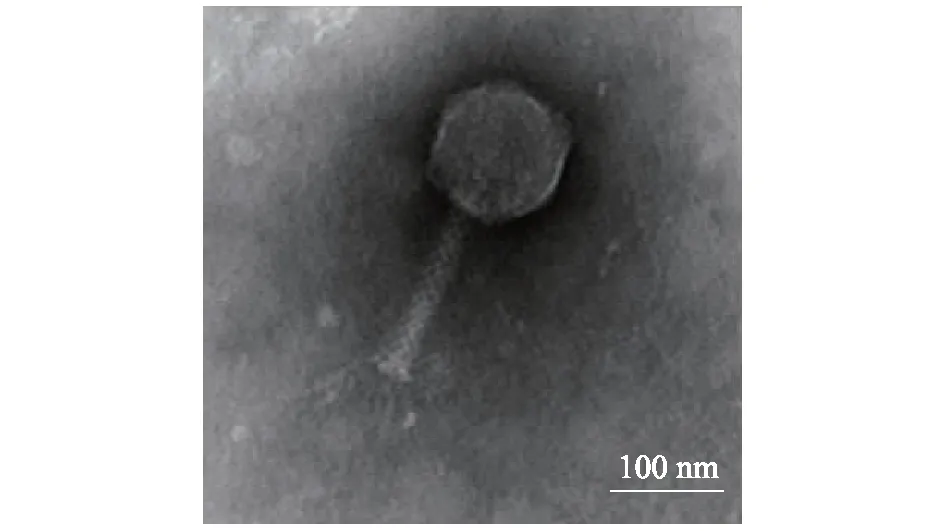
图2 噬菌体vB_EcoM_Bp5透射电镜形态Fig.2 Morphology of bacteriophage vB_EcoM_Bp5 in transmission electron microscope
2.3 噬菌体基因组分析
泳道M1和M2分别为23 kb Marker 和 15 kb Marker,泳道1为噬菌体vB_EcoM_Bp5基因组,泳道2和3分别为噬菌体vB_EcoM_Bp5基因组被EcoR I 和Hind III消化后的产物。
噬菌体vB_EcoM_Bp5基因组只可以被DNase I消化,而不可以被RNase A和Mung bean nuclease消化,说明该噬菌体基因组为dsDNA(双链DNA)。由图3可知,通过对噬菌体基因组进行酶切,根据酶切片段与DNA marker的条带比对,噬菌体的基因组分子量大小约为50 kb,其确切的分子量大小还需要通过全基因组测序才能确定。
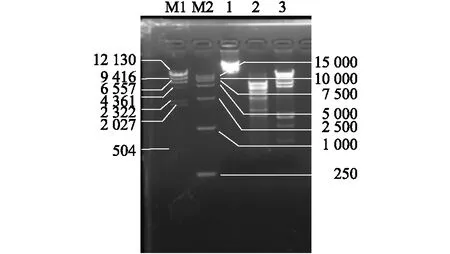
图3 噬菌体vB_EcoM_Bp5基因组酶切图谱Fig.3 Electrophoresis of bacteriophage vB_EcoM_Bp5 genome
2.4 最佳感染复数
由表2可知,当MOI为10时,噬菌体vB_EcoM_Bp5感染SQ-C-E5后的噬菌体效价为1.6×1011PFU/ml,与其他感染复数作用下的噬菌体效价相比,MOI为10时,噬菌体效价最高,因此,噬菌体vB_EcoM_Bp5的最佳MOI为10。
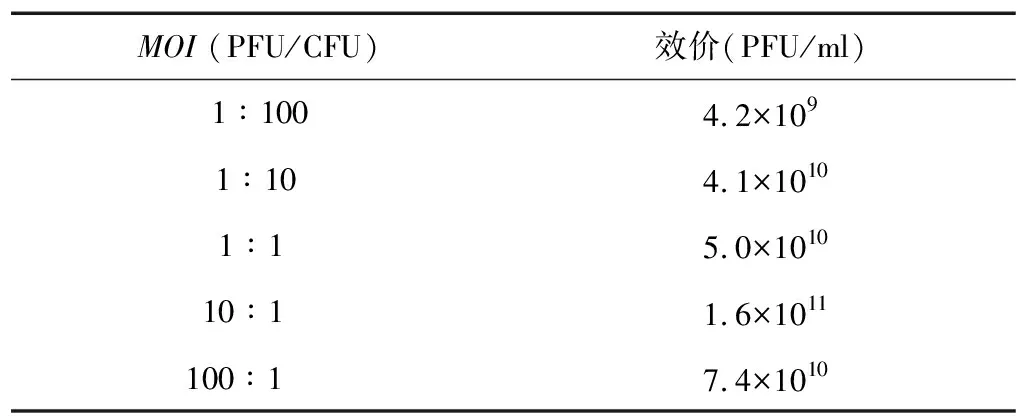
表2 噬菌体vB_EcoM_Bp5最佳MOI的测定
2.5 一步生长曲线
由图4可知,噬菌体vB_EcoM_Bp5在感染宿主菌后效价在5 min内无明显变化,即潜伏期为5 min,爆发期大约持续65 min,在70 min后噬菌体数量趋于平稳。噬菌体的初期数量5.0×105PFU/ml,裂解末期噬菌体数量平均值为6.8×107PFU/ml,根据裂解量=裂解末期噬菌体平均数量/感染初期细菌数量可知,噬菌体vB_EcoM_Bp5的裂解量为136。
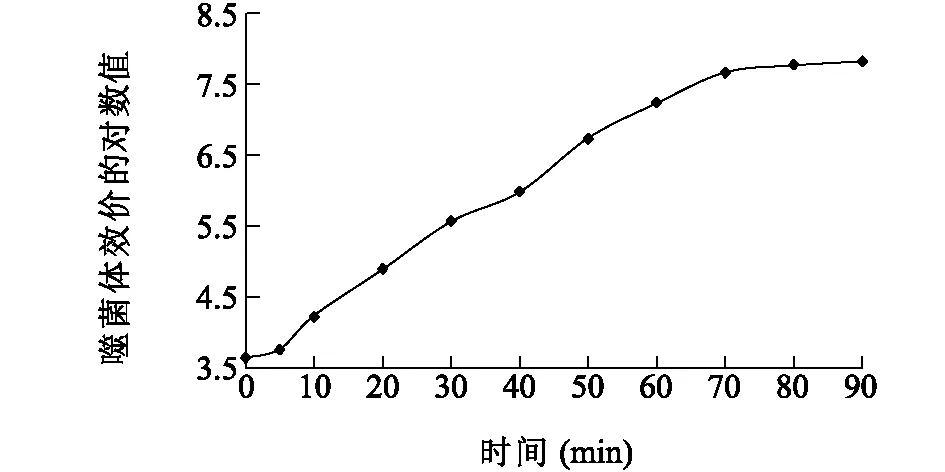
图4 噬菌体vB_EcoM_Bp5一步生长曲线Fig.4 One-step growth curve of vB_EcoM_Bp5
2.6 噬菌体杀菌效力
由图5可知,当噬菌体vB_EcoM_Bp5与宿主菌感染复数为0时,表示培养液内仅含有细菌,没有噬菌体,其在5 h内,OD600呈上升趋势,而在感染复数为0.01,0.10,1.00,10.00,100.00时,OD600都有不同程度的下降,并且无上升的过程,最后趋于稳定,表明噬菌体vB_EcoM_Bp5的杀菌效果明显,在感染初期,能有效抑制细菌的生长,并在后期完全抑制细菌生长,甚至可以完全清除细菌。在不同的感染复数下,其下降的幅度是不一样的,当感染复数达到10时,其对宿主菌的裂解效果最明显。
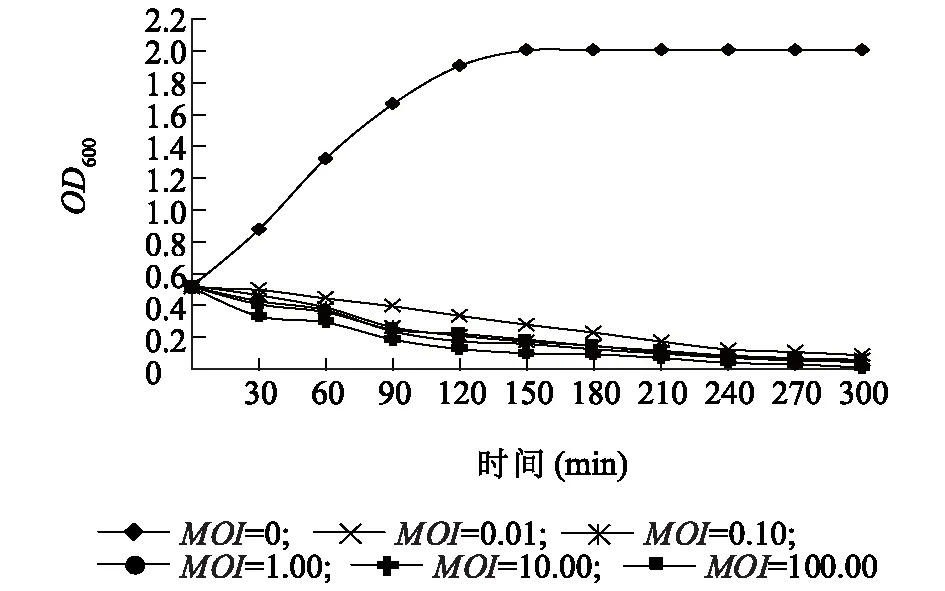
图5 噬菌体vB_EcoM_Bp5裂解细菌的动态曲线Fig.5 Lytic kinetics of bacteriophage vB_EcoM_Bp5
2.7 热稳定性
由图6可知,噬菌体vB_EcoM_Bp5在温度条件为30 ℃、40 ℃、50 ℃时,随时间推移,其效价并没有发生明显的变化,而在60 ℃时,噬菌体效价开始下降,并且温度越高,作用时间越长,活力下降越明显。在80 ℃时,噬菌体效价为零,表明在此温度下,噬菌体的活力受到了严重的破坏。可知,噬菌体vB_EcoM_Bp5的最适温度为30~60 ℃。
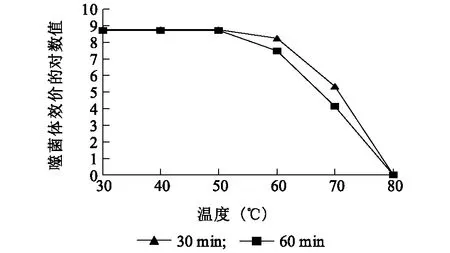
图6 噬菌体vB_EcoM_Bp5温度耐受能力Fig.6 Tolerance to temperatures of vB_EcoM_Bp5
2.8 pH稳定性
由图7可知,噬菌体vB_EcoM_Bp5在pH为5~10时,噬菌体的活力较稳定,当pH小于5或大于10时,噬菌体的活力下降明显,在pH≤3或≥11时,噬菌体处于失活状态,表明该噬菌体在强酸,强碱的条件下无法存活。由此可知,该噬菌体的最适pH范围为5~10。

图7 噬菌体vB_EcoM_Bp5酸碱耐受能力Fig.7 Tolerance to acidity and alkalinity of vB_EcoM_Bp5
2.9 噬菌体的裂解谱
选取30株鸡源大肠杆菌进行点样,发现噬菌体vB_EcoM_Bp5能裂解其中的17株大肠杆菌,裂解率为56.7%,其中12株为NDM-5阳性大肠菌株,5株为NDM-5阴性大肠菌株,分别来源于场I(8株)、场II(5株)和场III(4株)3个鸡养殖场。由此可见,噬菌体vB_EcoM_Bp5宿主谱较宽,能够有效地裂解多株鸡源NDM-5阳性大肠杆菌,同时对NDM-5阴性的大肠杆菌也有一定的裂解作用,说明噬菌体vB_EcoM_Bp5为宽宿主谱的大肠杆菌裂解性噬菌体。
3 讨 论
3.1 对携带NDM-5基因的大肠杆菌具有裂解作用的噬菌体的分离鉴定
大肠杆菌广泛存在于畜禽机体以及养殖环境中,大肠杆菌病是畜牧养殖业常见疾病之一,目前对于大肠杆菌病的治疗主要依赖于抗生素疗法。但是由于抗生素的大量使用,大肠杆菌对抗生素产生了耐药性,尤其是携带NDM-5基因的大肠杆菌的出现,可以对几乎所有的β-内酰胺类药物耐药,对动物疾病治疗和食品安全提出了严峻挑战,亟需寻找一种安全、高效的方法来治疗耐药大肠杆菌引起的动物疾病[11]。
由于噬菌体能够高效地杀死宿主菌,人们开始关注噬菌体在对抗细菌感染性疾病中的作用[12]。噬菌体在自然环境中广泛分布,据估计,噬菌体的丰度约为 1×1031,为人类提供了一个可以利用的丰富的抗菌资源库[13]。
本研究筛选出1株对携带NDM-5基因的大肠杆菌具有裂解作用的噬菌体vB_EcoM_Bp5,其能够杀灭多株NDM-5阳性的大肠杆菌。噬菌体vB_EcoM_Bp5头部呈现多面体,头部直径约80 nm,有一个可伸缩长尾,尾部长约90 nm,直径约20 nm,属于肌尾病毒科,与吴伟胜[14]报道的无明显的尾部,直径为50 nm的鸡源大肠杆菌噬菌体Bp5和Bp6的形态明显不同,与郭秋菊等[15]报道的几株大肠杆菌噬菌体的形态也有差异,说明不同地区分离出来的大肠杆菌噬菌体形态不同。
噬菌体vB_EcoM_Bp5的噬菌斑呈圆形,噬菌斑透亮,无晕圈,说明该噬菌体为裂解性噬菌体,且只可以被DNase I消化,说明该噬菌体基因组为双链DNA。
3.2 噬菌体的生物学特性
噬菌体vB_EcoM_Bp5在温度30~60 ℃时稳定,在pH 5~10时稳定,与王礼伟等[16]报道的大肠杆菌噬菌体EcP10相比,本研究中的噬菌体pH稳定范围较广,并且稳定性较强,与何觅之[17]报道的Bp9B1226噬菌体相比,本研究中的噬菌体在30~60 ℃的温度稳定性较高。同时,噬菌体的潜伏期为5 min,裂解量为136,与李振江等[18]报道的潜伏期20 min,裂解期20 min的大肠杆菌噬菌体PD15相比,本研究中的潜伏期较短,能够在较短时间内释放出裂解性噬菌体,有效快速杀灭大肠杆菌,并且其裂解量较大,明显高于赵俊杰[19]报道的裂解量为60.5的大肠杆菌噬菌体LZZ-17。由此可见,该噬菌体的杀菌效果比较迅速和显著,与其他噬菌体相比,可以短时间有效地降低大肠杆菌的数量。由噬菌体vB_EcoM_Bp5的杀菌效力测定结果可知,本研究中的噬菌体在不同的MOI值下,其都能有效地使大肠杆菌的OD600在较短的时间内快速降低,说明其裂解效果明显,同时,噬菌体vB_EcoM_Bp5的杀菌谱较广,不仅可以杀灭NDM-5阳性的大肠杆菌,对不携带NDM-5基因的大肠杆菌也有裂解作用,因此该噬菌体具有较高的应用价值。
在目前细菌耐药性普遍存在,而新型抗菌药物研发滞后的情况下,噬菌体疗法以其独特的优势又重新回到了人们的视野当中。但是噬菌体疗法也有一定的局限性,噬菌体最终应用于临床还有待进一步的研究。噬菌体本身对宿主的特异性高,其应用时存在宿主谱窄的问题,因此如何扩大其宿主谱,以及其进入动物机体后免疫反应如何,都有待进一步的研究。
参考文献:
[1] 邹大阳.ndm-1耐药菌在中国的流行及特性研究[D]. 北京:中国人民解放军军事医学科学院,2015.
[2] WANG Y,ZHANG R,LI J. Comprehensive resistome analysis reveals the prevalence of NDM and MCR-1 in Chinese poultry production [J]. Nature Microbiology,2017,2:16260.
[3] HE T,WEI R,ZHANG L. Characterization of NDM-5-positive extensively resistantEscherichiacoliisolates from dairy cows [J]. Veterinary Micobiology,2017,207: 153-158.
[4] SULAKVELID A,ALAVIDZE Z,MORRIS J G. Bacteriophage therapy[J].Antimicrobial Agents and Chemotherapy,2001,45(3):649-659.
[5] 韩 晗,李雪敏,王 爽,等.噬菌体作抗菌剂使用的安全性评价研究进展[J]. 江苏农业科学,2017,45(22):18-23.
[6] 代保英. 大肠杆菌K88噬菌体的分离、分类初步鉴定和生物学特性的测定[D]. 扬州:扬州大学,2009.
[7] SUMMERS W C. Bacteriophage therapy [J]. Annual Review of Microbiology,2001,55(2): 437-451.
[8] 余静丹. 鲍曼不动杆菌噬菌体的分离鉴定及生物学特性的研究[D]. 长春:吉林大学,2013.
[9] LU Z,BREIDT F,FLEMING H P,et al. Isolation and characterization of aLactobacillusplantarumbacteriophage,ΦJL-1 from a cucumber fermentation [J]. International Journal of Food Microbiology,2003,84(2): 225-235.
[10] LEUSCHNER R G K,ARENDT E K,HAMMES W P. Characterization of a virulentLactobacillussake phage PWH2 [J]. Appllied Microbiology Biotechnology,1993,39(4/5): 617-621.
[11] 李 杨,王 静,霍 凯,等. 大肠杆菌噬菌体的分离及其生物学特性[J]. 中国兽医杂志,2014,41(1): 7-10
[12] 王 冉,韩 晗,张 辉,等. 大肠杆菌K88噬菌体的分离鉴定及其生物学特性[J]. 华北农学报,2012,27(4):163-167.
[13] WOMMACK K E,COLWELL R R. Virioplankton:viruses in aquatic ecosystems [J]. Microbiology and Molecular Biology Reviews,2000,64(1): 69-114.
[14] 吴伟胜. 鸡大肠杆菌噬菌体的分离鉴定及初步应用[D].聊城:聊城大学,2016.
[15] 郭秋菊,滕井华,许荣均,等. 大肠杆菌噬菌体的分离、纯化及其特性研究[J].厦门大学学报(自然科学版), 2008,47(S2): 273-277.
[16] 王礼伟,梁 晏,屈勇刚,等. 一株鸡源致病性大肠杆菌噬菌体的分离及其生物学特性[J]. 江苏农业学报,2014,30(2):455-457.
[17] 何觅之. 大肠杆菌K88、K99广谱噬菌体的分离与生物学特性鉴定[D].武汉:华中农业大学,2012.
[18] 李振江,张 改,王书伟,等.大肠杆菌噬菌体PD15的分离与生物学特性的研究[J].河南医学高等专科学校学报,2016,28(3): 165-168.
[19] 赵俊杰. 大肠杆菌噬菌体LZZ-17生化特性及全基因组学研究[D]. 兰州:甘肃农业大学,2016.

