樱桃番茄果实光泽度测定方法的建立和应用
周 蓉, 徐丽萍, 王银磊, 赵丽萍, 余文贵, 赵统敏
(1.江苏省农业科学院蔬菜研究所,江苏 南京 210014; 2.江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014; 3.西宁市蔬菜研究所,青海 西宁 810016)
樱桃番茄可作蔬菜或水果生食,深受消费者的喜爱。随着人们生活水平的提高,消费者对樱桃番茄的要求不再局限于口感,外观品质好的樱桃番茄具有较好的市场。随着果蔬国际贸易的逐渐扩大,符合国际果蔬市场需求的优质樱桃番茄也需要有良好的外观品质。因此,樱桃番茄果实的外观品质(如色泽和形状等)直接影响其市场价值。近年来,人们对果实色泽特征的描述已经从感官的定性描述逐渐转向色度值的定量描述[1]。常用的定量描述方法有色差计法、比色法和色卡法[1]。目前对果实色泽的研究应用最多的是色差计法[2-3]。光泽度是樱桃番茄果实的一个重要外观性状,具有高光泽性状的樱桃番茄由于鲜艳和亮丽的外表,深受广大消费者的喜爱,其市场价格比低光泽的樱桃番茄高。关于番茄色泽的报道很多,但多数集中在颜色方面,极少涉及光泽方面[4-7]。
番茄果实表面的光泽度是一项难以测量的外观参数,研究人员往往根据个人经验,用肉眼观察的方法评价果实的光泽度[8]。肉眼观察的方法个人主观性较强,容易产生视觉疲劳,测量误差较大,且不适于大规模光泽度的评价,不利于企业的大批量分类[1]。周冰钰等将黄瓜果实外表皮剥下后铺平,利用光泽度仪HYD-09测得果实的光泽值[9]。然而,该方法对果实具有破坏性,需要厚薄均匀且平整的果皮,且外界自然光会影响测量结果,不利于大规模测量。潘磊庆等发明一种苹果表面光泽度检测装置,对苹果进行拍摄,通过图像处理识别系统给出苹果光泽度等级[10]。该方法要求具备图像拍摄和处理系统,技术要求较高,操作较为复杂。目前,相关基础研究和市场应用均急需一种准确快速且非破坏性的测定樱桃番茄果实表面光泽度的方法。然而,国内外尚无樱桃番茄果实表面光泽度测定方法及光泽度评价方法的报道。从樱桃番茄品质看,果皮光泽性状是影响外观品质的主要因素之一,也是主要经济性状之一。因此,培育外观、内在品质俱佳的优良番茄品种,已成为当今番茄育种的主要目标。在传统育种中,对果皮光泽度性状的鉴定需要等到果实成熟期,耗时较长[9]。利用分子标记辅助选择育种,可以缩短育种周期,加快番茄育种进程[11]。
因此,为了定量描述番茄果实的光泽度,本研究将利用分光测色计检测樱桃番茄的多个颜色参数,筛选评价樱桃番茄光泽度的最佳颜色参数;通过摸索试验条件,建立一种快速、准确、非破坏性的测定樱桃番茄果实光泽度的方法。再基于建立的方法,进一步选择高光泽和低光泽的樱桃番茄材料作为亲本,构建F2群体,选择具有极端光泽度的F2代单株,为番茄果实光泽度相关分子标记的开发奠定基础。
1 材料与方法
1.1 用于建立樱桃番茄果实光泽度测定方法的植物材料
以江苏省农业科学院蔬菜研究所番茄课题组提供的10个樱桃番茄基因型(WJ-1至WJ-10)为试验材料,于2015年春季种植在江苏省农业科学院六合基地塑料大棚内,用于樱桃番茄果实光泽度评价方法的建立。樱桃番茄植株按常规方法进行管理。
1.2 不同光泽度樱桃番茄果实颜色参数的测定
在盛果期,从10个基因型樱桃番茄植株的第3~4个果穗,随机选取76个成熟度一致的果实,利用分光测色计CM-700D(日本柯尼卡美能达公司产品)测定樱桃番茄果实表面色泽,每个果实沿赤道面测定5个点后求平均值,获得每个果实最终的L*、a*、b*和G值。L*、a*和b*值的色空间是最常用的物体颜色空间。L*值0表示黑色,100表示白色,各种灰白在0和100之间;a*(红绿色差)值大于0表示红色,小于0表示绿色,绝对值越大,红色或绿色越深;b*(黄蓝色差)值大于0表示黄色,小于0表示蓝色,绝对值越大,黄色或蓝色越深。G(8°角光泽)值表示物体表面的光泽度。参考Gomez等[4]和周蓉等[3]的方法,计算获得a*/b*、(a*/b*)2、色调(H)、色度(C)、番茄颜色指数(TCI)这5个色泽参数。其中,色调= ATAN(a*/b*)2,色度= (a*2+b*2)1/2,TCI=L*×[(a*2+b*2)1/2]。在使用分光测色计CM-700D前,用清洁的标准板进行校准。去除樱桃番茄果实表面的污渍,避免外界光照进入测量孔。同时,通过5个人对多份樱桃番茄品种果实的肉眼观察和光泽度评价,获得高光泽和低光泽的樱桃番茄作为参照,对76个樱桃番茄果实进行肉眼分级。根据光泽水平的高低将樱桃番茄果实分为4个等级,具有低光泽度的番茄果实定为1级,具有高光泽度的番茄果实定为4级,介于二者之间的果实光泽度定为2级(中等光泽度且偏向于1级)和3级(中等光泽度且偏向于4级)。
1.3 樱桃番茄果实光泽测定方法的建立
取成熟樱桃番茄果实,在自然和4个不同水平的手动施压情况下放置在测量口,测定G值,其中手动施压1级为轻微施压,2级为中等施压,3级为较重施压,4级为严重施压,以6个果实作为重复。取16个成熟果实,自然放置后,在果实表面同一位置重复测定G值2次。取14个成熟果实,自然放置后,在晴天室内开启2个日光灯、1个日光灯、自然光和黑暗的外界环境下测定G值。取9个成熟果实,自然放置后,每个果实沿赤道面测定4个、5个、6个、8个点的G值,同时在覆盖整个果实表面的23个点测定G值。
随机选取4个番茄植株,从每个植株的第1果序、第2果序和第3果序分别取3个成熟果实,每个果实沿赤道面选取5个点测定G值。在同一番茄植株上,选取8种不同成熟度的果实,同一成熟度选取3个果实,每个果实沿赤道面选取5个点测定G值。
取13个成熟果实,每个果实沿赤道面选取5个点,在采摘当天(0 d)、采摘后1 d、2 d和4 d测定G值。
1.4 亲本材料的筛选和F2群体的构建
为了评价市场上主栽品种和本课题组樱桃番茄果实光泽度,对市场上13份樱桃番茄品种(M1~M13)和本课题组9份高代自交系樱桃番茄材料(J1~J9)的果实进行G值测定。每个品种测定8个果实,每个果实沿赤道面选取5个点,并进行肉眼观察评价果实光泽度。然后,选取本课题组的1个高光泽(J8)和1个低光泽(J9)樱桃番茄,分别取14个成熟度一致的果实和6个不同成熟度的果实进行G值测定。为了开发番茄果实光泽度相关的分子标记,利用高光泽和低光泽樱桃番茄构建F2群体。以高光泽樱桃番茄(J8,即P1)和低光泽樱桃番茄(J9,即P2)为亲本,2015年春季在江苏省农业科学院六合基地正反交获得F1,2015年秋季在连云港赣榆基地F1植株自交产生F2群体。2016年春季种植正交F2代169个单株,反交F2代178个单株。2017年春季种植正交F2代304个单株。2016年和2017年春季均种植P1、P2和F1。所有试验材料由江苏省农业科学院蔬菜研究所番茄课题组提供,并按常规方法进行管理。
1.5 F2代单株果实表面光泽度的测定和分级
利用已优化的番茄果实光泽测定方法,随机选取P1和P2的12个单株进行G值测定,同时将P1果实光泽度定为4级,P2果实光泽度定为1级。对F2代单株成熟果实进行G值测定和肉眼光泽度分级。每个植株选择具有代表性的8个成熟果实,选取每个果实赤道面的5个点测定G值,这5个点G值的平均值作为该果实最终G值,8个果实G值的平均值作为该单株果实最终G值。同时,通过肉眼观察,对每个单株的成熟果实进行光泽度分级,与P1果实光泽度相似的定为4级,与P2果实光泽度相似的定为1级,介于P1和P2之间的果实光泽度定为2级(中等光泽度且偏向于P2果实光泽度)和3级(中等光泽度且偏向于P1果实光泽度)。
1.6 数据分析
利用SPSS(SPSS Inc., Chicago, IL, 美国)进行Person相关性分析。
2 结果与分析
2.1 樱桃番茄果实光泽度测定参数的筛选和测定方法的优化
通过76个樱桃番茄表面色泽参数与肉眼光泽度分级值的比较可以看出,L*和G这2个色泽参数与肉眼光泽度分级值分别呈显著负相关和极显著正相关,相关系数(r)分别为-0.206和0.788(表1),因此,G值可以用于樱桃番茄果实光泽的有效评价。
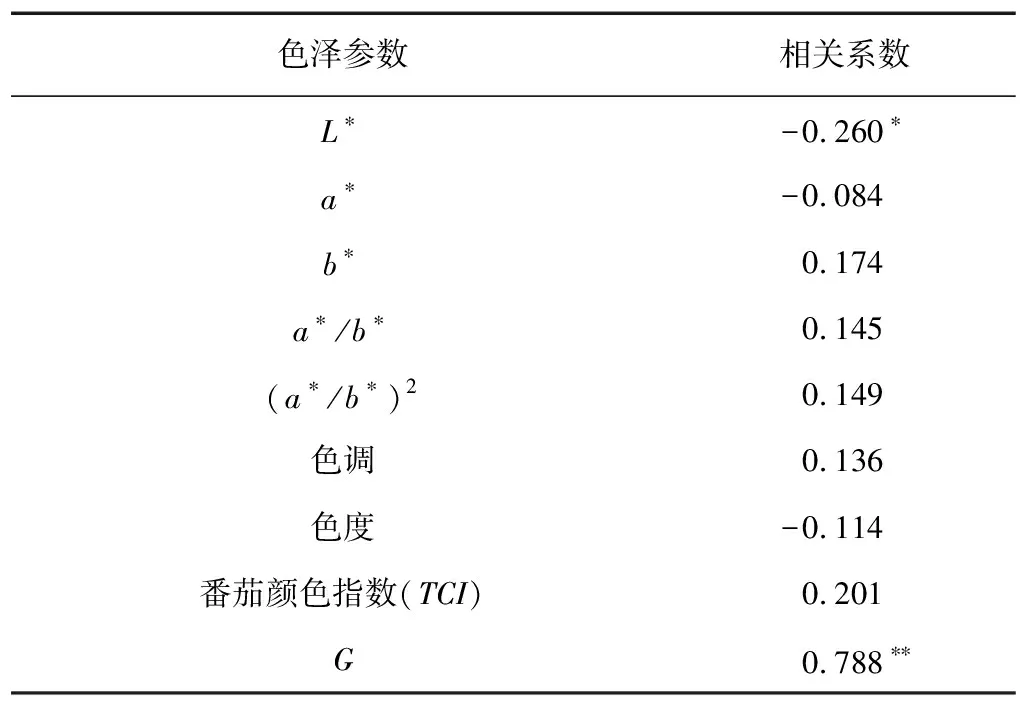
表1 76个樱桃番茄的果实色泽参数与肉眼光泽度分级值的相关性
*表示相关显著;**表示相关极显著。
与自然放置相比,手动施压会减小番茄果实的G值,且施压力度越大,G值越小(图1)。利用CM-700D分光测色计对番茄果实表面同一个点2次测定的结果完全一致。在2个日光灯、1个日光灯、自然光和黑暗的外界条件下测定的G值一致。在自然光条件下自然放置,每个果实表面选取4个、5个、6个、8个点与选取23个点测定的G值之间呈极显著相关,相关系数(r)分别0.913**、 0.977**、0.944**和0.970**。同一植株3个果序的果实光泽度之间无显著差异,且同一植株不同成熟度的果实光泽度之间也无显著差异。采摘后1 d、2 d和4 d与采摘当天番茄果实的G值均呈极显著正相关,相关系数(r)分别为0.877**、0.812**和0.807**(表2)。
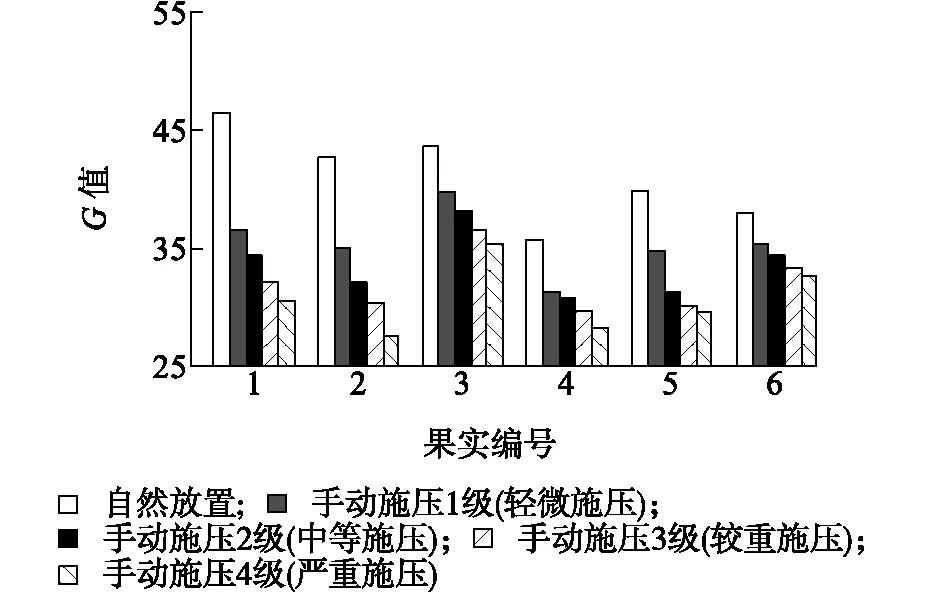
图1 外界压力对樱桃番茄果实表面G值测定结果的影响Fig.1 The effect of the outside pressure on the measured G value of cherry tomato surface

表2 樱桃番茄采摘后不同时间与采摘当天G值的相关性
2.2 高光泽和低光泽樱桃番茄材料的选择
在市场上搜集的13份樱桃番茄品种中,圣桃6号果实光泽度最高(G=42.7),紫皮球果实最暗(G=19.9),这13份品种果实的平均G值为31.8(图2)。同时,根据肉眼观察结果,初步选取本课题组的9份樱桃番茄基因型,其中5份是高光泽材料(J1、J2、J3、J4和J8),4份是低光泽的材料(J5、J6、J7和J9)。J8的G值最高(42.7),J9的G值最低(25.3)(图2)。对于J8和J9而言,14个成熟度一致的果实G值之间无显著差异。
在6个不同成熟期,J8果实的G值均显著高于J9,J8果实G值在不同成熟期差异不显著,而J9果实G值在成熟后期显著下降(图3)。由J8和J9果实的照片也可以看出,J8果实光泽度显著高于J9。
2.3 樱桃番茄F2代单株果实光泽度的比较
为了筛选具有不同光泽度的F2代单株,并进一步证实G值与肉眼观测值的相关性,对正反交F2代单株果实的光泽度进行了调查和测定。结果表明,2016年春季正交F2代169个单株、反交F2代178个单株和2017年春季种植正交F2代304个单株的番茄果实G值和肉眼分级值均存在极显著相关性,相关系数(r)分别为0.761**、0.826**和0.679**。2016年春季正反交F2代347个单株和2年正交F2代473个单株的番茄果实G值和肉眼分级值呈极显著相关性,r值分别为0.792**和0.705**。对于本试验F2代的所有单株(651株)来说,G值和肉眼分级值的r值为0.736**。
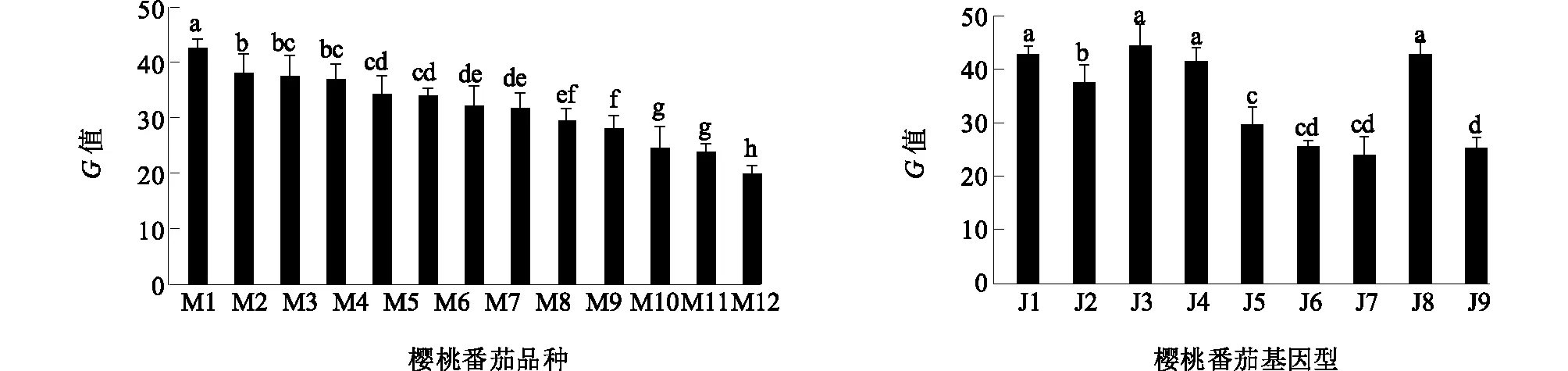
M1~M12为市场上樱桃番茄品种,J1~J9为本课题组的樱桃番茄高代自交系。图2 不同樱桃番茄材料果实G值的差异Fig.2 Difference of G value of cherry tomato cultivars and inbred lines
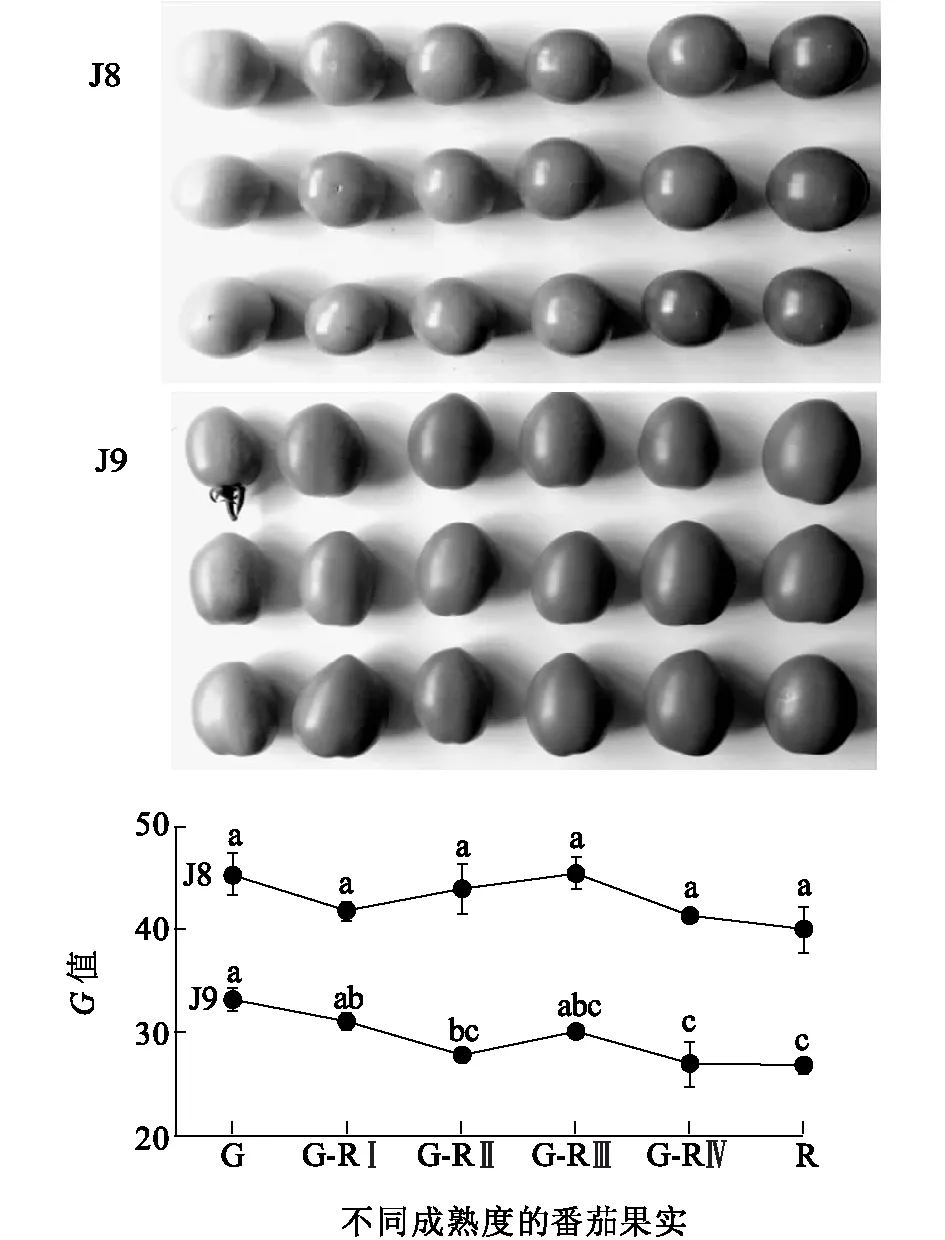
G表示果实为绿色,G-RⅠ~G-RⅣ表示果实从绿色向红色转变,R表示果实为红色。同一自交系内不同字母表示差异达到显著水平(P<0.05)。图3 6个不同成熟度的樱桃番茄J8和J9果实G值及照片比较Fig.3 The G value and photos of cherry tomato J8 and J9 fruits at different mature degrees
2016年春季正交F2代169个单株中,果实G≤22.0的单株6个,果实G为22.1~24.0的单株7个,果实G为38.1~40.0的单株4个,果实G为40.1~42.0的单株1个,果实G大于42.0的单株4个(图4)。2016年反交F2代178个单株中,果实G≤22.0的单株4个,果实G为22.1~24.0的单株10个,果实G为40.1~42.0的单株2个(图4)。由于正交F2代单株中高光泽度的果实数目较多,因此,2017年春季增加正交F2代的种植数量。在2017年春季正交F2代304个单株中,果实G≤22.0的单株6个,果实G为22.1~24.0的单株5个,果实G为38.1~40.0的单株11个,果实G为40.1~42.1的单株6个,果实G>42.0的单株1个(图4)。此外,F1单株果实的G值均在30.1至32.0之间,P1的G值在40.1至42.0之间,P2的G值在24.1至26.0之间(图4)。

a:≤22.0;b:22.1~24.0;c:24.1~26.0;d:26.1~28.0;e:28.1~30.0;f:30.1~32.0;g:32.1~34.0;h:34.1~36.0;i:36.1~38.0;j:38.1~40.0;k:40.1~42.0;l:>42.0。箭头表示F1、P1和P2的G值所在的范围。A:2016年正交F2群体;B:2016年反交F2群体;C:2017年正交F2群体。图4 樱桃番茄F2群体单株果实表面光泽度Fig.4 Glossiness of fruits from the plants of cherry tomato F2 population
3 讨 论
樱桃番茄果实有无光泽属于感官品质性状,是重要的农艺性状之一,与番茄的经济价值密切相关。根据光泽的有无或高低可以将番茄果实分为不同类别,如高光泽、低光泽甚至无光泽。高光泽的番茄具有光鲜油亮的外表,能够更好地吸引消费者,具有较好的商品性。因此,建立樱桃番茄果实光泽测定方法有利于番茄的高品质育种,可以提高番茄的商品价值。而且,番茄是研究果实发育的模式作物,具有稳定的遗传转化体系[12-13]。因此,研究番茄果实光泽性状可以为光泽分子标记辅助育种体系的建立和果皮光泽形成的遗传机理研究奠定基础。本研究首次结合颜色参数G值建立了一种快速准确地测定樱桃番茄光泽度的方法,并利用该方法筛选得到高光泽和低光泽的樱桃番茄材料,构建了F2群体,筛选获得具有极端光泽度的F2代单株。
对于果实光泽度的评价,肉眼观察的方法误差大,不适于大规模应用。周冰钰等[9]利用光泽度仪评价黄瓜表面光泽度的方法对果实具有破坏性,也不适于大规模应用。潘磊庆等[10]利用图像处理识别系统划分苹果光泽度等级的方法要求具备图像拍摄和处理系统,技术要求高,操作复杂。目前,相关基础研究和市场应用中均急需一种准确快速且非破坏地测定樱桃番茄果实表面光泽度的方法。颜色参数L*代表明亮度,L*值越大表示所测样品的表面越亮[14]。刘德春等发现L*值对脐橙果皮光泽度的评价结果与肉眼观测结果一致[1]。然而,本研究中,樱桃番茄果实表面L*值与肉眼评价的光泽度呈显著负相关,因此,L*值不适于樱桃番茄果实光泽度的评价。本研究首次利用G值(即8°角光泽度)这个颜色参数来评价樱桃番茄果实的光泽度,76个樱桃番茄果实的G值与肉眼光泽度分级值呈极显著正相关,说明G值可以作为樱桃番茄果实光泽度评价的有效指标。
在测定樱桃番茄果实光泽度时,外界压力会对G值造成较大影响。因此,在测定过程中,为了减轻外界压力的影响,应该将待测樱桃番茄自然放置在仪器测量口处。光照条件不会影响G值测定结果,因此,无需考虑测定环境的光照条件。在测定不同品种番茄果实G值时,无需考虑果序的差异,选取相同成熟度的果实,每个果实沿赤道面取5个点测定即可,这是由于同一植株不同果序相同成熟度的果实之间G值无显著差异。樱桃番茄采摘后1 d、2 d和4 d与采摘当天测定的G值呈极显著正相关,但采摘后1 d的相关性最大。因此,为了更准确地评价樱桃番茄果实的光泽度,应在采摘后尽早完成果实表面光泽度的测定。总之,在测定樱桃番茄光泽度时,首先采收植株上具有代表性的成熟度一致的果实,剔除裂果,打开分光测色计CM-700D,零位校准和空白校准后,取干净果实自然置于测量口,使果实表面覆盖住测量口,不留肉眼可见的缝隙,不施加外界压力,每个果实随机取赤道面5个点进行G值测定,每个品种至少选取3个果实。
大多数重要农艺性状受到多个基因、环境及环境与基因互作的影响,这些性状的遗传机制往往复杂[15],如番茄的光泽度性状。确定数量性状位点(Quantitative trait loci, QTL),对于该性状的标记开发和遗传分析具有重要意义[16]。传统的QTL定位方法需要对目标性状的所有个体进行基因型和表型鉴定,费用成本高且效率低[17]。群体分组分析(Bulked segregant analysis,BSA)可以实现目标基因的快速定位以及与目标性状紧密连锁的分子标记的开发[18]。为了构建极端混池,为BSA测序分析做准备,本研究利用市场上樱桃番茄品种和本课题组的樱桃番茄材料,用上述快速准确测定樱桃番茄光泽度的方法,选取了具有高光泽度(J8,G= 42.7)和低光泽度(J9,G= 25.3)的高代自交系番茄材料作为亲本。2016年春季,对正反交F2代单株果实的光泽度进行了肉眼观察评价和G值测定,发现反交群体中高光泽度单株较少,因此,本研究选取正交F2群体作进一步研究。扩大群体可以增加BSA测序结果的准确性。黄瓜果实的光泽度不仅受自身基因的控制,还受外在环境条件的影响[19]。Petit等也发现番茄果实的光泽度对环境条件(比如季节)比较敏感[8]。因此,为了降低季节因素对果实光泽度的影响,我们未在秋季进行试验,而是在2017年春季种植304个正交F2群体,获得高光泽度和低光泽度的单株分别有18个和11个。结合2016年和2017年春季正交F2代单株果实G值测定结果,共选择了27个高光泽度和24个低光泽度单株进行极端混池,用于后续BSA测序。由于部分单株可能同时含有高光泽度和低光泽度的果实[8],这会影响测序结果的准确性和分子标记的开发。因此,我们在选择具有极端性状的F2代单株时已剔除这样的单株。本研究为樱桃番茄果实光泽度表型指标的测定、评价和材料筛选提供了快速有效的方法,这将为樱桃番茄果实光泽度分子标记辅助育种体系的建立,果皮光泽形成的遗传机理和光泽度基因调控研究奠定基础,有利于加快高品质樱桃番茄育种进程。
参考文献:
[1] 刘德春,曾 琼,刘 勇,等. ‘纽荷尔’脐橙及其光泽型突变体果皮色差指数变化规律的研究[J]. 果树学报,2013,30(6):914-917.
[2] 王伟杰,徐建国,徐昌杰. 宫内伊予柑果实发育期间色泽和色素的变化[J]. 园艺学报,2006,33(3):461-465.
[3] 周 蓉,蒋芳玲,梁 梅,等. 用色差仪法定量分析番茄果实番茄红素的含量[J]. 江西农业学报,2012,24(9):45-48.
[4] GOMEZ R, COSTA J, AMO M, et al. Physicochemical and colorimetric evaluation of local varieties of tomato grown in SE Spain[J]. Journal of the Science of Food and Agriculture, 2001, 81(11): 1101-1105.
[5] LOPEZ C A F, GOMEZ P A. Comparison of color indexes for tomato ripening[J]. Horticultura Brasileira, 2004, 22(3): 534-537.
[6] 王孝宣. 增强番茄果实颜色基因的精细定位及相关基因的差异表达[D]. 北京:中国农业科学研究院,2004.
[7] 赵润洲,刘鸣韬. 番茄果实色泽与色素组成的关系[J]. 河南农业科学,2011,40(9):98-100.
[8] PETIT J, BRES C, JUST D, et al. Analyses of tomato fruit brightness mutants uncover both cutin-deficient and cutin-abundant mutants and a new hypomorphic allele of GDSL lipase[J]. Plant Physiology, 2014, 164(2): 888-906.
[9] 周冰钰,秦智伟,周秀艳,等. 黄瓜种质资源果皮表面光泽性评价[J]. 中国蔬菜,2013,1(11):27-31.
[10] 潘磊庆,孙 柯,屠 康,等. 一种苹果表面光泽度检测方法: CN105699397A[P]. 2016-06-22.
[11] 许向阳,赵婷婷,李景富. 番茄抗叶霉病基因Cf12的分子标记及种质资源筛选[J]. 园艺学报,2011,38(S):2568.
[12] ADATO A, MANDEL T, MINTZ-ORON S, et al. Fruit-surface flavonoid accumulation in tomato is controlled by a SlMYB12-regulated transcriptional network[J]. Plos Genet, 2009, 5: e1000777.
[13] RUIZMAY E, HUCKO S, HOWE K J, et al. A comparative study of lectin affinity based plant n-glycoproteome profiling using tomato fruit as a model[J]. Molecular and Cellular Proteomics, 2014, 13(2): 566-579.
[14] 王利群,戴雄泽. 色差计在辣椒果实色泽变化检测中的应用[J]. 辣椒杂志,2009,7(3):23-26.
[15] SEMAGN K, BEYENE Y, WARBURTON M L, et al. Meta-analyses of QTL for grain yield and anthesis silking interval in 18 maize populations evaluated under water-stressed and well-watered environments[J]. BMC Genomics, 2013, 14(1): 313.
[16] HOLLAND J B. Genetic architecture of complex traits in plants[J]. Current Opinion in Plant Biology, 2007, 10(2): 156-161.
[17] COLLARD B C, MACKILL D J. Marker-assisted selection: an approach for precision plant breeding in the twenty-first century[J]. Philosophical Transactions of the Royal Society of London Series B-biological Sciences, 2008, 363(1491): 557-572.
[18] SUN Y, WANG J, JONATHANH C, et al. Efficiency of selective genotyping for genetic analysis of complex traits and potential applications in crop improvement[J]. Molecular Breeding, 2010, 26(3): 493-511.
[19] 杨绪勤. 黄瓜果瘤和果实无光泽性状基因的定位与功能分析[D]. 上海:上海交通大学,2014.

