猪脂肪沉积和胚胎附植期FTO基因的表达及碱基突变检测
付言峰, 李 兰, Robert V. Knox, 李碧侠, 方晓敏, 任守文
(1.江苏省农业科学院畜牧研究所/动物品种改良和繁育重点实验室/江苏省农业种质资源保护与利用平台, 江苏 南京 210014; 2.江苏省农业科学院动物免疫工程研究所, 江苏 南京 100193; 3.美国伊利诺伊大学, 伊利诺伊 厄巴纳-香槟 61801)
近些年来,随着人们对猪肉品质的要求越来越高,肉质性状也越来越被养猪企业所关注[1-2],而影响猪肉质性状(眼肌面积、背膘后、瘦肉率、肌间脂肪含量 等)的一个关键因素是脂肪沉积[3],脂肪沉积非常复杂,每一种类型的脂肪沉积都对应一种不同的沉积过程[4-5]。另外,猪产仔数是一个重要的繁殖性状和经济性状[6],而影响猪产仔数的一个关键因素是胚胎附植[7],因为很多胚胎在这个过程中死亡[8],而这些胚胎的死亡是导致产仔数下降的一个重要原因[9-11]。此外,猪作为一个良好的新型模式动物,在研究人类疾病(如肥胖和流产)的过程中也发挥着重要的作用[12]。
作为一个同时影响猪肉质性状和繁殖性状的基因,脂肪肥胖相关基因 (FTO)于2007年被发现与肥胖相关[13],在人类和小鼠上的研究结果表明该基因在控制食欲和能量消耗方面具有重要作用[14-15]。FTO基因可以通过调控脂肪细胞成脂功能,从而调节人类肥胖的发生[16]。国外对猪FTO基因的遗传变异与其肌内脂肪、肌间脂肪的沉积、大理石评分、滴水损失及瘦肉率等猪肉品质的关系研究已有零星报道[17],国内对猪FTO基因的遗传变异在不同品种猪群中的多态性分布也有一些报道[18]。
除了影响脂肪代谢以外,FTO还影响机体的繁殖性能[19]。人和大鼠中的研究结果表明,胎盘组织中的FTO基因在子宫内环境与胎儿生长发育之间发挥了桥梁作用[20];在小鼠中,原位杂交和Real-time qPCR结果表明,FTO在胚胎组织中表达量很高[12];在山羊中,研究发现妊娠第110 d时,胎盘组织中的FTO表达与胎儿体质量有很强的相关性[21];在荷斯坦牛中,FTO多态性影响乳脂量[22]。
鉴于FTO在脂肪代谢和繁殖过程中的生物学功能,本研究采用Real-time qPCR方法分析了FTO在脂肪沉积过程中的苏山猪组织样中的表达,FTO在胚胎附植过程中的梅山猪组织样中的表达,克隆测序了苏山猪FTO基因的全长编码序列(CDS),并推测了编码序列上SNPs突变所引发的氨基酸变化。这些结果将有助于人们进一步了解FTO的功能。
1 材料与方法
1.1 试验动物
脂肪沉积研究所用试验动物来自江苏洪泽鑫象猪业有限公司,选用10头体质量达(95±2) kg、6月龄的半同胞健康苏山猪,分成2组,即:5头高脂猪(活体测定背膘厚度最高的前5头猪)和5头低脂猪(活体测定背膘厚度最低的后5头猪),这些试验猪在同一猪场进行统一的饲喂和管理,同时在自由采食及饮水条件下,进行疾病防治和行为体况观察。将供试猪电昏后在同一天快速屠宰,然后用无RNase的手术器械参照屠宰程序[23]采集苏山猪的16种组织样(背膘、背最长肌、心、肝、脾、肺、胃、大肠、小肠、肾、膀胱、卵巢、输卵管、子宫体、子宫颈和子宫内膜)。上述组织样采集后,立即用液氮冷冻保存,用于后续的RNA提取。
胚胎附植研究的试验动物来自于江苏农林职业技术学院梅山猪保种场,以3头梅山猪母猪(第5胎次~第7胎次)为研究对象,按猪场常规条件进行饲喂和管理,同时在自由采食及饮水条件下,进行疾病防治和行为体况观察。在同场、相同管理条件下进行单圈饲养,进行同期发情处理,相同种公猪精液授精妊娠。以最后一次配种为0 d计,在配种第18 d(附植中期)进行屠宰,采集全身20种组织样(子宫体、胚胎、子宫内膜附着点、子宫内膜非附着点、卵巢、子宫角、大脑、下丘脑、垂体、脊髓、心、肝、脾、肺、胃、大肠、小肠、肾上腺、肾和膀胱)。 样品采集后,立即用液氮保存。
1.2 主要试剂与仪器
主要试剂有TRIzol (Invitrogen, America)、AMV First Strand cDNA Synthesis Kit (BBI, Canada)、SybrGreen PCR Master Mix 2X (ABI, America)、琼脂糖 (Biowest, Spain)、DEPC (KeyGen, China)、PremixTaq(TaKaRa, Japan),1×TAE等缓冲液为自配,其他常规试剂为南京化学试剂有限公司生产。
荧光定量PCR检测系统(ABI, America)、凝胶成像仪 (Tanon 3500, China)、紫外分光光度仪(Shimadzu,Japan) 、超纯水仪(Millipore, USA)、自动灭菌锅(博讯 YXQ-LS-50A, China) 、高速冷冻离心机(Eppendorf, Germany)。
1.3 引物设计
猪FTO(GenBank: NM_001112692)和GAPDH(持家基因)的Real-time quantitative PCR引物均由Primer Premier 5.0软件设计,其中FTO_fat deposition引物用于脂肪沉积的研究,FTO_embryo implantation引物用于胚胎附植的研究。引物(表1)由上海英潍捷基(Invitrogen)生物公司合成。

表1 猪FTO基因实时荧光定量PCR分析用引物序列及反应条件
1.4 RNA提取与反转录成cDNA
总RNA用TRIzol/氯仿方法[24]从猪组织样品中提取,之后用超微量紫外分光光度计 (Thermo NANODROP 2000 Spectrophotometer, 美国) 检测提取RNA浓度,再用1.5%的琼脂糖电泳检测RNA完整性。
RT-PCR中的RT(反转录),使用总RNA为模板合成cDNA第一链,采用“AMV First Strand cDNA Synthesis Kit”试剂盒,21 μl反转录反应体系,分两步进行, (1)Total RNA 5 μl, Rnase-free ddH2O 5 μl,随机引物(10 pmol/μl)各1 μl,70 ℃温浴5 min。(2) 冰浴10 s,离心加入下列试剂:5×Reaction Buffer 4 μl, dNTP Mix (10 mmol/L) 2 μl, Rnase inhibitor (20 U/μl) 1 μl, AMV Reverse Transcriptase (10 U/μl) 2 μl。(3) 37 ℃温浴5 min,42 ℃温浴60 min,70 ℃温浴10 min。终止反应。-20 ℃保存。
1.5 实时荧光定量PCR
为了保证样品的可靠性,对反转录生成的cDNA先进行预试验。为减少干扰,每个cDNA样本都稀释10倍 (5 μl cDNA + 45 μl H2O),每个样品做3个重复,并用ddH2O 代替cDNA 模板做阴性对照,以检测是否有外源DNA污染。
以cDNA为模板,分别定量PCR扩增基因目的片段,20 μl PCR反应体系如下:SybrGreen qPCR Master Mix (2X) 10.0 μl, 上下游引物(10 μmol/L)各1.0 μl,模板(cDNA稀释10倍) 1.0 μl,TaqDNA Polymerase 0.3 μl, 加Rnase-free ddH2O到 20.0 μl。反应程序如下:95 ℃ 2 min 热启动HotStarTaq酶活性;95 ℃溶解10 s,60 ℃煺火/延伸 40 s,循环40次;45~95 ℃,读板时0.1 ℃/s进行溶解曲线分析。
1.6 数据统计
实时荧光定量PCR的数据利用2-△△Ct法分析,得到FTO的mRNA 相对表达量,内参基因为GAPDH[25-26]。不同组织间mRNA表达量的差异性显著水平通过SAS 8.2 统计软件包进行GLM分析,结果以最小二乘均值±标准差表示。
2 结果与分析
2.1 RNA提取结果
组织样中提取的总RNA利用分光光度计测定出的OD260/OD280结果大都处于1.8~2.1,表明提取的RNA浓度和质量都较高。随机选取8种组织样提取的总RNA,进行琼脂糖电泳检测,结果显示总RNA在凝胶上显示出2条清晰的条带,分别为28 S和18 S rRNA,且同一组织样的2条带的灰度值比值(28 S/18 S)大都处于1.0~1.5,表明总RNA基本完整,可以满足后续的反转录和Real-time PCR试验的要求(图1)。
2.2 FTO在猪脂肪沉积过程中的mRNA表达
半定量PCR结果表明,FTO的mRNA在苏山猪的11种组织样中均有表达,其mRNA相对表达量(两条带灰度值比值FTO/GAPDH)由大到小排序为:卵巢(0.91)、 肺(0.89)、输卵管(0.86)、 子宫内膜 (0.83)、大肠(0.66)、子宫体(0.65)、 子宫颈 (0.64)、脾(0.57)、 膀胱(0.50)、胃(0.42)和小肠(0.04)。其中,卵巢、输卵管、子宫内膜等繁殖组织样中的表达量高于其他组织样 (图2)。
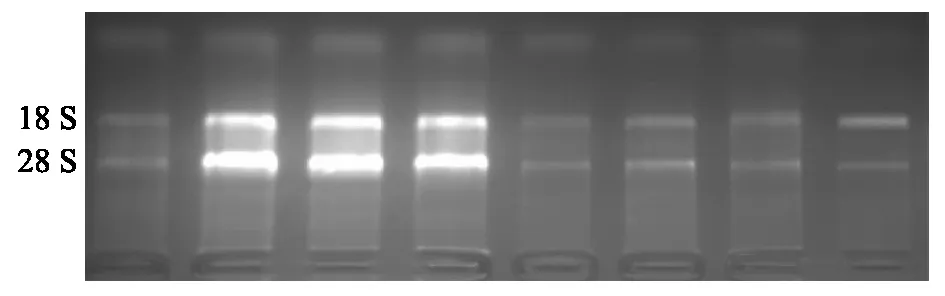
从左至右依次为:脊髓、大脑、小肠、大肠、膀胱、心、背最长肌和脾脏。图1 不同组织样提取的总RNA的1.5%琼脂糖凝胶电泳检测结果Fig.1 Results of 1.5% agarose gel electrophoresis for total RNA extracted from different swine tissues

图2 FTO基因在苏山猪不同组织中的mRNA表达量Fig.2 The mRNA expression level of FTO in different tissues of Sushan pigs
定量PCR(Real-time qPCR)结果表明,FTO的mRNA在苏山猪的另外5种组织样中也均有表达,包括:背膘、心、肾、背最长肌和肝。按照mRNA表达量由大到小排序,低脂猪为:背膘(9.44)、心脏 (1.00)、肾脏 (0.92)、肝脏 (0.20)、背最长肌 (0.08);高脂猪为:背膘 (10.59)、心脏 (0.85)、背最长肌 (0.81)、肝脏 (0.58)、肾脏 (0.51)。对2种脂肪类型猪综合分析,背膘中的mRNA表达量最高,且极显著高于其他任何组织(P< 0.01);背最长肌中的mRNA表达量,高脂猪显著大于低脂猪(P<0.05)(图3)。FTO的表达量越高,脂肪含量越高,眼肌面积和瘦肉率越低(表2),FTO的高表达似乎促进猪的脂肪沉积。

不同小写字母表示差异显著(P<0.05)。图3 FTO基因在苏山猪不同组织样中的定量PCR结果Fig.3 Quantitative PCR results of FTO in different tissues of Sushan pigs
2.3 FTO在猪胚胎附植过程中的mRNA表达
Real-time quantitative PCR结果显示,胚胎附植中期 (妊娠第18 d),在梅山猪15种组织样中均检测到FTO基因的mRNA表达,按表达量从高到低,依次为:子宫体、胚胎、下丘脑、子宫内膜附植点、子宫内膜非附植点、卵巢、子宫角、大脑、膀胱、脊髓、肾上腺、脾、垂体、背膘和心。在这些组织样中,子宫体、胚胎、子宫内膜附植点、非附植点和卵巢等繁殖组织样中mRNA的表达量显著高于其他组织样(下丘脑除外) (P<0.05),这说明胚胎附植期繁殖组织样是FTO的主要靶组织。
另外,FTO在下丘脑组织中的表达量排名第三,在垂体中也有较高的表达量 (图4),表明,FTOmRNA的表达在胚胎附植调控中发挥一定作用,调控途径很可能是下丘脑-垂体-性腺轴。另外,FTO在猪脂肪沉积过程和胚胎附植过程中所展现出的不同的表达趋势,表明其作用广泛,在机体生长发育、妊娠维持等方面均发挥着重要作用。
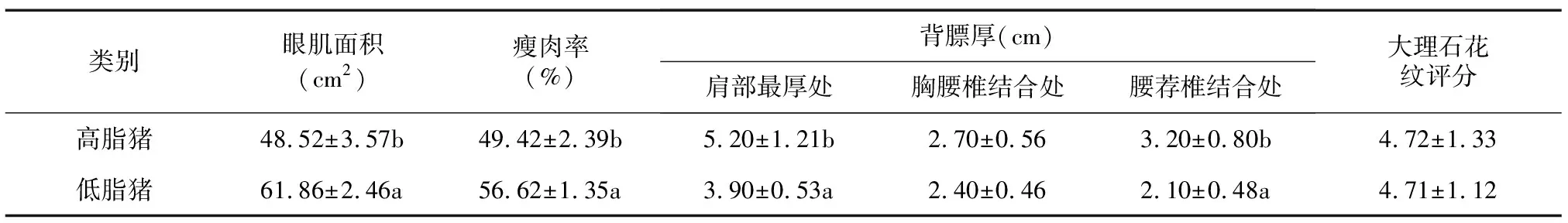
表2 用于FTO表达研究的苏山猪的脂肪沉积相关肉质性状
同一列数据后不同小写字母表示差异显著 (P<0.05)。

图4 胚胎附植期FTO基因在梅山猪不同组织样中的mRNA表达Fig.4 The mRNA expression of FTO in different tissues of Meishan pigs during embryo implantation
2.4 FTO的单核苷酸突变(cSNPs)及引起的氨基酸突变
本研究使用克隆测序法,在51头苏山猪群中检测了FTO编码序列(即CDS区,范围:15~1 532 bp)上的单核苷酸突变(cSNPs),并对这些突变引起的氨基酸水平的突变进行了分析。结果表明,苏山猪FTO编码序列(GenBank: JX873956)上共发现10个cSNPs,依次为:G52A(FTOcDNA序列第52位的G→A突变)、A227G、C523T、C608G、G628A、A655G、A810G、A886G、G1002A和A1344G。这10个cSNPs分布于第1、第3、第4、第6、第8外显子上,其中有8个突变引起了所编码氨基酸的变化(表3)。
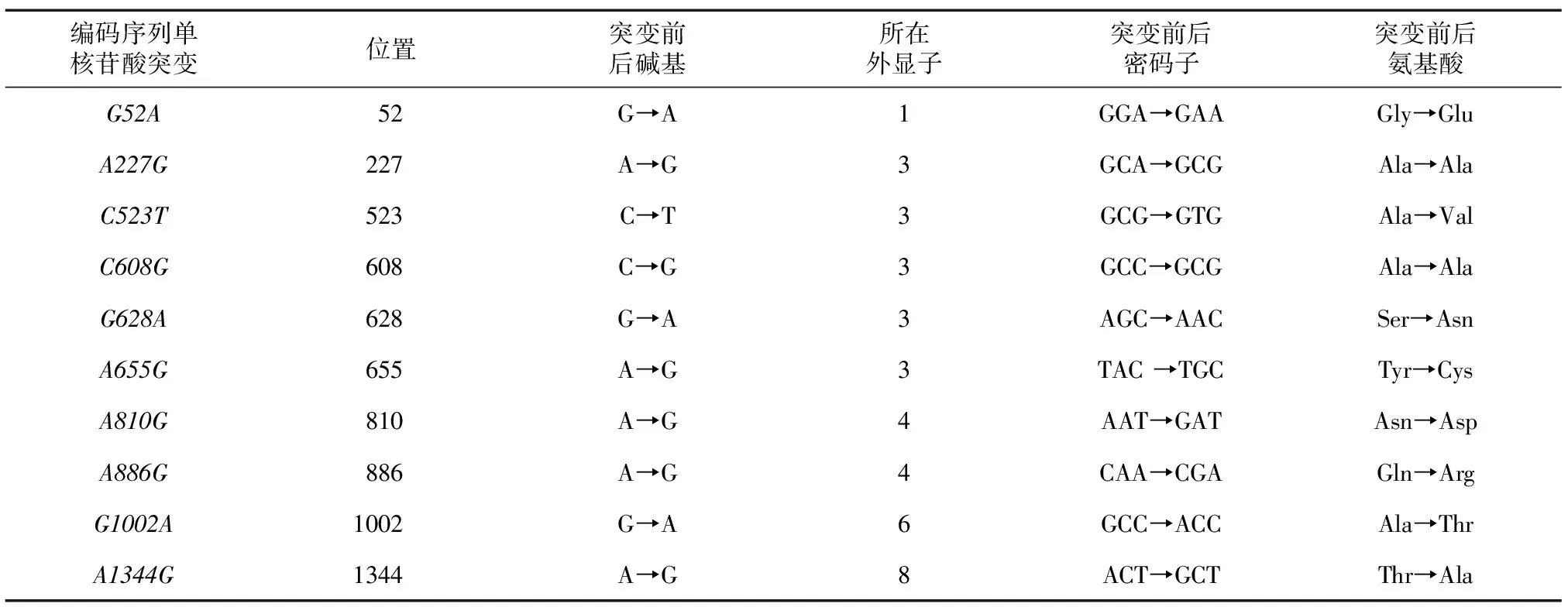
表3 苏山猪群中检测到的FTO基因cSNPs及其引起的氨基酸突变
2.5 FTO第3外显子cSNPs的基因和基因型频率
通过直接测序法,本研究检测了51头苏山猪群中的FTO第3外显子中的4个cSNPs (A227G、C523T、C608G和G628A)。结果(表4)表明,在A227G和G628A位点均检测到3种基因型,而在C523T和C608G位点均只检测到2种基因型。卡方 (χ2)检验结果表明,A227G、C523T和G628A位点的基因和基因型频率均处于哈代-温伯格平衡分布,而C608G位点则处于哈代-温伯格不平衡分布 (P<0.01)。
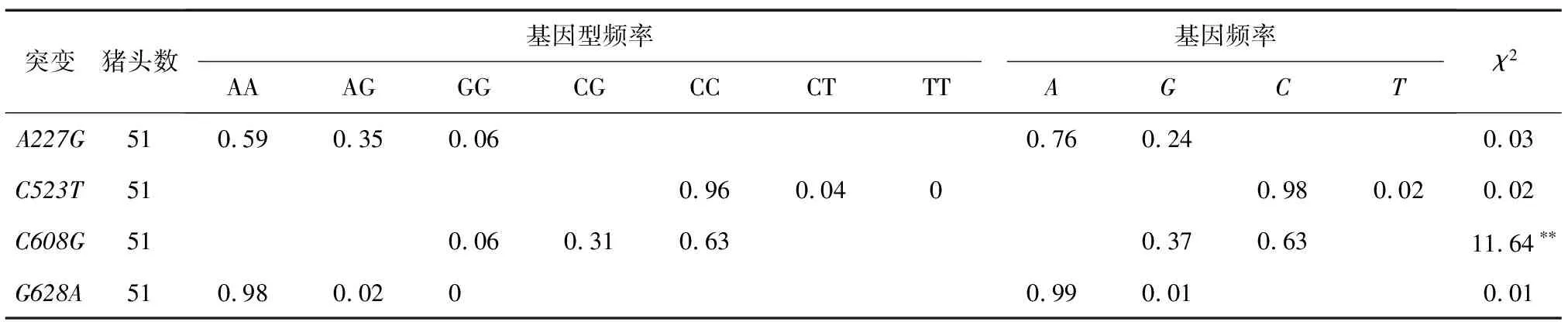
表4 苏山猪群中检测到的FTO基因cSNPs位点的基因频率和基因型频率
χ2(df=2)0.01=9.21,χ2(df=2)0.05=5.99;**表示差异极显著(P<0.01)。
3 讨 论
脂肪沉积可以影响猪背膘厚、背最长肌橫截面积、瘦肉率等肉质性状[3]。胚胎附植可以影响猪窝产仔数、终生产仔数、母猪利用年限等繁殖性状[27-28]。随着定位克隆、物理作图和候选基因等分子生物学技术的发展,研究人员已成功发现一些同时影响猪脂肪性状和繁殖性状的候选基因,如过氧化物酶体增殖物活化受体基因 (PPAR)[29-30]、瘦素受体基因 (LEPR)[31-32]和组蛋白去乙酰化酶基因(SIRT1)[33-34]等。
FTO在猪脂肪沉积过程中的mRNA表达结果表明,苏山猪16种组织样中均检测到FTO的mRNA表达,且背膘中的表达量最高,并极显著高于其他任何组织(P<0.01),说明FTO作用广泛,且主要在易脂肪沉积的组织中发挥作用;在背最长肌中的mRNA表达量,高脂猪显著大于低脂猪(P<0.05),说明FTO基因的高表达量与猪脂肪沉积量呈正相关,即FTO的高表达有利于脂肪沉积。在德国哥廷根小型猪中,研究者发现脂肪沉积时期,其肌肉、大脑、肝、肾和心脏中均表达FTO的mRNA,且组织间表达量差异显著 (P<0.05)[12]。在苏格兰黑脸绵羊中,肥胖羊相较于普通羊,有更高的FTOmRNA表达量[35]。在蛋鸡中,4~8周龄的快速生长期,垂体、下丘脑、肌肉、脂肪、睾丸等组织样中均检测到FTO的mRNA表达[36]。
FTO在猪胚胎附植过程中的mRNA表达结果表明,胚胎附植中期梅山猪15种组织样中均检测到FTO基因的mRNA表达,且繁殖组织中的表达量显著高于其他组织(下丘脑除外)(P<0.05),也显著高于空怀猪。另外FTO在下丘脑中的表达量排名第三位,在垂体中也有表达,这说明FTO很可能通过下丘脑-垂体-性腺轴在猪胚胎附植调控中发挥着重要的作用。Bassols等发现,人的子宫组织中FTO的mRNA表达量显著高于其他组织,且FTO在子宫中的高表达量与不断增加的胎儿体质量和长度显著相关[37]。在大鼠中,妊娠时期肥胖的母鼠生下的断奶仔鼠,在下丘脑和肝脏中均检测到更高的FTOmRNA表达量[38]。 在大鼠和人中,胎盘组织中FTO的表达说明其可能是子宫内环境和胎儿生长之间相互联系的桥梁[20]。
FTO的cSNPs及引起的氨基酸突变分析结果表明,苏山猪FTO编码序列(15~1 532 bp)上共发现10个cSNPs突变,其中有8个直接引起了编码氨基酸的变化,这些突变可能会进一步引发基因功能的变化[39];另外2个cSNPs也可能通过连锁不平衡与直接影响繁殖性状的位点相作用,从而间接影响到氨基酸直至蛋白质的变化[40-41]。FTO第3外显子中的4个cSNPs在苏山猪群中均检测到2种以上的基因型,说明其可在苏山猪、金华猪[18]等某些特定猪群中作为影响猪肉质和繁殖性状的候选基因。
综上所述,猪FTO是一个动态表达的基因,作用广泛,脂肪沉积时期主要在脂肪组织中表达,胚胎附植时期主要在子宫、胚胎等繁殖组织中表达,在这2个机体活动中都发挥着重要的作用。在苏山猪群编码序列中发现的8个直接引起编码氨基酸变化的cSNPs会在分子标记选择辅助育种中发挥重要作用。
参考文献:
[1] 付言峰,李 兰,周艳红,等. 瘦素受体对苏钟猪脂肪沉积调控的影响 [J]. 南京农业大学学报,2015, 38(6):986-992.
[2] VAN WIJK H, DIBBITS B, BARON E, et al. Identification of quantitative trait loci for carcass composition and pork quality traits in a commercial finishing cross [J]. J Anim Sci,2006, 84(4):789-799.
[3] WOOD J, ENSER M, FISHER A, et al. Fat deposition, fatty acid composition and meat quality: a review [J]. Meat Science,2008, 78(4):343-358.
[4] HAUSMAN G, POULOS S. Recruitment and differentiation of intramuscular preadipocytes in stromal-vascular cell cultures derived from neonatal pig semitendinosus muscles [J]. J Anim Sci,2004, 82(2):429-437.
[5] 付言峰,李 兰,王学敏,等. 苏钟猪FTO基因的mRNA表达、克隆测序及其生物信息学分析 [J]. 华北农学报, 2013, 28(1):128-134.
[6] FU Y, LI L, LI B, et al. Long form leptin receptor and SNP effect on reproductive traits during embryo attachment in Suzhong sows [J]. Animal Reproduction Science, 2016, 168(2):57-65.
[7] LIM W, BAE H, BAZER F W, et al. Functional roles of eph A-ephrin A1 system in endometrial luminal epithelial cells during early pregnancy [J]. Journal of Cellular Physiology,2016, 232(6):1527-1538.
[8] CARDENAS H, POPE W. Increased ovulation rate in gilts treated with dihydrotestosterone [J]. Reproduction,2002, 123(4):527-533.
[9] GEISERT R, SCHMITT R. Early embryonic survival in the pig: Can it be improved [J]. Journal of Animal Science,2002, 80(1):54-65.
[10] FU Y, FU J, YANG L, et al. Expression of Eph-Ephrin a molecules in endometrium during swine embryo implantation examined using Real-Time RT-PCR [J]. Agricultural Sciences in China,2011, 10(9):1445-1451.
[11] LIN H, WANG H, WANG Y, et al. Transcriptomic analysis of the porcine endometrium during embryo implantation[J]. Genes,2015, 6 (4):1330-1346.
[12] MADSEN M B, BIRCK M M, FREDHOLM M, et al. Expression studies of the obesity candidate geneFTOin pig [J]. Anim Biotechnol,2009, 21 (1):51-63.
[13] FRAYLING T M, TIMPSON N J, WEEDON M N, et al. A common variant in theFTOgene is associated with body mass index and predisposes to childhood and adult obesity [J]. Science,2007, 316 (5826):889-894.
[14] FISCHER J, KOCH L, EMMERLING C, et al. Inactivation of theFtogene protects from obesity [J]. Nature,2009, 458 (7240):894-898.
[15] KLÖTING N, SCHLEINITZ D, RUSCHKE K, et al. Inverse relationship between obesity andFTOgene expression in visceral adipose tissue in humans [J]. Diabetologia,2008, 51 (4):641-647.
[16] LIU Y, LIU Z, SONG Y, et al. Meta-analysis added power to identify variants inFTOassociated with type 2 diabetes and obesity in the Asian population [J]. Obesity,2010, 18 (8):1619-1624.
[17] FAN B, DU Z Q, ROTHSCHILD M F. The fat mass and obesity-associated (FTO) gene is associated with intramuscular fat content and growth rate in the pig [J]. Anim Biotechnol,2009, 20 (2):58-70.
[18] 陶 新,邓 波,门小明,等. 不同猪种肉质相关基因Hal,RN和FTO的多态性研究 [J]. 畜牧兽医学报,2012, 43(5):676-683.
[19] BARTON S J, MOSQUERA M, CLEAL J K, et al. Relation ofFTOgene variants to fetal growth trajectories: findings from the southampton women′s survey [J]. Placenta,2016, 38(2):100-106.
[20] MAYEUR S, CISSE O, GABORY A, et al. Placental expression of the obesity-associated geneFTOis reduced by fetal growth restriction but not by macrosomia in rats and humans [J]. J Dev Orig Health Dis,2013, 4(2):1-5.
[21] SEBERT S, HYATT M, CHAN L, et al. Influence of prenatal nutrition and obesity on tissue specific fat mass and obesity-associated (FTO) gene expression [J]. Reproduction,2010, 139(1):265-274.
[22] ZIELKE L G, BORTFELDT R H, REISSMANN M. Impact of variation at theftolocus on milk fat yield in holstein dairy cattle [J]. PLoS One,2013, 8(5):e63406.
[23] FU Y, FU J, REN Q, et al. Expression of Eph A molecules during swine embryo implantation [J]. Molecular Biology Reports,2012, 39(3):2179-2185.
[24] SAMBROOK J, RUSSELL D W. Molecular cloning: a laboratory manual [M]. New York: Cold Spring Harbor Laboratory Press, 2001.
[25] LIVAK K, SCHMITTGEN T. Analysis of relative gene expression data using real-time quantitative PCR and the 2-[Delta][Delta] CT method [J]. Methods,2001, 25(4):402-408.
[26] SCHMITTGEN T, LIVAK K. Analyzing real-time PCR data by the comparative CT method [J]. Nature Protocols,2008, 3 (6):1101-1108.
[27] 马喜山,王爱国,傅金恋. 猪HB-EGF 基因多态性与产仔数的关联性分析 [J]. 中国农业科学,2009, 42 (1):274-282.
[28] 付言峰,王爱国,李 兰,等. 胚胎附植期Eph-Ephirn A基因家族在猪子宫内膜中的mRNA表达变化[J]. 江苏农业学报,2013, 29(1):93-100.
[29] MANDARD S, MÜLLER M, KERSTEN S. Peroxisome proliferator-activated receptor a target genes[J]. Cell Mol Life Sci,2004, 61(4):393-416.
[30] WANG G, KONG L, HU P, et al. Effect of polymorphism in the peroxisome proliferator-activated receptor gamma gene on litter size of pigs [J]. Molecular Biology Reports,2011, 38(3):1807-1812.
[31] 付言峰,方晓敏,李碧侠,等. 瘦素受体表达量在苏钟猪脂肪沉积调控中的作用 [J]. 中国兽医学报,2012, 32(9):1266-1271.
[32] LI Y, GENG J, WANG Y, et al. The role of leptin receptor gene polymorphisms in determining the susceptibility and prognosis of NSCLC in Chinese patients [J]. J Cancer Res Clin Oncol,2011, 138 (2):311-316.
[33] 李碧侠,赵 芳,付言峰,等. 猪卵巢颗粒细胞中SIRT1基因表达量与雌激素分泌的相关性 [J]. 江苏农业学报,2013, 29(3): 555-558.
[34] OH W K, CHO K B, HIEN T T, et al. Amurensin G, a potent natural SIRT1 inhibitor, rescues doxorubicin responsiveness via down-regulation of multidrug resistance [J]. Mol Pharmacol,2010, 78(5):855-864.
[35] SÉBERT S, HYATT M, CHAN L, et al. Influence of prenatal nutrition and obesity on tissue specific fat mass and obesity-associated (FTO) gene expression [J]. Reproduction,2010, 139(1):265-274.
[36] TIWARI A, KRZYSIK-WALKER S, RAMACHANDRAN R. Cloning and characterization of chicken fat mass and obesity associated (Fto) gene: fasting affects Fto expression [J]. Domest Anim Endocrinol,2012, 42(1):1-10.
[37] BASSOLS J, PRATS-PUIG A, VAZQUEZ-RUIZ M, et al. Placental FTO expression relates to fetal growth [J]. Int J Obes,2010, 34(9):1365-1370.
[38] CARUSO V, CHEN H, MORRIS M J. Early hypothalamic FTO overexpression in response to maternal obesity-potential contribution to postweaning hyperphagia [J]. PLoS One,2011, 6(9):e25261.
[39] CHEN X, WANG X, LI Z, et al. Molecular cloning, tissue expression and protein structure prediction of the porcine 3-hydroxy-3-methylglutaryl-coenzyme A reductaseHMGRgene [J]. Gene,2012, 495(2):170-177.
[40] NIU B, YE L, LI F, et al. Identification of polymorphism and association analysis with reproductive traits in the porcine RNF4 gene [J]. Animal Reproduction Science,2009, 110(4):283-292.
[41] FU Y, FU J, WANG A. Association of EphA4 polymorphism with swine reproductive traits and mRNA expression of EphA4 during embryo implantation [J]. Molecular Biology Reports,2012, 39(3):2689-2696.

