MaASR1基因通过乙烯途径提高拟南芥抗旱性的作用机制
张丽丽, 徐碧玉, 刘菊华, 贾彩红, 张建斌, 金志强,2
(1.中国热带农业科学院热带生物技术研究所/农业部热带作物生物学与遗传资源利用重点实验室,海南 海口 571101; 2.中国热带农业科学院海口实验站/海南省香蕉遗传育种改良重点实验室,海南 海口 570102)
环境的非生物胁迫,如干旱,极端温度,寒冷,重金属,或高盐,严重损害植物生长和生产力。干旱是最严重的环境胁迫,超过任何其他环境因素,严重损害植物的生长和发育,限制植物生产和作物的性能[1]。植物激素,如脱落酸(ABA)、乙烯(ET)、水杨酸(SA)和茉莉酸(JA)对植物的生长和发育有广泛的影响,它们调节植物抵御生物和非生物胁迫的保护性应答[2-6]。不同的非生物胁迫和生物胁迫,经常通过共享或重叠激素信号转导通路来引发植物响应[7-8]。
乙烯在试验中被证明可以关闭气孔[9],环境诱导乙烯积累可以导致气孔关闭也已经被报道[10]。乙烯应答因子ERF类蛋白在植物生长发育尤其是在植物应对非生物胁迫中起着非常重要的作用[11-12]。在早期的研究中发现来自番茄的乙烯应答因子蛋白JERF3 通过调节氧化胁迫应答来增强转基因烟草对干旱、盐和冷害的耐受力[13]。JERF1和JERF3基因在转基因水稻中的过量表达会引起一系列生理和分子的变化,从而增强水稻对干旱和氧化胁迫的耐受力[14]。植物对环境胁迫的适应依赖于参与胁迫感知、信号转导、及特定胁迫和代谢相关基因表达的分子网络的激活[15]。研究结果表明番茄SlERF5在拟南芥对生物和非生物胁迫的转录调控中发挥着重要作用[16]。SlERF5基因在番茄中的过量表达会增强番茄对干旱和高盐胁迫的耐受力[17]。油菜乙烯应答因子BrERF4在拟南芥中的过量表达可以增强拟南芥对干旱和盐的耐受力[18]。拟南芥ERF022可以通过乙烯途径调节体细胞胚胎发生的诱导[19],拟南芥ERF1通过结合不同的顺式作用元件来调节非生物胁迫应答基因的表达[20]。OsEF109可以显著提高水稻对干旱胁迫的耐受性[21],OsERF3的过表达改变了对乙烯生物合成的调控,揭示了乙烯对植株耐旱性的正调节作用[22]。
此外有一些ERF类蛋白在植物响应胁迫时发挥负调控的作用,比如拟南芥AtERF4和AtERF7作为转录抑制因子来调控ABA的应答[23-24]。AtERF7在拟南芥中的过量表达可以使保卫细胞降低对ABA的敏感性,因此通过气孔增加了水分的损失,AtERF7在拟南芥中的过量表达甚至抑制被ABA诱导的基因的表达从而降低了对干旱胁迫的耐受力[23]。AtERF4与AtERF7发挥调控作用的原理相似,它可以增强植物对盐胁迫的敏感性[24]。
MaASR1是从香蕉果实的cDNA文库中获得的一个ASR基因,本实验室前期的研究结果表明香蕉植株在干旱胁迫条件下,MaASR1基因在根部和叶片中的表达量大幅上升,这说明MaASR1基因主要参与植物在面临干旱胁迫时的应答反应[25]。为了深入研究MaASR1基因在香蕉干旱胁迫中发挥作用的抗性机制,将MaASR1基因转入模式植物拟南芥,获得了转基因纯合株系L14[25]。L14在干旱胁迫条件下的存活率优于野生型拟南芥植株[25]。并且在转基因株系中,MaASR1基因的表达量越大,则该株系表现出来的抗旱能力则越强[25-26]。这些证据都能说明MaASR1基因的转入能够提高拟南芥的抗旱性[25]。为了进一步研究MaASR1基因转入拟南芥后增强其抗旱性的分子机制,运用DNA芯片技术来筛选野生型拟南芥和转MaASR1基因拟南芥在不做任何处理和干旱胁迫处理条件下的差异基因,希望能进一步解析香蕉MaASR1基因通过乙烯途径提高拟南芥抗旱性的作用机制。
1 材料与方法
1.1 试验材料
野生型拟南芥(Arabidopsisthaliana. Columbia ecotype)是从美国俄亥俄州立大学拟南芥生物资源中心购买的。转MaASR1基因的转基因型拟南芥命名为L14,是由本实验室构建植物表达载体后通过农杆菌侵染的方法转化得到的。
1.2 所用引物
本研究所用引物见表1。
1.3 试验方法
1.3.1 对野生型和MaASR1转基因拟南芥幼苗的干旱处理 在MS固体培养基上播种野生型拟南芥WT和MaASR1转基因株系L14的种子,4 ℃条件下处理3 d (该步骤主要是对种子进行春化处理),然后在光照培养箱中培养。温度为 21~23 ℃,每日光照和黑暗培养时间分别为8 h和16 h。光照度为2 000 lx,相对湿度为70%。15 d后,选择生长出 2~4片叶片的幼苗,将其从培养皿中取出,置于盖有2个培养皿的滤纸之上,然后在光照培养箱中模拟干旱胁迫条件进行处理。处理时间分别为0 h、2 h和6 h,然后分别取样0.2 g,拟南芥的取样部位为整个拟南芥幼苗植株,在液氮中冷冻之后于-70 ℃保存[25]。

表1 本研究所用引物
1.3.2 野生型和MaASR1转基因拟南芥叶片总RNA的提取及cDNA的合成 取干旱处理0 h、2 h和6 h的试验材料,用QIAGEN plant RNA Kit试剂盒来提取拟南芥的总RNA。然后用Fermentas的反转录试剂盒合成cDNA的第1条链。荧光定量PCR的引物序列见表1,qRT-PCR仪器型号为Mx3000P(Stratagene,USA),以拟南芥看家基因AtActin(基因登录号AK318637)为内参基因。荧光定量PCR程序为94 ℃,30 s;94 ℃ 7 s,55 ℃(57 ℃) 15 s,72 ℃ 20 s,40个循环。
1.3.3 荧光定量PCR数据分析 数据处理采用Excel 2010软件完成,利用DPS软件对数据进行统计分析,差异显著性检验和相关性分析。
1.3.4 表达谱芯片的制作和分析 提取MaASR1转基因株系(编号为L14)和野生型拟南芥的总RNA,委托博奥生物有限公司制作2种类型的表达谱芯片,一种是转基因与野生型拟南芥在自然状态即未作任何胁迫处理条件下的DNA芯片,命名为14 vs WT,其中14代表非胁迫处理下转基因株系L14,WT代表非胁迫处理下野生型拟南芥;另一种是干旱处理2 h的MaASR1转基因拟南芥L14与野生型表达谱芯片,命名为Y vs W,其中Y代表干旱胁迫处理下转基因株系L14,W代表干旱胁迫处理下野生型拟南芥。2种类型的芯片各重复3次以减少误差。并对所得到的DNA芯片的结果进行生物信息学分析和差异基因的筛选。
2 结果与分析
2.1 表达谱芯片差异基因的通路分析
表达谱芯片的筛选标准为:Ratio≥2代表表达上调大于2倍的基因,Ratio≤0.5代表表达下调大于2倍的基因。14 vs WT一共得到747个差异基因,其中上调基因559个,下调基因188个;Y vs W一共得到653个差异基因,其中上调基因256个,下调基因397个[27]。
在14 vs WT芯片中得到的差异基因经分析共找到61个相关的pathway,主要涉及淀粉和蔗糖的代谢,磷酸戊糖途径,糖酵解及糖异生,植物激素信号转导等途径。共有9个差异基因参与激素信号转导途径(表2),其中8个差异基因上调,1个差异基因下调。
在Y vs W芯片中得到的差异基因经分析共找到58个相关的pathway,主要涉及植物激素信号转导,光合作用,叶绿素代谢,植物生长节律等代谢途径。共有20个差异基因参与激素信号转导途径(表3),其中5个差异基因上调,15个差异基因下调。

表2 14 vs WT芯片中差异基因的通路分析

表3 Y vs W芯片中差异基因的通路分析
通过对表达谱芯片进行详细的生物信息学分析(主要包括Network分析,Gene ontology分析以及Pathway分析),发现MaASR1基因提高植物抗旱性与植物激素信号转导途径有密切的关系。本研究重点研究了与乙烯途径的关系,经分析得到了与乙烯途径相关的几个关键基因,分别是:ACO1(ACC OXIDASE 1),即ACC氧化酶基因;ACS6(1-AMINOCYCLOPROPANE-1- CARBOXYLIC ACID (ACC) SYNTHASE 6),即ACC合成酶基因;AtERF4(ETHYLENE RESPONSIVE ELEMENT BINDING FACTOR),即乙烯应答元件结合因子基因;AtERF5、AtERF6、AtERF8、AtERF11、AtERF13、AtETR2(ETHYLENE RESPONSE 2),即乙烯受体基因;AtERS2(ETHYLENE RESPONSE SENSOR 2),即乙烯反应传感蛋白基因;AtEBF2(EIN3-BINDING F BOX PROTEIN 2),即结合AtEIN3的F-box蛋白基因;At5g61600(ethylene-responsive element-binding family protein),即乙烯响应结合元件家族蛋白基因[27]。
2.2 表达谱芯片中野生型及MaASR1转基因拟南芥乙烯应答相关基因的表达
ACS6与ACO1参与乙烯生物合成过程,AtERF4、AtERF5、AtERF6、AtERF8、AtERF11、AtERF13乙烯应答元件结合因子,从AtERF4~AtERF11都参与乙烯介导的信号途径。利用Real-time RT-PCR检测野生型及MaASR1转基因拟南芥不同时间的干旱处理及在不做任何胁迫处理条件下乙烯相关基因的表达变化,来进行芯片结果的验证。
如图1所示,参与乙烯生物合成途径的AtACS6和AtACO1,MaASR1转基因拟南芥在未受干旱胁迫和干旱胁迫2 h时的基因表达量均高于野生型,而在干旱胁迫6 h时野生型拟南芥基因的表达量则明显高于MaASR1转基因拟南芥。
参与乙烯信号途径的ERF类基因,AtERF6、AtERF11和AtERF13基因变化趋势相同,MaASR1转基因拟南芥在未受干旱胁迫和干旱胁迫2 h、6 h时的基因表达量均高于野生型;AtERF5和AtERF8基因变化趋势相同,在未受干旱胁迫时MaASR1转基因拟南芥的基因表达量明显高于野生型,在干旱胁迫2 h时MaASR1转基因拟南芥与野生型基因表达量基本相同,而在干旱胁迫6 h时野生型拟南芥基因表达量明显高于转基因拟南芥;AtERF4基因变化趋势与前两类均不同,在未受干旱胁迫处理时,转基因拟南芥基因表达量与野生型差异不显著,而在干旱胁迫2 h和6 h时,转基因拟南芥基因表达量则明显高于野生型。
乙烯受体基因AtETR2和AtERS2在未受干旱胁迫和干旱胁迫2 h和6 h时,MaASR1转基因拟南芥基因表达量都高于野生型。
未受干旱胁迫时AtEBF2在MaASR1转基因拟南芥中的基因表达量明显高于野生型。干旱胁迫2 h和6 h时的基因表达量在MaASR1转基因拟南芥和野生型中没有显著差异。
未受干旱胁迫和干旱胁迫2 h时,乙烯响应结合元件家族蛋白At5g61600在MaASR1转基因拟南芥中的表达量均高于野生型,在干旱胁迫6 h时MaASR1转基因拟南芥表达量低于野生型,达到了极显著差异。
从表4中芯片检测数据与Realtime-PCR数据之间相关性分析可以看出,相关系数均大于0.7,这说明芯片检测数据与Realtime-PCR数据是极显著正相关的关系,说明得到的芯片数据是可靠的。
3 讨 论
AtACS6即ACC合成酶,是整个乙烯合成途径中的关键酶和限速酶,SAM在ACC合酶(ACC synthase,ACS)的催化下产生氨基环丙烷羧酸(1-aminocyclo- propane-1-carboxylic acid, ACC),ACC在AtACO1即ACC氧化酶的催化下产生乙烯。RT-PCR结果表明,在干旱胁迫2 h时,AtACS6和AtACO1在MaASR1转基因株系的表达水平与野生型相比明显提高。这表明在干旱胁迫条件下,MaASR1的转入提高了拟南芥体内的乙烯合成水平。
在植物的乙烯反应途径中,第一步是乙烯与受体分子相结合。在拟南芥中共有5个乙烯受体,它们表现出功能冗余。多种乙烯受体的存在是乙烯反应顺利进行所必需的,即使其中的一个受体功能丧失了或者发生了突变,乙烯反应也不受影响。乙烯受体对乙烯反应起负调控作用,拟南芥中乙烯反应的诱导是由于这些蛋白质的失活而不是激活[28]。受体本身处于开启状态,抑制乙烯反应,乙烯与受体的结合使受体关闭[29]。乙烯缺乏时,乙烯受体与CTRI结合,形成ETR-CTRI复合体,激活CTRI的负调控活性, 不产生乙烯反应;乙烯存在时,乙烯与受体结合,CTRI不能被激活,产生乙烯反应。乙烯受体和CTRI都是乙烯信号转导的负调控器,乙烯与受体结合钝化其负调控活性[30]。位于乙烯信号转导下游和末端的EIN2、EIN3和ERF1都是乙烯信号转导的正调控器[31]。EBF2即结合EIN3的F-box蛋白,EBF1/ EBF2通过一条泛蛋白/蛋白酶体途径作用于EIN3蛋白,使EIN3蛋白迅速降解。说明EBF1/ EBF2间接对乙烯反应起负调控作用[32]。
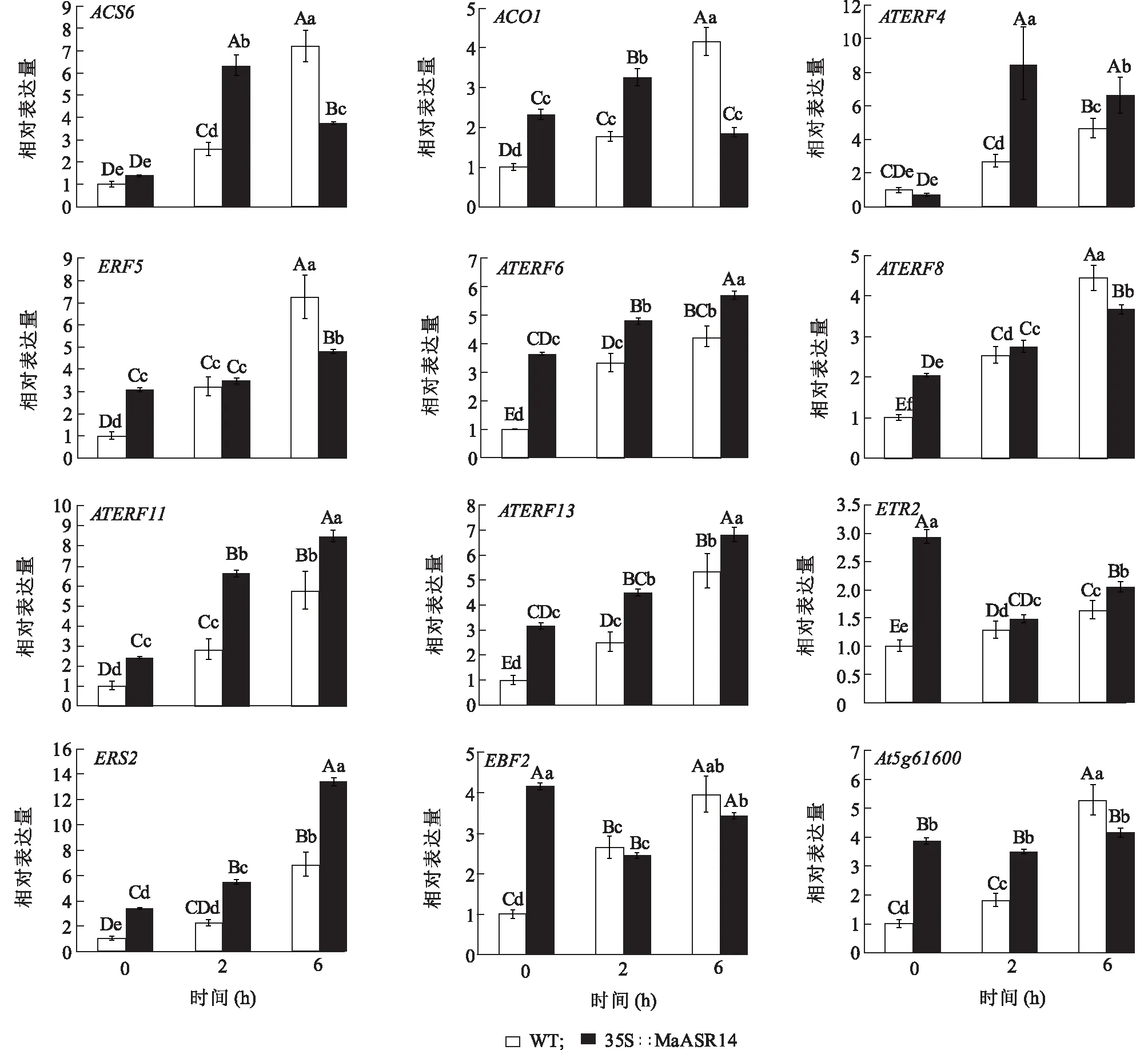
不同小写字母表示组间差异显著(P<0.05);不同大写字母表示组间差异极显著(P<0.01)。图1 野生型及MaASR1转基因拟南芥乙烯应答相关基因表达的Realtime-PCR验证Fig.1 The expression profile of ethylene related genes detected by Realtime-PCR in wild-type and the MaASR1 transgenic line L14
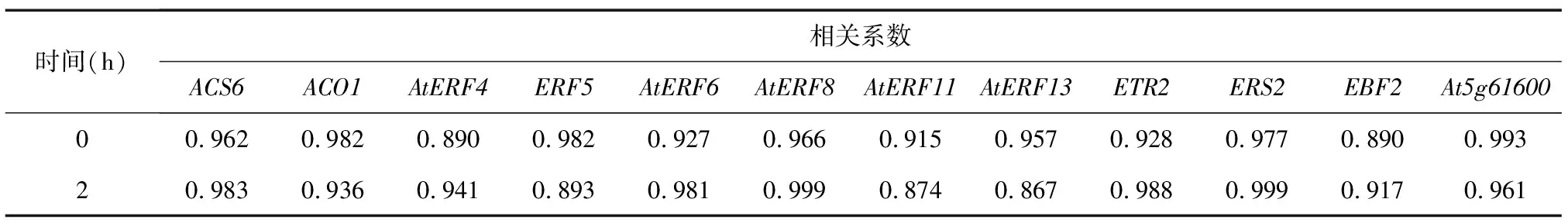
表4 芯片数据与荧光定量PCR结果的相关性
ERFs 类的转录因子在植物对非生物胁迫的应答中发挥重要作用。ERF转录因子可以与顺式作用元件DRE/CRT结合,而DRE/CRT广泛存在于与植物对干旱、冷害和盐害等非生物胁迫等密切相关的功能基因的启动子中。ERF转录因子可以通过识别顺式作用元件DRE/CRT调节胁迫相关基因的表达,从而调节植物对非生物胁迫的应答反应。水稻中ERFs转录因子TSRF1的过量表达可以提高水稻的抗旱性[33];在水稻中克隆和鉴定了4个ERF类转录因子OsBIERF1~OsBIERF4,它们都参与植物对非生物胁迫的应答[34]。可溶性糖和脯氨酸是参与植物渗透调节的关键因素,它们可以增强植物对环境胁迫的适应能力[35-36]。JERF3基因在水稻中的过量表达能提高在干旱胁迫下可溶性糖和脯氨酸的积累水平从而抵御干旱[37]。
以上研究结果都表明,ERFs 转录因子在植物的非生物胁迫应答中具有非常重要的作用。从表达谱芯片的分析结果和RT-PCR的结果显示,在2 h干旱胁迫条件下AtERF4、AtERF6、AtERF8、AtERF11、AtERF13的表达量在转基因拟南芥中比野生型有明显的提高,其中AtERF8的表达量在转基因拟南芥中与野生型相比差异显著,AtERF4、AtERF6、AtERF11、AtERF13的表达量在转基因拟南芥中与野生型相比差异极显著。在2 h干旱胁迫条件下,AtERF5的表达在野生型和转基因型中没有明显变化;但在未进行干旱胁迫时AtERF5的表达量在转基因拟南芥中比野生型有明显的提高,差异极显著。以上结果表明MaASR1可以通过提高AtERF类基因的表达来赋予拟南芥植物抗旱性。在干旱胁迫条件下AtETR2和AtERS2的表达量在转基因拟南芥中比野生型有所提高,由于乙烯受体有功能冗余,所以乙烯受体AtETR2和AtERS2表达量的变化不会影响最后的乙烯反应。在干旱胁迫2 h时,乙烯负调控因子AtEBF2的表达量在转基因拟南芥中与野生型没有明显差异,在干旱胁迫6 h时,AtEBF2的表达量在转基因拟南芥中比野生型明显下降,因此是有利于乙烯反应的进行。在干旱胁迫2 h时,乙烯应答蛋白基因At5g61600在转基因拟南芥中的表达量比野生型显著提高。
目前尚没有AtASR基因通过调节乙烯途径来提高植物抗旱性的报道,以上芯片生物信息学分析以及RT-PCR的研究结果表明,MaASR1基因可以通过正调控乙烯反应和提高AtERF类基因的表达来赋予植物抗旱性。并且在干旱胁迫条件下,MaASR1的转入通过提高AtACS6和AtACO1的表达水平提高了拟南芥体内的乙烯合成水平,这为深入解析MaASR1基因提高植物抗旱性的作用机理奠定了基础。
参考文献:
[1] SHAO H B, CHU L Y, JALEEL C A, et al. Understanding water deficit stress-induced changes in the basic metabolism of higher plants-biotechnologically and sustainably improving agriculture and the ecoenvironment in arid regions of the globe[J]. Crit Rev Biotechnol, 2009, 29(2):131-151.
[2] FUJITA M, FUJITA Y, NOUTOSHI Y, et al. Crosstalk between abiotic and biotic stress responses:a current view from the points of convergence in the stress signaling networks[J]. Curr Opin Plant Biol, 2006, 9(4):436-442.
[3] VERMA V, RAVINDRAN P, KUMAR P P. Plant hormone-mediated regulation of stress responses[J]. BMC Plant Biol, 2016, 16:86.
[4] NGUYEN D, RIEU I, MARIANI C, et al. How plants handle multiple stresses:hormonal interactions underlying responses to abiotic stress and insect herbivory[J]. Plant Mol Biol, 2016, 91(6):727-740.
[5] 张 帆,李景富,姜景彬,等.外源水杨酸诱导对番茄幼苗抗冷性的影响[J].江苏农业科学,2017,45(3):91-94.
[6] 孙验玲,徐远超,李 帅,等. 玉米耐受盐胁迫的调控机理研究进展[J]. 山东农业科学,2016,48(11):157-163.
[7] MITTLER R, BLUMWALD E. Genetic engineering for modern agriculture:challenges and perspectives[J]. Annual Review of Plant Biology, 2010, 61:443-462.
[8] LEE S C, LUAN S. ABA signal transduction at the crossroad of biotic and abiotic stress responses[J]. Plant Cell Environ, 2012, 35(1):53-60.
[9] DESIKAN R, LAST K, HARRETT-WILLIAMS R, et al. Ethylene-induced stomatal closure in Arabidopsis occurs via AtrbohF-mediated hydrogen peroxide synthesis[J]. Plant J, 2006, 47(6):907-916.
[10] VYSOTSKAYA L, WILKINSON S, DAVIES W J, et al. The effect of competition from neighbours on stomatal conductance in lettuce and tomato plants[J]. Plant Cell Environ, 2011, 34(5):729-737.
[11] JOO J, CHOI H J, LEE Y H, et al. A transcriptional repressor of theERFfamily confers drought tolerance to rice and regulates genes preferentially located on chromosome 11[J]. Planta, 2013, 238:155-170.
[12] REN M Y, FENG R J, SHI H R, et al. Expression patterns of members of the ethylene signaling-related gene families in response todehydration stresses in cassava[J]. PLoS One, 2017, 12(5):e0177621.
[13] WU L J, ZHANG Z J, ZHANG H W, et al. Transcriptional modulation of ethylene response factor protein jerf3 in the oxidative stress response enhances tolerance of tobacco seedlings to salt, drought, and freezing[J]. Plant Physiol, 2008, 148(4):1953-1963.
[14] ZHANG H W, LIU W, WAN L Y, et al. Functional analyses of ethylene response factor JERF3 with the aim of improving tolerance to drought and osmotic stress in transgenic rice[J]. Transgenic Res, 2010, 19(5):809-818.
[15] VINOCUR B, ALTMAN A. Recent advances in engineering plant tolerance to abiotic stress:achievements and limitations[J]. Curr Opin Biotech, 2005, 16(2):123-132.
[16] CHUANG H W, HARNRAK A, CHEN Y C, et al. A harpin-induced ethylene-responsive factor regulates plant growth and responses to biotic and abiotic stresses[J]. Biochem Bioph Res Co, 2010, 402(2):414-420.
[17] PAN Y, SEYMOUR G B, LU C G, et al. An ethylene response factor (ERF5) promoting adaptation to drought and salt tolerance in tomato[J]. Plant Cell Rep, 2012, 31(2):349-360.
[18] SEO Y J, PARK J B, CHO Y J, et al. Overexpression of the ethylene-responsive factor gene brerf4 from brassica rapa increases tolerance to salt and drought in arabidopsis plants[J]. Mol Cells, 2010, 30(3):271-277.
[19] NOWAK K, WOJCIKOWSKA B, GAJ M D. ERF022 impacts the induction of somatic embryogenesis in Arabidopsis through the ethylene related pathway[J]. Planta, 2015, 241:967-985.
[20] CHENG M C, LIAO P M, KUO W W, et al. The Arabidopsis ETHYLENE RESPONSE FACTOR1 regulatesabiotic stress-responsive gene expression by binding to different cis-acting elements in response to different stress signals[J]. Plant Physiol, 2013, 162(3):1566-1582.
[21] YU Y, YANG D, ZHOU S, et al. The ethylene response factor OsERF109 negatively affects ethylene biosynthesis and droughttolerance in rice[J]. Protoplasma, 2017, 254(1):401-408
[22] ZHANG H, ZHANG J, QUAN R, et al. EAR motif mutation of rice OsERF3 alters the regulation of ethylene biosynthesis and drought tolerance[J]. Planta, 2013, 237:1443-1451.
[23] SONG C P, AGARWAL M, OHTA M, et al. Role of anArabidopsisAP2/EREBP-type transcriptional repressor in abscisic acid and drought stress responses[J]. Plant Cell, 2005, 17(8):2384-2396.
[24] YANG Z, TIAN L N, LATOSZEK-GREEN M, et al. ArabidopsisERF4 is a transcriptional repressor capable of modulating ethylene and abscisic acid responses[J]. Plant Mol Biol, 2005, 58(4):585-596.
[25] 王 园.香蕉ASR基因抗逆功能的研究[D]. 海口:海南大学, 2010.
[26] 苗红霞, 王 园, 徐碧玉, 等. 香蕉MaASR1基因的抗干旱作用[J]. 植物学报, 2014, 49 (5):548-559.
[27] 张丽丽,香蕉转录因子基因-MaASR1提高拟南芥抗旱能力的调控机理研究[D]. 海口:海南大学, 2012.
[28] HUA J, MEYEROWITZ E M. Ethylene responses are negatively regulated by a receptor gene family inArabidopsisthaliana[J]. Cell, 1998, 94(2):261-271.
[29] 王中凤, 应铁进. 植物乙烯信号转导研究进展[J]. 植物生理与分子生物学学报, 2004, 30(6):601-608.
[30] BLEECKER A B, KENDE H. Ethylene:A gaseous signal molecule in plants[J]. Annu Rev Cell Dev Bi, 2000, 16:1-18.
[31] KLEE H J. Ethylene signal transduction. moving beyond Arabidopsis[J]. Plant Physiol, 2004, 135(2):660-667.
[32] GUO H W, ECKER J R. Plant responses to ethylene gas are mediated by SCF (EBF1/EBF2)-dependent proteolysis of EIN3 transcription factor[J]. Cell, 2003, 115(6):667-677.
[33] QUAN R D, HU S J, ZHANG Z L, et al. Overexpression of an ERF transcription factor TSRF1 improves rice drought tolerance[J]. Plant Biotechnol J, 2010, 8(4):476-488.
[34] CAO Y F, SONG F M, GOODMAN R M, et al. Molecular characterization of four rice genes encoding ethylene-responsive transcriptional factors and their expressions in response to biotic and abiotic stress[J]. J Plant Physiol, 2006, 163(11):1167-1178.
[35] ZHAO F Y, WANG Z L, ZHANG Q, et al. Analysis of the physiological mechanism of salt-tolerant transgenic rice carrying a vacuolar Na+/H+antiporter gene from Suaeda salsa[J]. J Plant Res, 2006, 119(2):95-104.
[36] VERBRUGGEN N, HERMANS C. Proline accumulation in plants:a review[J]. Amino Acids, 2008, 35(4):753-759.
[37] ZHANG H W, LIU W, WAN L Y, et al. Functional analyses of ethylene response factor JERF3 with the aim of improving tolerance to drought and osmotic stress in transgenic rice[J]. Transgenic Res, 2010, 19(5):809-818.

