血管内皮生长因子与肿瘤负荷相关性研究
贾晓辉 郝丽丽
(吉林市第二人民医院,吉林 130000)
肿瘤是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物,多呈占位性块状突起,且转移和侵袭是恶性肿瘤的重要特征。恶性肿瘤已经成为世界性的公共卫生问题,严重危及人类的健康和生命安全。据统计,目前全球每年新发1 500万恶性肿瘤病例,每年死于恶性肿瘤的患者约有900万,其中2/3的病例发生在发展中国家[1]。我国流行病学资料显示[2],恶性肿瘤发病率为344.89/10万,男性发病率高于女性,且城市发病率远高于农村,年龄越高其发生风险也越高,但是包括乳腺癌、宫颈癌和胃癌在内的多种恶性肿瘤近年来均呈现出年轻化趋势。有研究显示,恶性肿瘤发生的生理学基础是新血管生成,而血管内皮生长因子(Vascular endothelial growth factor,VEGF)是血管内皮细胞特异性肝素结合因子,在体内大量合成和分泌能够诱导血管新生,故推测在肿瘤患者中血清VEGF水平异常升高[3,4]。为了探讨血清VEGF的表达情况与肿瘤负荷的相关性,并挖掘其可能的作用途径,本研究特选取健康人、高危者、手术切除后无病灶者、经治疗病情稳定者和初诊患者对血清VEGF进行定性和定量对比,并对比各组CD4+/CD8+差异,分析初诊组中血清VEGF与CD4+/CD8+的相关性,详情报告如下。
1 资料与方法
1.1资料
1.1.1临床资料 自医院体检中心和肿瘤科2014年6月~2015年6月收治的健康志愿者、恶性肿瘤高危者(有恶性肿瘤家族史)、恶性肿瘤手术后无原位病灶患者、经治疗后病情稳定的恶性肿瘤患者、初诊恶性肿瘤患者各100例,分别记为对照组、高危组、手术组、稳定组和初诊组。
纳入及排除标准:对照组确定为健康志愿者,高危者均具有恶性肿瘤家族史但是本人并未发现有恶性肿瘤,手术组均经病理检查证实为恶性肿瘤,且均未发现原位病灶,稳定组均经对症支持治疗后病情稳定,维持时间≥4周,且原位病灶长径无明显变化,初诊组均确诊为恶性肿瘤,但是未接受任何抗肿瘤措施治疗;排除预期生存时间<6个月者,年龄<18或>85岁者,良性肿瘤者,有药物滥用史、吸毒史者,拒绝签署同意书者。
1.1.2主要设备和试剂 生化管(嘉兴华越医疗器械有限公司);VEGF标准品(杭州联科生物技术股份有限公司);蒸馏水、洗涤液、显色剂A和B(深证晶美生物科技有限公司);恒温箱(上海一恒科学仪器有限公司);酶标仪(深圳市盛信康科技有限公司);流式细胞仪(美国贝克曼库尔特有限公司)。
1.2方法
1.2.1抽血送检 用生化管抽取血液3 ml送至化验室,从2~8℃取出试剂盒,室温放置(22℃)20~30 min使其回到室温再开始检测。
1.2.2VEGF检测方法 ①复温:室温(22℃)放置20~30 min使其恢复室温;②稀释:先将冻干粉(VEGF标准品)用1 ml样品溶解,调整母液浓度至800 pg/ml,再进行倍比稀释。倍比稀释从高浓度到低浓度时注意要更换枪头;③配液和加样:将浓缩洗涤液用蒸馏水20倍稀释;分别在孔中加入相应浓度的标准品,滴加剂量为200 μl/孔,待检孔先加入样品稀释液100 μl再加入血清样品100 μl,混匀,盖膜,放置于37℃温育60 min;④洗涤和加酶温育:扣去孔内液体,加入稀释洗涤液,380 μl/孔,15 s后弃去液体并在滤纸上扣干,共重复5次;加入200 μl酶标抗体工作液,37℃避光温育60 min;⑤洗涤和显色:洗涤和加酶温育:扣去孔内液体,加入稀释洗涤液,380 μl/孔,1 min后弃去液体并在滤纸上扣干,共重复5次。依次加入显色剂A、B液各100 μl,混匀,37℃避光显色10 min;⑥测定:50 μl/孔加终止液,混匀,放入酶标仪,测定各孔OD值,波长为450/630 nm,绘制标准曲线,根据样品的吸光值在坐标上找出对应的浓度。按照如下公式计算血清VEGF水平:血清VEGF浓度=2×求算各孔VEGF浓度值。
1.2.3CD4+和CD8+检测方法 采用流式细胞仪对外周血两因子水平进行检测,并计算CD4+/CD8+。
1.2.4观察指标 对比各组血清VEGF增高率和分级情况,其中血清VEGF<142.2 pg/ml者为正常(血清VEGF<80 pg/ml者为无风险,血清VEGF≥80 pg/ml且<142.2 pg/ml者记为需复查);血清≥142.2 pg/ml且<284 pg/ml者记为轻度升高;血清≥284 pg/ml者记为较高,其中需复查、轻度升高和较高者构成比记为增高率。
对比各组血清VEGF水平、CD4+、CD8+、CD4+/CD8+水平。
分析初诊组血清VEGF水平与CD4+/CD8+的相关性。
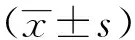
2 结果
2.1各组基线资料情况 各组性别、平均年龄以及手术组、稳定组和初诊组肿瘤类型分布基线资料比较差异均无统计学意义(P>0.05),详见表1。
2.2各组血清VEGF增高率和分级情况 各组血清VEGF分级比较差异有统计学意义(P<0.05),且高危组、手术组、稳定组、初诊组血清VEGF增高率均远高于对照组(χ2=2.743、33.147、126.081、148.053,P=0.048、0.000、0.000、0.000),手术组、稳定组和初诊组血清VEGF增高率均远高于高危组(χ2=22.427、109.974、131.273,P=0.000、0.000、0.000),稳定组和初诊组血清VEGF增高率均远高于手术组(χ2=41.301、57.955,P=0.000、0.000),初诊组血清VEGF增高率远高于稳定组(χ2=2.986,P=0.047),详见表2。
2.3各组血清VEGF、CD4+、CD8+、CD4+/CD8+各组血清VEGF、CD4+、CD8+、CD4+/CD8+水平比较差异有统计学意义(P<0.05),且高危组、手术组、稳定组、初诊组血清VEGF水平均远高于对照组(t=17.448、80.118、50.108、54.696,P=0.000、0.000、0.000、0.000),而CD4+均远低于对照组(t=5.173、6.286、8.462、10.170,P=0.024、0.019、0.013、0.000),CD4+/CD8+均远低于对照组(t=13.479、20.178、32.543、51.702,P=0.000、0.000、0.000、0.000),手术组、稳定组和初诊组血清VEGF水平均远高于高危组(t=63.066、43.879、49.567,P=0.000、0.000、0.000),而CD4+均远低于高危组(t=6.170、7.402、8.970,P=0.020、0.015、0.012),CD4+/CD8+均远低于高危组(t=52.010、40.706、41.214,P=0.000、0.000、0.000),稳定组和初诊组血清VEGF水平均远高于手术组(t=13.432、23.956,P=0.000、0.000),而CD4+均远低于稳定组(t=5.113、6.108,P=0.024、0.017),CD4+/CD8+均远低于手术组(t=11.783、19.805,P=0.000、0.000),初诊组血清VEGF水平远高于稳定组(t=10.286,P=0.000),而CD4+均远低于稳定组(t=6.133,P=0.021),CD4+/CD8+均远低于稳定组(t=9.817,P=0.000);稳定组和初诊组CD8+水平均远高于对照组、高危组和手术组(t=7.143、6.097、5.187,P=0.009、0.011、0.020;t=8.761、6.297、5.375,P=0.007、0.009、0.012),详见表3。
2.4初诊组血清VEGF与CD4+/CD8+相关性 经Pearson分析可知,初诊组血清VEGF与CD4+/CD8+呈负相关(r=-0.578,P<0.05)。
表1各组基线资料
Tab.1Baselinedataofeverygroup
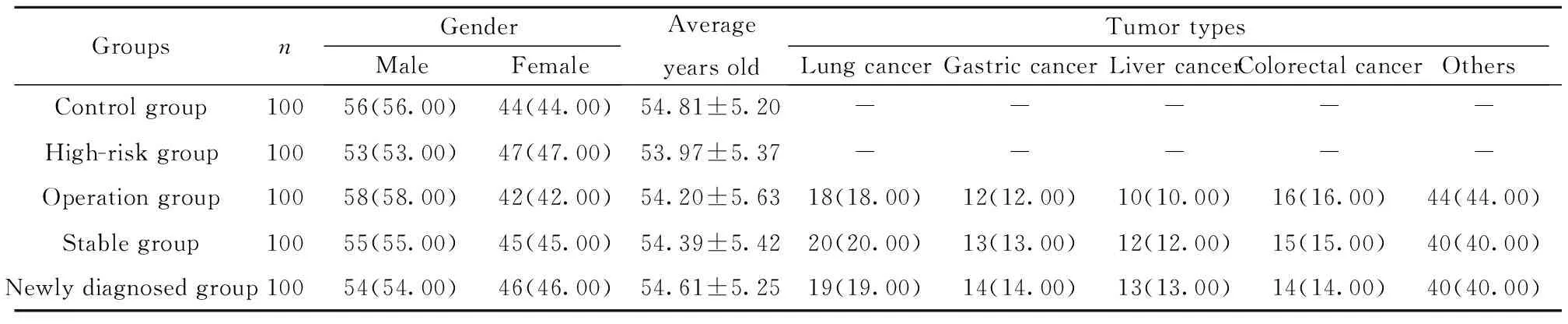
GroupsnGenderMaleFemaleAverageyears oldTumor typesLung cancerGastric cancerLiver cancerColorectal cancerOthersControl group10056(56.00)44(44.00)54.81±5.20-----High-risk group10053(53.00)47(47.00)53.97±5.37-----Operation group10058(58.00)42(42.00)54.20±5.6318(18.00)12(12.00)10(10.00)16(16.00)44(44.00)Stable group10055(55.00)45(45.00)54.39±5.4220(20.00)13(13.00)12(12.00)15(15.00)40(40.00)Newly diagnosed group10054(54.00)46(46.00)54.61±5.2519(19.00)14(14.00)13(13.00)14(14.00)40(40.00)
表2各组血清VEGF水平分布及增高率对比
Tab.2ComparisonofserumVEGFgradingandincreasingratesineverygroup
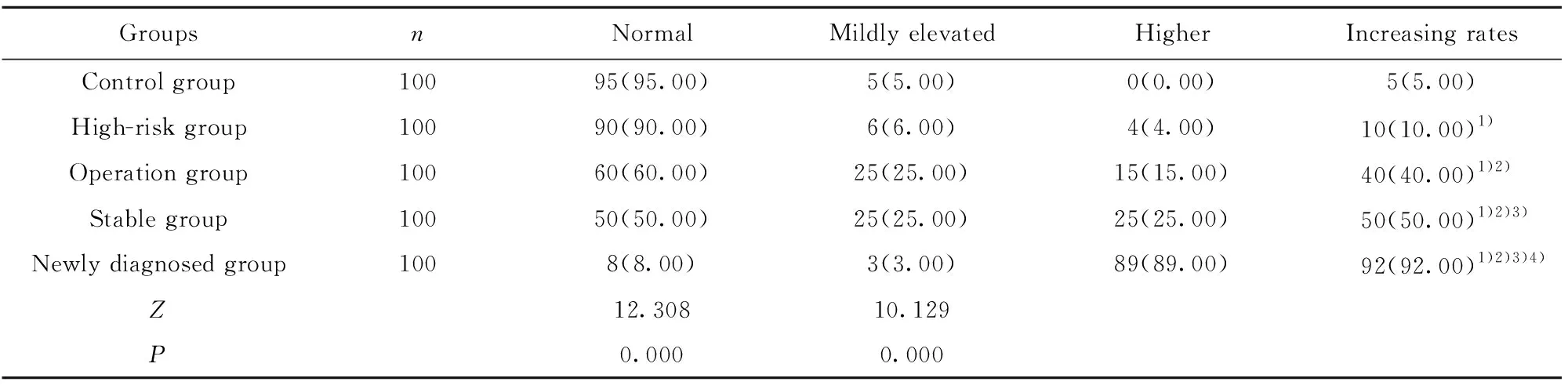
GroupsnNormalMildly elevatedHigherIncreasing ratesControl group10095(95.00)5(5.00)0(0.00)5(5.00)High-risk group10090(90.00)6(6.00)4(4.00)10(10.00)1)Operation group10060(60.00)25(25.00)15(15.00)40(40.00)1)2)Stable group10050(50.00)25(25.00)25(25.00)50(50.00)1)2)3)Newly diagnosed group1008(8.00)3(3.00)89(89.00)92(92.00)1)2)3)4)Z12.30810.129P0.0000.000
Note:Compared with the control group,1)P<0.05;compared with the high-risk group,2)P<0.05;compared with the operation group,3)P<0.05;compared with the stable group,4)P<0.05.
表3各组血清VEGF、CD4+、CD8+、CD4+/CD8+对比
Tab.3ComparisonofserumVEGF,CD4+,CD8+andCD4+/CD8+ineverygroup

GroupsnVEGF(pg/ml)CD4+(%)CD8+(%)CD4+/CD8+Control group10052.43±7.46 33.41±2.1417.13±1.091.95±0.14High-risk group10074.38±10.131)30.26±2.051)17.29±1.121.75±0.131)Operation group100193.65±15.971)2)27.18±2.111)2)17.88±1.101.52±0.111)2)Stable group100249.87±38.691)2)3)25.40±2.071)2)3)19.69±1.031)2)3)1.29±0.101)2)3)Newly diagnosed group100312.45±46.951)2)3)4)23.11±1.781)2)3)4)21.40±1.061)2)3)4)1.08±0.121)2)3)4)F26.743396.606286.81421.454P0.0000.0000.0000.000
Note:Compared with the control group,1)P<0.05;compared with the high-risk group,2)P<0.05;compared with the operation group,3)P<0.05;compared with the stable group,4)P<0.05.
3 讨论
现代医学水平下,人们对恶性肿瘤的发生机制认识尚浅,遗传易感性是该病发生的根本原因,物理因素、化学因素、生物因素等均可通过遗传易感性发挥作用,引起机体免疫状态紊乱和脱氧核糖核苷酸(DNA)损伤,可导致基因突变,久而久之,正常细胞便转变为恶性转化细胞,最终发生癌变[5-7]。研究证实[8],恶性肿瘤发生的危险因素主要有致癌物质接触或吞入机体、不良生活习惯、不健康饮食习惯、吸烟、酗酒、不良性生活习惯等,且随着现代诊断技术的不断发展和设备的不断更新,恶性肿瘤的检出率越来越高。尽管部分恶性肿瘤的发病率和死亡率有所控制,但形势仍然很严峻。目前恶性肿瘤患者的临床治疗方式主要有手术、放疗、化疗和中医药治疗等,尽管均有一定的抗肿瘤效果,但是仍缺乏高效的治疗方案,死亡率仍较高[9]。究其原因,除了与恶性程度较高有关外,对恶性肿瘤发生机制了解尚浅也会影响预后[10]。鉴于此,对恶性肿瘤发生的相关机制进行深入探讨能够为临床治疗的探索提供全新的思路。
本研究中高危组、手术组、稳定组、初诊组血清VEGF增高率、血清VEGF水平均远高于对照组(P<0.05),且手术组、稳定组和初诊组血清VEGF增高率、血清VEGF水平均远高于高危组(P<0.05),可知血清VEGF增高率和血清VEGF水平与恶性肿瘤的发生均存在紧密关联。肿瘤的生长依赖于新血管的生成,而VEGF作为一种重要的血管内皮细胞增殖和迁移刺激因子,在新血管生成中发挥着至关重要的作用[11]。据毛琳研究显示[12],新生的肿瘤血管是肿瘤细胞增殖的必要条件,同时也是肿瘤转移的第一路径,能够为肿瘤复发、转移和浸润奠定基础。此研究结果在另外一项荷瘤小鼠的实验研究中也得到证实[13],且此研究还发现,恶性肿瘤组织中VEGF蛋白相对表达量明显高于癌旁组织和正常组织,而癌旁组织的VEGF蛋白相对表达量也显著高于正常组织,证实VEGF表达异常升高的确与恶性肿瘤的发生有关。由此可以推测,肿瘤负荷很可能与VEGF存在正向相关性。
本研究结果中,各组血清VEGF分级比较差异有统计学意义(P<0.05),稳定组和初诊组血清VEGF增高率、血清VEGF水平均远高于手术组(P<0.05),初诊组血清VEGF增高率、血清VEGF水平均远高于稳定组(P<0.05),可知血清VEGF增高率和血清VEGF水平与恶性肿瘤的病情严重程度均存在紧密关联。血清VEGF增高率和血清VEGF水平越高,表明机体新血管生成的病理生理活动越激烈,也就意味着恶性肿瘤患者病情越严重,发生转移和侵袭的风险越高[14]。有研究表明,血清VEGF水平会随着恶性肿瘤的生长表现出明显的变化,并不会由于原位病灶稳定或消失静止不变,而是能够反映恶性肿瘤患者身体里面是否有转移灶,是否转移灶有加重趋势等,证实该因子具有较高的灵敏度和特异度,能够准确反映恶性肿瘤患者的严重程度[15]。由此可知,血清VEGF表达情况很可能与恶性肿瘤的严重程度存在紧密关联。
此外,本研究中CD4+和CD4+/CD8+水平在对照组、高危组、手术组、稳定组和初诊组中均逐渐升高,且每两组之间的水平对比差异均有统计学意义(P<0.05),且稳定组和初诊组CD8+水平均远高于对照组、高危组和手术组(P<0.05),可知在健康人群和不同肿瘤负荷状态人群中机体细胞免疫功能存在明显的差异;初诊组血清VEGF与的CD4+/CD8+呈负相关(r=-0.578,P<0.05),血清VEGF水平越高,CD4+/CD8+越低,反之亦然。CD4+为分泌细胞因子的细胞,在免疫应答反应中发挥重要作用;CD8+与CD4+可相互调控,可分泌抑制因子,相互拮抗,并据此对免疫应答产生调节作用,以维持免疫功能平衡[16]。在恶性肿瘤患者中恶性肿瘤细胞增殖状态与细胞免疫功能异常存在密切的关系。另有研究报道[17],VEGF不仅能够影响恶性肿瘤患者树突状细胞的分化与成熟,还可阻碍树突状细胞的抗原递呈功能,进而会对细胞毒性T细胞的扩增和活化产生影响,最终导致肿瘤细胞对放化疗杀伤作用的敏感性下降。结合上述研究,推测在恶性肿瘤的发生和发展过程中,血清VEGF异常升高,细胞免疫功能异常减弱,可作为临床治疗的新靶点。
综上所述,血清VEGF异常升高很可能意味着恶性肿瘤的发生风险增加,且恶性肿瘤患者病情越严重,病灶越多,转移和侵袭的风险越高,血清VEGF水平也越高,而CD4+/CD8+越低。本研究为恶性肿瘤的临床诊治提供了一个新的指标,而是否能够将其作为恶性肿瘤治疗的新靶点应当作为下一步的研究方向。
参考文献:
[1] Pearson ADJ,Pfister SM,Baruchel A,etal.From class waivers to precision medicine in paediatric oncology[J].Lancet Oncol,2017,18(7):394-404.
[2] 张 维,邱 惠,丁贤彬,等.重庆市2014年恶性肿瘤流行病学数据分析及防治对策研究[J].重庆医学,2017,46(11):1511-1512.
Zhang W,Qiu H,Ding XB,etal.The epidemiology analysis and countermeasure research of cancer in Chongqing 2014[J].Chongqing Med,2017,46(11):1511-1512.
[3] 吴 旻,陆艳荣,张瑾熔.AGGF1和HIF-1α及VEGF表达与食管鳞癌放疗预后相关性研究[J].中华肿瘤防治杂志,2016,23(17):1159-1164.
Wu M,Lu YR,Zhang JR.Relationship between the expression of AGGF1 ,HIF-1α and VEGF in esophageal squamous cell carcinoma and the prognosis of radiotherapy[J].Chin J Cancer Prevent Treatment,2016,23(17):1159-1164.
[4] 王绍辉,马四补,颜 昱,等.苏铁总黄酮对Lewis肺癌模型小鼠VEGF、bFGF、HIF-1α、NF-κB表达的影响[J].中国免疫学杂志,2017,33(7):1029-1034.
Wang SH,Ma SB,Yan Y,etal.Effects of total flavonoids from Cycas Revolute on expression of VEGF,bFGF,HIF-1α and NF-κB in model mice of Lewis lung cancer[J].Chin J Immunol,2017,33(7):1029-1034.
[5] Madhunapantula SV,Robertson GP.Targeting protein kinase-b3 (akt3) signaling in melanoma[J].Exp Opin Ther Targets,2017,21(3):273-290.
[6] 李 红,臧隽章,冯振卿,等.肿瘤细胞与骨髓源性细胞融合对肿瘤转移的影响及机制[J].医学研究生学报,2016,29(6):658-662.
Li H,Zang JZ,Feng ZQ,etal.The impact and molecular mechanism of fusion between tumor cells and bone marrow derived cells in tumor metastasis[J].J Med Postgraduates,2016,29(6):658-662.
[7] 李玉苗.Cullin7泛素连接酶在恶性肿瘤发生发展中的作用[J].中国肿瘤生物治疗杂志,2017,24(4):442-446.
Li YM.The role of Cullin7 ubiquitin ligase in carcinogenesis and progression of malignant tumor[J].Chin J Cancer Biotherapy,2017,24(4):442-446.
[8] 陈东风,孙文静,刘凯军,等.非酒精性脂肪性肝病相关性肝癌的流行病学现状与发病机制[J].中华肝脏病杂志,2017,25(2):111-114.
Chen DF,Sun WJ,Liu KJ,etal.Current epidemiology and pathogenesis of non-alcoholic fatty liver disease-associated liver cancer[J].Chin J Hepatol,2017,25(2):111-114.
[9] 平凌燕,宋玉琴,郑 文,等.99例原发肠道恶性淋巴瘤患者的临床特征、诊治及预后分析[J].中华血液学杂志,2017,38(3):231-236.
Ping LY,Song YQ,Zheng W,et al.Clinical features,diagnosis,treatment,and prognosis of 99 cases with primary intestinal lymphoma[J].Chin J Hematol,2017,38(3):231-236.
[10] Gavriatopoulou M,Terpos E,Kastritis E,etal.Efficacy and safety of elotuzumab for the treatment of multiple myeloma.[J].Exp Opin Drug Saf,2017,16(2):237-245.
[11] 李红雨,余亚南,胡晓静,等.上皮性卵巢癌组织中TGF-β1、FOXQ1、VEGF、E-cad、N-cad的表达及意义[J].山东医药,2017,57(2):91-94.
Li HY,Yu YN,Hu XJ,etal.Expressions and significance of TGF-β1,FOXQ1,VEGF,E-cad and N-cad in epithelial ovarian cancer tissues[J].Shandong Med J,2017,57(2):91-94.
[12] 毛 琳,吕 刚.贝伐珠单抗联合化疗治疗转移性结直肠癌的临床研究[J].解放军医学杂志,2017,42(6):569-570.
Mao L,Lv G.Clinical study of bevacizumab combined with chemotherapy in the treatment of metastatic colorectal cancer[J].Med J Chin People's Liberation Army,2017,42(6):569-570.
[13] 李 萌,丁瑞麟,文庆莲.重组人血管内皮抑素联合紫杉醇不同时序给药降低肺癌移植瘤小鼠血清中VEGF和HIF-1α的水平及其意义[J].肿瘤,2016,36(3):264-271.
Li M,Ding RL,Wen QL.Sequential administration of recombinant human endostatin combined with paclitaxel decreases the level of VEGF and HIF-1 α in serum of lung cancer xenograft mice and its significance[J].Cancer,2016,36(3):264-271.
[14] 杨雅芝,张小燕,万 倩,等.外泌小体内miRNA在多发性骨髓瘤进展中的作用及可能机制[J].中国实验血液学杂志,2017,25(1):301-305.
Yang YZ,Zhang XY,Wan Q,etal.Role of exosomal miRNA in multiple myeloma progression and its possible mechanism-review[J].J Exp Hematol,2017,25(1):301-305.
[15] 刘行仁,白义凤,梁 良,等.紫苏醇对肺癌A549细胞增殖和侵袭的抑制作用机制的研究[J].中国免疫学杂志,2017,33(6):859-863.
Liu XR,Bai YF,Liang L,etal.Anti-lung cancer effect and anti-angiogenesis therapy study of perillyl alcohol[J].Chin J Immunol,2017,33(6):859-863.
[16] 王景胜,苗 杰,刘正君,等.外周血T淋巴细胞亚群检测用于恶性肿瘤患者中的临床效果[J].检验医学与临床,2017,14(A01):269-270.
Wang JS,Miao J,Liu ZJ,etal.Clinical effect of peripheral blood T lymphocyte subsets in malignant tumor patients[J].Laboratory Med Clinic,2017,14(A01):269-270.
[17] Bocci G,Kerbel RS.Pharmacokinetics of metronomic chemotherapy:a neglected but crucial aspect.[J].Nat Rev Clin Oncol,2016,13(11):659-673.

