白藜芦醇对糖尿病大鼠血管平滑肌细胞凋亡的影响及其机制研究
李 燕 白立炜 王 涛 曹 萌 翟倩倩
(新乡医学院第一附属医院内分泌科,新乡 453100)
糖尿病是由多种因素引发的复杂的慢性疾病,且伴有多种并发症。糖尿病患者容易出现高血压、动脉粥样硬化、血脂异常、心肌梗死、中风、眼病、肾病及神经性疾病等症状。随着生活现代化程度的加大,越来越多的人正遭受糖尿病的折磨,1980年美国患糖尿病的人数为560万,2011年就增加到了2 090万,且糖尿病的发生带来了巨大的财政负担[1]。中国糖尿病的发病率从1980年的0.9%上升到2010年的11.6%,2013年中国糖尿病患者占全球糖尿病患者的四分之一,且有将近50.1%的人患有前驱糖尿病[2]。国际糖尿病联盟估计糖尿病的患病数将从2011年的3.66亿增加到2030年的5.52亿[3]。糖尿病治疗是医疗健康事业的重大课题。白藜芦醇是一种天然的多酚类物质,可从多种植物中提取[4]。白藜芦醇在新陈代谢及心血管疾病、神经退行性疾病及癌症中具有重要的保护作用[5-8]。本文主要研究在高糖高脂喂养下链脲佐菌素(Streptozotocin,STZ)诱导的糖尿病大鼠模型中,白藜芦醇对血管平滑肌细胞凋亡的调控作用及其分子机制。
1 材料与方法
1.1动物及主要试剂 40只8周龄成熟雄性清洁级大鼠购自四川省医学科学院实验动物研究中心。白藜芦醇和STZ购自美国Sigma公司。DMEM培养基及胎牛血清购自赛默飞世尔科技公司。Masson 三色染色试剂盒购自北京索莱宝科技有限公司Cleaved caspase-3、Cleaved caspase-9、B淋巴瘤2蛋白(B cell lymphoma 2,Bcl-2)和Bcl-2相关蛋白X (Bcl-2-associated X protein,Bax)及PI3K、p-PI3K、AKT、p-AKT的抗体购自Abcam公司。
1.2方法
1.2.1糖尿病大鼠模型的建立及药物处理 40只大鼠随机平均分为4组,分别为对照组(n=10)、对照+白藜芦醇组(n=10); STZ诱导的糖尿病组(n=10)、STZ+白藜芦醇组(n=10)。STZ诱导的糖尿病组和STZ+白藜芦醇组用高糖高脂饲料和小剂量腹腔多次连续注射STZ,连续5 d,每次60 mg/kg,从尾静脉采集全血分析血糖水平。若血糖水平连续3 d 超过12 mmol/L则判定为糖尿病。对照组给同等体积柠檬酸盐缓冲液。在大鼠确诊为糖尿病后,白藜芦醇组立即给予白藜芦醇灌胃[10 mg/(kg·d)],并开始从1计数实验天数,对照组和糖尿病组同期均接受同等体积蒸馏水灌胃处理,持续到第9周时,每组小鼠应用颈椎脱臼法处死,取上腔静脉血液。
1.2.2实时定量PCR (Quantitative real-time reverse transcription PCR,qRT-PCR) RNA提取试剂盒提取血清中总RNA后反转成cDNA,以此cDNA为模板进行qRT-PCR。MCP-1上游引物:GCTCGCTCAGCCAGATGCAAT,MCP-1下游引物:TGGGTTGTGGAGTGAGTGTTC。MIF上游引物:GGCCTCACTT-ACCTGCACC,MIF下游引物:ACCATTTATTTCT-CCCGACC。IL-18上游引物:ATATCGACCGAACAGCCAAC,IL-18下游引物:TGGCACACGTTTCTG-AAAGA。根据SYBR Premix Ex TaqTM说明书进行qRT-PCR,用公式2-ΔΔCt计算相对表达量。
1.2.3苏木素伊红(HE)染色和Masson染色 白藜芦醇处理9周后,颈椎脱臼法处死大鼠后取左心室心肌组织用多聚甲醛进行固定,经脱水石蜡包埋后进行切片(4 μm)。切片脱蜡至水后按照苏木素伊红(HE)染色液说明书进行苏木素伊红(HE)染色。光镜下观察心肌纤维化情况。为了进行Masson染色,首先将切片(4 μm)脱蜡至水,然后按照Masson 三色染色试剂盒说明书进行染色,镜下观察并拍照。细胞核呈蓝色,胞浆、肌肉、红细胞呈红色,胶原纤维/蛋白呈蓝色。
1.2.4血管平滑肌细胞的原代分离培养及药物处理 首先取出对照组和STZ诱导的糖尿病组主动脉放入装有无菌的D-Hank′s液培养皿中进行洗涤。体式显微镜下去除血管外膜,纵向切开血管壁,刮除内膜留下中膜,去除中膜外组织杂质。然后将剥离出来的中膜放入DMEM培养基并剪碎,离心去上清,取沉淀加入0.5%EDTA钠盐消化30 s,加入DMEM培养基终止消化。最后离心弃上清并用新鲜培养基重悬,再移入培养瓶中贴附于底面。轻轻翻转培养瓶,置于37℃,5%CO2的培养箱中培养2~3 h后,组织块贴壁后翻转培养瓶,加入含20%胎牛血清的DMEM培养液使组织块全部浸没在培养液中,继续静置培养。培养8~12 d后观察,当80%细胞已融合后便可进行细胞传代。取生长良好的对照组和STZ诱导的糖尿病组血管平滑肌细胞分别接种于96孔板中培养24 h后,分为对照组、对照+白藜芦醇组、STZ诱导的糖尿病组、STZ+白藜芦醇组。对照+白藜芦醇组和STZ+白藜芦醇组添加50 μmol/L的白藜芦醇;对照组和STZ诱导的糖尿病组添加等量的无菌水。处理24 h后进行后续实验。
1.2.5流式细胞术分析细胞凋亡 收集各组血管平滑肌细胞,用1×Binding buffer将细胞制成1×106个/ml的悬液。用Annexin V-fluorescein isothiocyan-ate(FITC),碘化丙啶(Propidium iodide,PI)染色15 min后利用流式细胞仪对染色细胞进行检测。
1.2.6蛋白印迹 首先收集各组血管平滑肌细胞,PBS洗3次后加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取。然后等量的蛋白进行SDS-PAGE凝胶电泳分离并将蛋白转至PVDF膜。经5%的BSA进行封闭后依次孵育相应的一抗和二抗。最后进行显色,并统计灰度值计算相对表达量。
1.3统计学分析 用SPSS16.0软件对实验数据进行统计学分析,两两比较用独立的t检验。P<0.05认为存在明显差异。
2 结果
2.1白藜芦醇在STZ诱导的糖尿病大鼠模型中对血清细胞因子的影响 利用qRT-PCR检测糖尿病大鼠血清中细胞因子MCP-1、MIF和IL-18的mRNA水平。如图1A~C所示,与对照组相比,STZ诱导糖尿病组大鼠血清中MCP-1、MIF和IL-18的mRNA水平明显升高(P<0.05)。对照组与对照+白藜芦醇组的MCP-1、MIF和IL-18的mRNA水平无明显差异。与STZ诱导糖尿病组相比,STZ+白藜芦醇组血清中MCP-1、MIF和IL-18的mRNA水平明显降低(P<0.05)。上述数据表明,白藜芦醇可抑制STZ诱导的糖尿病大鼠模型中细胞因子MCP-1、MIF和IL-18表达。
2.2白藜芦醇在STZ诱导的糖尿病大鼠模型中对心肌纤维化的影响 通过HE染色和Masson染色观察心肌组织纤维化情况,如图2所示,对照组与对照+白藜芦醇组蓝色胶原纤维很少,排列规则;STZ诱导糖尿病组大鼠心肌组织蓝色胶原纤维含量明显增多且排列紊乱,STZ+白藜芦醇组心肌组织蓝色胶原纤维减少,排列趋于规则。上述结果表明,在STZ诱导的糖尿病大鼠模型中,白藜芦醇具有抗心肌纤维化的作用。

图1 qRT-PCR检测血清中细胞因子的mRNA水平Fig.1 mRNA levels of serum cytokines were detected by qRT-PCRNote: *.P<0.05,#.P<0.05.
2.3白藜芦醇对STZ诱导的糖尿病大鼠模型中主动脉血管平滑肌细胞形态及数目的影响 倒置显微镜下观察从主动脉中分离出的血管平滑肌细胞形态及数目。如图3A所示,白藜芦醇可改善STZ诱导的糖尿病大鼠模型中血管平滑肌细胞形态的异常。图3B显示,STZ诱导糖尿病组大鼠主动脉血管平滑肌细胞数目明显少于对照组(P<0.05),对照组与对照+白藜芦醇组血管平滑肌细胞数目无明显差异。与STZ诱导糖尿病组相比,STZ+白藜芦醇组大鼠主动脉血管平滑肌细胞数目明显增多(P<0.05)。由此可见,白藜芦醇可改善STZ诱导的糖尿病大鼠主动脉血管平滑肌细胞形态及数目的异常。
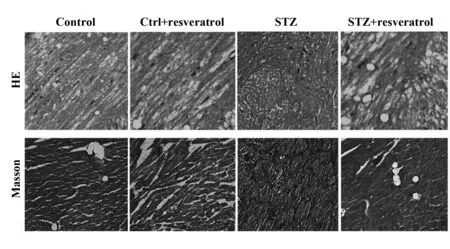
图2 HE和Masson染色分析心肌纤维化水平(×100)Fig.2 Myocardial fibrosis was analyzed by hematoxylin-eosin (HE) staining and Masson staining(×100)

图3 白藜芦醇对主动脉的血管平滑肌细胞形态及数目的影响Fig.3 Effect of resveratrol on cell morphology and number of vascular smooth muscle cells of aortaNote: *.P<0.05,#.P<0.05.
2.4白藜芦醇对STZ诱导的糖尿病大鼠模型中血管平滑肌细胞凋亡的影响 运用流式细胞术分析STZ诱导的糖尿病大鼠模型中血管平滑肌细胞凋亡情况。图4A显示,STZ诱导糖尿病组细胞凋亡数最多,STZ+白藜芦醇组次之,对照组与对照+白藜芦醇组细胞凋亡数最少。由图4B可知,STZ诱导糖尿病组细胞凋亡率明显高于对照组(P<0.05)。对照组与对照+白藜芦醇组细胞凋亡率无明显变化。STZ+白藜芦醇组细胞凋亡率明显低于STZ诱导糖尿病组(P<0.05)。由此可见,白藜芦醇可抑制STZ诱导的糖尿病大鼠血管平滑肌细胞凋亡。
2.5白藜芦醇对STZ诱导的糖尿病大鼠模型中血管平滑肌细胞凋亡标记蛋白表达的影响 为分析白藜芦醇对血管平滑肌细胞凋亡标记蛋白表达的影响,蛋白印迹检测Cleaved caspase-3、Cleaved caspase-9、Bax和Bcl-2的表达。图5A显示,在STZ诱导糖尿病组Cleaved caspase-3、Cleaved caspase-9、Bax的表达水平高于其他三组,Bcl-2的表达则低于其他三组。统计灰度值计算相对表达量,如图5B所示,STZ诱导糖尿病组Cleaved caspase-3、Cleaved caspase-9、Bax的相对表达量明显高于对照组,Bcl-2的表达低于对照组(P<0.05)。对照组与对照+白藜芦醇组Cleaved caspase-3、Cleaved caspase-9、Bax和Bcl-2的表达无明显差异。与STZ诱导糖尿病组相比,STZ+白藜芦醇组Cleaved caspase-3、Cleaved caspase-9、Bax表达明显降低,Bcl-2的表达明显升高(P<0.05)。上述结果进一步表明,白藜芦醇可抑制STZ诱导的糖尿病大鼠模型中血管平滑肌细胞凋亡。
2.6白藜芦醇对STZ诱导的糖尿病大鼠模型中血管平滑肌细胞PI3K/Akt信号通路相关蛋白表达的影响 通过蛋白印迹分析平滑肌细胞PI3K/AKT信号通路相关蛋白PI3K、p-PI3K、AKT、p-AKT的蛋白水平。图6A显示,PI3K和AKT在各组细胞中的蛋白水平无明显变化,p-PI3K和 p-AKT在STZ诱导糖尿病组中的表达量最低。如图6B、C所示,STZ诱导糖尿病组中p-PI3K/PI3K和p-AKT/AKT比率明显低于对照组(P<0.05)。对照组与对照+白藜芦醇组p-PI3K/PI3K和p-AKT/AKT比率无明显差异。与STZ诱导糖尿病组相比,STZ+白藜芦醇组p-PI3K/PI3K和p-AKT/AKT比率明显升高(P<0.05)。上述结果说明,在STZ诱导的糖尿病大鼠模型中血管平滑肌细胞p-PI3K/PI3K和p-AKT/AKT比率下降,白藜芦醇处理可抑制p-PI3K/PI3K和p-AKT/AKT比率的下降,激活PI3K/AKT信号通路。
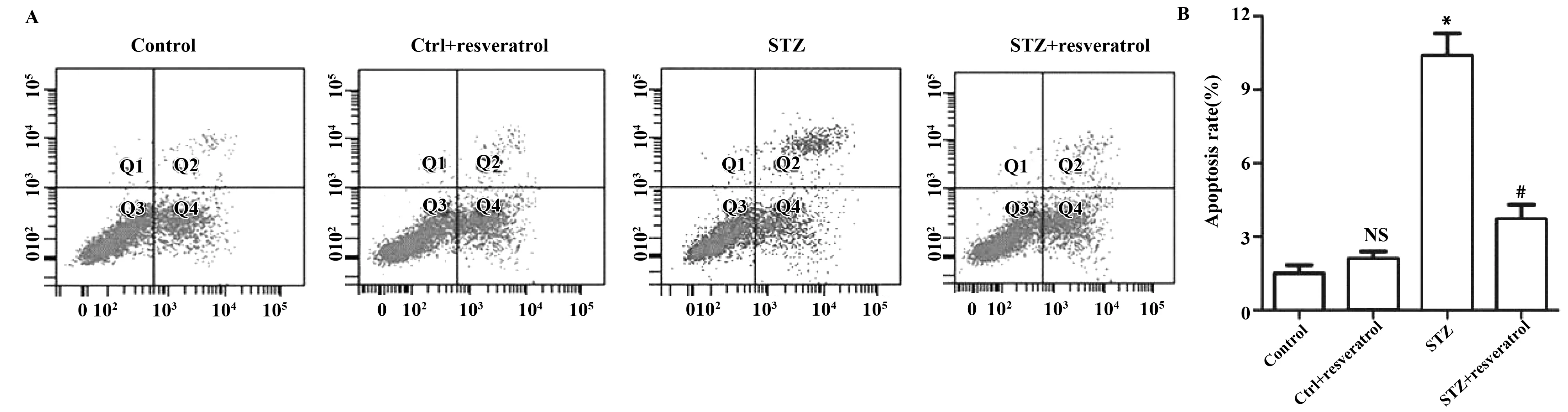
图4 白藜芦醇对血管平滑肌细胞凋亡的影响Fig.4 Effect of resveratrol on apoptosis of vascular smooth muscle cellsNote: *.P<0.05,#.P<0.05.

图5 白藜芦醇对血管平滑肌细胞凋亡标记蛋白表达的影响Fig.5 Effect of resveratrol on expression of apoptosis related proteins in vascular smooth muscle cellsNote: *.P<0.05,#.P<0.05.
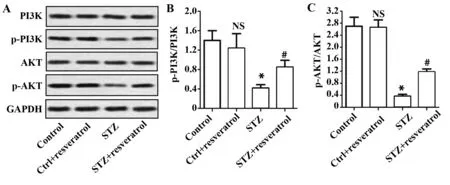
图6 白藜芦醇对血管平滑肌细胞PI3K/Akt信号通路相关蛋白表达的影响Fig.6 Effect of resveratrol on expression of PI3K/Akt related proteins in vascular smooth muscle cellsNote: *.P<0.05,#.P<0.05.
3 讨论
糖尿病主要包括1型糖尿病和2型糖尿病,2型糖尿病约占95%。目前同时治疗1型糖尿病和2型糖尿病的药物主要为胰岛素类似物和普兰林肽,针对2型糖尿病的治疗药物主要包括:二甲双胍、磺酰脲类药物、氯茴苯酸类药物、噻唑烷二酮类药物、胰高血糖素样肽1、二肽基肽酶4、钠依赖的葡萄糖转运蛋白2及溴麦角环肽等[9,10]。这些药物大多数都为化学合成,副作用较大。寻找天然安全的药物对糖尿病的治疗具有重要意义。越来越多的研究表明许多植物提取物在各类疾病的治疗中起着积极作用。
在各类疾病的进程中常常伴有各类细胞因子的变化,许多植物提取物可逆转细胞因子的变化。有研究显示白藜芦醇可减弱草酸诱导的人原发性肾上皮细胞MCP-1 mRMA水平的升高[11]。Zagotta等[12]发现白藜芦醇可降低发炎的脂肪组织中MCP-1 mRMA的水平。据报道卧茎景天提取物可抑制马兜铃酸诱导的肾小管上皮细胞损伤模型中MIF的表达[13]。有文献报道在脂多糖诱导的急性肺损伤大鼠模型中,白藜芦醇可抑制IL-18 mRMA水平的升高[14]。Xiao等[15]发现白藜芦醇可抑制糖尿病缺血性急性肾损伤大鼠模型中IL-18 mRMA水平的升高。本研究表明,白藜芦醇可抑制STZ诱导的糖尿病大鼠血清中MCP-1、MIF和IL-18的mRNA水平的升高。
糖尿病患者常会发生各种并发症,心肌纤维化加剧在这个过程中起着重要作用。许多植物提取物可改善心肌纤维化病变。Chen等[16]发现在缺血再灌注大鼠模型中芪参益气滴丸可改善心肌纤维化紊乱。有文献报道参芪化合物可降低糖尿病大鼠心肌纤维化水平[17]。有研究表明山楂果提取物可减轻肥胖症大鼠心肌纤维化程度[18]。据报道隐丹参醌可降低1型糖尿病大鼠模型中心肌纤维化程度[19]。Dong等[20]发现在缺血再灌注损伤大鼠模型中,白藜芦醇处理可改善心肌纤维紊乱。本研究结果显示,在STZ诱导的糖尿病大鼠模型中,白藜芦醇可改善心肌纤维化加剧。
白藜芦醇还具有调控细胞凋亡的作用。Sui等[21]发现白藜芦醇可抑制H2O2诱导的血管内细胞凋亡。有研究表明白藜芦醇可抑制丙酮醛诱导的肝癌细胞凋亡,减弱Cleaved caspase-3表达的升高[22]。据报道白藜芦醇可抑制β淀粉样蛋白诱导的神经细胞凋亡,减弱Bax表达的升高[23]。有数据显示白藜芦醇可降低高糖诱导的心肌细胞凋亡,减弱Bax的表达,提高Bcl-2表达[24]。本文结果表明,在STZ诱导的糖尿病大鼠模型中,白藜芦醇可抑制血管平滑肌细胞凋亡及凋亡标记蛋白Cleaved caspase-3、Cleaved caspase-9和Bax表达,增强Bcl-2表达。
PI3K/AKT信号通路在各类疾病中都发挥着重要作用。大量文献报道植物提取物可影响PI3K/AKT信号通路的活化。Ren等[25]发现从桑叶中提取的多糖可通过激活PI3K/AKT信号通路使高脂喂养STZ诱导的2型糖尿病大鼠肝葡萄糖代谢及胰岛素转运正常化。有研究发现在高脂喂养STZ诱导的2型糖尿病大鼠中,决明子可提高AKT磷酸化水平,减轻心肌缺血再灌注损伤[26]。Liu等[27]研究表明在糖尿病大鼠模型中柑橘果胶可通过上调p-AKT表达激活PI3K/AKT信号通路起到抗糖尿病的作用。据报道在早期脑损伤大鼠模型中,白藜芦醇可提高AKT磷酸化水平,抑制神经细胞凋亡[28]。有数据显示白藜芦醇可通过激活PI3K/AKT信号通路提高高糖诱导的PC12细胞活力,降低细胞凋亡[29]。Wu等[30]发现白藜芦醇可通过PI3K/AKT信号通路减轻糖尿病性心肌病变大鼠模型中心肌细胞的纤维化,抑制心肌细胞凋亡。本文结果显示,白藜芦醇可提高STZ诱导的糖尿病大鼠模型中血管平滑肌细胞PI3K和Akt的磷酸化水平,激活PI3K/AKT信号通路,抑制血管平滑肌细胞凋亡。
本研究表明,在STZ诱导的糖尿病大鼠模型中,白藜芦醇可抑制血清中细胞因子MCP-1、MIF和IL-18的mRNA水平的升高;改善心肌纤维化的加剧;减弱血管平滑肌细胞凋亡及凋亡标记蛋白Cleaved caspase-3、Cleaved caspase-9和Bax表达,提高Bcl-2表达;提高血管平滑肌细胞PI3K和AKT的磷酸化水平。综上所述,白藜芦醇可通过激活PI3K/AKT信号通路起到抑制糖尿病平滑肌细胞凋亡的作用。下一步计划研究白藜芦醇对眼病、肾病及神经性疾病等糖尿病并发症的影响,为开发糖尿病新药提供理论依据。
参考文献:
[1] Mays L.Diabetes mellitus standards of care[J].Nurs Clin North Am,2015,50(4):703-711.
[2] Chan JC,Zhang Y,Ning G.Diabetes in China:a societal solution for a personal challenge[J].Lancet Diabetes Endocrinol,2014,2(12):969-979.
[3] Alam U,Asghar O,Azmi S,etal.General aspects of diabetes mellitus[J].Handb Clin Neurol,2014,126:211-222.
[4] Szkudelski T,Szkudelska K.Resveratrol and diabetes:from animal to human studies[J].Biochim Biophys Acta,2015,1852(6):1145-1154.
[5] Kulkarni SS,Canto C.The molecular targets of resveratrol[J].Biochim Biophys Acta,2015,1852(6):1114-123.
[6] Bitterman JL,Chung JH.Metabolic effects of resveratrol:addressing the controversies[J].Cell Mol Life Sci,2015,72(8):1473-1488.
[7] Zordoky BN,Robertson IM,Dyck JR.Preclinical and clinical evidence for the role of resveratrol in the treatment of cardiovascular diseases[J].Biochim Biophys Acta,2015,1852(6):1155-1177.
[8] Carter LG,D′Orazio JA,Pearson KJ.Resveratrol and cancer:focus on in vivo evidence[J].Endocr Relat Cancer,2014,21(3):R209-R225.
[9] Vetere A,Choudhary A,Burns SM,etal.Targeting the pancreatic beta-cell to treat diabetes[J].Nat Rev Drug Discov,2014,13(4):278-289.
[10] Kleinberger JW,Pollin TI.Personalized medicine in diabetes mellitus:current opportunities and future prospects[J].Ann N Y Acad Sci,2015,1346(1):45-56.
[11] Hong SH,Lee HJ,Sohn EJ,etal.Anti-nephrolithic potential of resveratrol via inhibition of ROS,MCP-1,hyaluronan and osteopontin in vitro and in vivo[J].Pharmacol Rep,2013,65(4):970-979.
[12] Zagotta I,Dimova EY,Debatin KM,etal.Obesity and inflammation:reduced cytokine expression due to resveratrol in a human in vitro model of inflamed adipose tissue[J].Front Pharmacol,2015,6:79.
[13] Bai Y,Lu H,Hu L,etal.Effect of Sedum sarmentosum BUNGE extract on aristolochic acid-induced renal tubular epithelial cell injury[J].J Pharmacol Sci,2014,124(4):445-456.
[14] Jiang L,Zhang L,Kang K,etal.Resveratrol ameliorates LPS-induced acute lung injury via NLRP3 inflammasome modulation[J].Biomed Pharmacother,2016,84:130-138.
[15] Xiao YD,Huang YY,Wang HX,etal.Thioredoxin-interacting protein mediates NLRP3 inflammasome activation involved in the susceptibility to ischemic acute kidney injury in diabetes[J].Oxid Med Cell Longev,2016,2016:2386068.
[16] Chen JR,Wei J,Wang LY,etal.Cardioprotection against ischemia/reperfusion injury by QiShenYiQi Pill(R) via ameliorate of multiple mitochondrial dysfunctions[J].Drug Des Devel Ther,2015,9:3051-3066.
[17] Hu YH,Hou J,Zheng DZ,etal.Protection and mechanism of shenqi compound for diabetic angiopathy model rats[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2014,34(9):1078-1085.
[18] Diane A,Borthwick F,Wu S,etal.Hypolipidemic and cardioprotective benefits of a novel fireberry hawthorn fruit extract in the JCR:LA-cp rodent model of dyslipidemia and cardiac dysfunction[J].Food Funct,2016,7(9):3943-3952.
[19] Lo SH,Hsu CT,Niu HS,etal.Cryptotanshinone inhibits STAT3 signaling to alleviate cardiac fibrosis in type 1-like diabetic rats[J].2017,31(4):638-646.
[20] Dong W,Yang R,Yang J,etal.Resveratrol pretreatment protects rat hearts from ischemia/reperfusion injury partly via a NALP3 inflammasome pathway[J].Int J Clin Exp Pathol,2015,8(8):8731-841.
[21] Sui XQ,Xu ZM,Xie MB,etal.Resveratrol inhibits hydrogen peroxide-induced apoptosis in endothelial cells via the activation of PI3K/Akt by miR-126[J].J Atheroscler Thromb,2014,21(2):108-118.
[22] Seo K,Seo S,Han JY,etal.Resveratrol attenuates methylglyoxal-induced mitochondrial dysfunction and apoptosis by Sestrin2 induction[J].Toxicol Appl Pharmacol,2014,280(2):314-322.
[23] Ai Z,Li C,Li L,etal.Resveratrol inhibits beta-amyloid-induced neuronal apoptosis via regulation of p53 acetylation in PC12 cells[J].Mol Med Rep,2015,11(4):2429-2434.
[24] Guo S,Yao Q,Ke Z,etal.Resveratrol attenuates high glucose-induced oxidative stress and cardiomyocyte apoptosis through AMPK[J].Mol Cell Endocrinol,2015,412:85-94.
[25] Ren C,Zhang Y,Cui W,etal.A polysaccharide extract of mulberry leaf ameliorates hepatic glucose metabolism and insulin signaling in rats with type 2 diabetes induced by high fat-diet and streptozotocin[J].Int J Biol Macromol,2015,72:951-959.
[26] Fu F,Tian F,Zhou H,etal.Semen cassiae attenuates myocardial ischemia and reperfusion injury in high-fat diet streptozotocin-induced type 2 diabetic rats[J].Am J Chin Med,2014,42(1):95-108.
[27] Liu Y,Dong M,Yang Z,etal.Anti-diabetic effect of citrus pectin in diabetic rats and potential mechanism via PI3K/Akt signaling pathway[J].Int J Biol Macromol,2016,89:484-488.
[28] Zhou XM,Zhou ML,Zhang XS,etal.Resveratrol prevents neuronal apoptosis in an early brain injury model[J].J Surg Res,2014,189(1):159-165.
[29] Liu MH,Yuan C,He J,etal.Resveratrol protects PC12 cells from high glucose-induced neurotoxicity via PI3K/Akt/FoxO3a pathway[J].Cell Mol Neurobiol,2015,35(4):513-522.
[30] Wu Z,Huang A,Yan J,etal.Resveratrol ameliorates cardiac dysfunction by inhibiting apoptosis via the PI3K/Akt/FoxO3a pathway in a rat model of diabetic cardiomyopathy[J].J Cardiovasc Pharmacol,2017,70(3):184-193.

