分根区交替灌溉对马铃薯叶片超微结构及生理性状的影响
宿飞飞,孙慕华,李 勇,刘尚武,刘振宇,王绍鹏,万书明,陈 曦,高云飞,张静华,秦斐斐,胡林双,吕典秋*
(1.黑龙江省农业科学院博士后科研工作站,黑龙江哈尔滨 150030;2.黑龙江省农业科学院植物脱毒苗木研究所,黑龙江哈尔滨 150030;3.北大荒黑土薯业有限公司,黑龙江哈尔滨 150030;4.山东省花生研究所,山东青岛 266100)
分根交替灌溉(partial root-zone drying,PRD)是对作物不同区域根系进行干湿交替灌溉的新型节水灌溉方式。这种灌溉是一种适度的干旱作用于作物根系,植株从而产生干旱信号诱导产生相应的生理和应答基因活化,对于保证作物产量及提高灌溉水利用率均具有很重要作用。国内外关于逆境胁迫对植物细胞超微结构变化的研究亦有报道,大量研究发现逆境胁迫对植物细胞的膜脂过氧化有促进作用,主要表现在叶绿体、线粒体等细胞器的超微结构破坏和叶绿素降解等[1-3]。目前,不同灌溉模式下的植物适应能力研究仍比较少。
分根交替灌溉的研究领域主要集中应用于在葡萄[4]、西红柿[5-7]、辣椒[8]、梨[9]、芒果[10]等蔬菜和果树作物研究,侧重于提高水分利用率及节约灌溉水资源。而在马铃薯抗旱研究应用较少,且对抗旱诱导所要求的细胞微观和生理活性的研究还鲜见报道。鉴于此,笔者研究了马铃薯分根交替灌溉下叶片的超微结构和各项生理活性指标变化规律,挖掘分根交替灌溉技术潜力,将作物水分生理调控机制与作物高效用水技术紧密结合,为研发出非充分灌溉下的马铃薯高效抗旱节水栽培技术提供理论依据。
1 材料与方法
1.1材料供试材料是费乌瑞它的马铃薯早熟品种,原种级别,由黑龙江省马铃薯工程技术研究中心提供,规格为50 g,整薯播种,试验在黑龙江省马铃薯工程技术研究中心智能温室。
1.2方法选取规格大小45 cm×35 cm×17 cm花盆,为了防止花盆内植株两侧根系区域内土壤水分发生渗透,在盆沿上划线并标记将盆用硬质塑料板均匀分成2部分。每个花盆称取重量相同试验土5 kg,试验土配比为草炭∶炉灰∶土=3∶1∶2。试验共设2个处理,分别为正常浇水对照(CK)和干旱诱导处理(PRD)。干旱诱导处理(PRD)半边浇水量为对照处理(CK)的70%。每个花盆种植1株,每个处理15株,3次重复,共90株。
试验按照正常管理,直到植株长到7~8片叶(定植40 d)时开始采取控水处理。具体处理方法如下:控水处理当天对试验植株进行浇透水处理,对照植株供水方式与常规灌溉一致,每隔5 d浇水1次,使土壤相对含水量始终保持在75%~80%。干旱诱导处理是每隔5 d浇水到花盆的半边,另半边花盆保持干旱状态,之后轮流更替。对花盆两侧进行前后2次浇水处理,分别在两次半边含水量80%、60%、40%时进行6次取样,在控水15 d之后进行复水,复水后土壤含水量60%和40%时再取样,样品选取顶部叶片以下的第2~3片功能叶片。在不同生长时期各称取叶片制作透射、扫描电镜样品,用于测定植株细胞微观形态指标,并称取0.5 g植株的叶片,将其用锡箔纸包被,放于液氮中速冻,再放-80 ℃超低温冰箱中,用于生理指标测定。
1.3测定项目与方法
1.3.1产量测定。采收时期马铃薯块茎全部收获,并称其鲜重。
1.3.2氧化酶分析。将检测样品从-80 ℃冰箱中取出,放入已进行预冷处理的研钵中,加入7 mL内含1%的PVP、浓度为0.05 mol/L、pH 7.8的磷酸缓冲液7 mL(分次加入,不要一次性加入),并加入适量石英砂,于冰浴中研磨,研磨完全后转移至离心管中,12 000 r/min 4 ℃离心处理15 min得到上清液,即为酶提取液,将其定容至10 mL,放至有刻度的试管中,并置于4 ℃冰箱的冰浴中备用,用于测定氧化酶活性。
1.3.2.1超氧化物歧化酶(SOD)活性。超氧化物歧化酶的提取主要参照李合生NBT光还原法[11]。把备用酶液取出0.1 mL,分别编号并设2个对照,对照管以0.05 mol/L磷酸缓冲液代替酶液,在每个样品中依次加入0.05 mol/L磷酸缓冲液1.5 mL,130 mmol/L甲硫氨酸0.3 mL,750 μmol/L氮蓝四唑0.3 mL,100 μmoL/LEDTA二钠0.3 mL,20 μmoL/L核黄素0.3 mL,混合均匀定容至3 mL。将对照管于黑暗处,而处理各管在4 000 lx光照下反应5 min。反应结束后,将各个试管遮光放置,并以无光照的对照试管为空白,分别测定其他各管560 nm处的吸光度。
SOD活性公式:
(1)
式中,SOD活性是以鲜重酶单位每克表示;ACK表示有光强的CK管吸光度;AE为测试品管吸光度;V为测试品液体积,单位为mL;Vt为测试品用量,单位为mL;W为测试品鲜重,单位为g。
1.3.2.2过氧化物酶(POD)活性。过氧化酶测定采用张志良愈创木酚的方法[12]。将100 mol/L磷酸缓冲液50 mL和愈创木酚28 μL共2种液体混合,搅拌加热溶解后进行冷却,达到室温状态加入19 μL 30%H2O2混合备用。取编号的试管,将混合液提取3.0 mL加入缓冲液0.7 mL和酶液0.3 mL,对照为混合液提取3.0 mL加入1.0 mL的提取缓冲液。每隔60 s 测定1次波长吸光值,直至300 s,共测定5次。以每60 s内A470变化0.01为1个H2O2酶活性单位U,单位用g/min表示。
POD活性计算公式如下:
POD总活性=(ΔA470×VT)/(W×V1×0.01×t)
(2)
公式中:△A470表示反应时间内吸光度值的变化;W表示测样品的鲜重,单位g;t表示比色反应时间,单位min;VT表示酶液总体积,单位mL;V1表示测定酶液体积,单位mL。
1.3.2.3过氧化氢酶(CAT)活性。过氧化氢酶提取参照郝再彬高锰酸钾滴定法[13]。取玻璃管样品数加上1个对照管,在所有试管中加入pH 7.5的0.05 mol/L磷酸缓冲液4.5 mL,再加入H2O23.0 mL,在样品管中加入0.6 mL的酶液,在对照管中加入0.6 mL的0.05 mol/L磷酸缓冲液,混合后再加入0.1 mol/L过氧化氢0.9 mL,立即记录时间,混匀,在240 nm处测定吸光值,每隔1 min读数1次,共测4 min,全部测定后,计算酶活性。CAT活性计算公式如下:
CAT活性=(ΔA240×3.0×VT)/(0.043 6×V1×t×FW)
(3)
式中,ΔA240表示吸光值变化在240 nm波长;3.0表示体系体积;VT表示酶液总体积,单位mL;V1是测定粗酶液容积,单位mL;FW表示待测样品鲜重,单位g;0.043 6表示240 nm处1 μmol/L H2O2吸光值;t为加H2O2到最后一次读数时间,单位min。
1.3.2.4丙二醛(MDA)含量。丙二醛含量测定采用何文亮等[14]硫代巴比妥酸比色方法。称取硫代巴比妥酸0.6 g,并加入1 mol/L的NaOH溶液10 mL,再加入1.0 mol/L的盐酸溶液11 mL,定容到100 mL的容量瓶。从容量瓶中取出3 mL TBA溶液分别放于编好号的样品管及2个对照管中,在样品管中加入1.5 mL 0.05 mol/L磷酸缓冲液及1.5 mL相对应编号的酶液,在对照管中则直接加入3 mL 0.05 mol/L磷酸缓冲液,加完各溶液后混匀,放于铁架上置于沸水浴中反应15 min,在沸水浴中反应时要用保鲜膜盖上试管口。为了防止蒸发,反应结束后迅速倒入编好号的离心塑料管中,直接插入冰盒中,在10 000 g离心15 min,取上清液分别测定OD450、OD532和OD600的吸光值。
MDA活性=[6.45×(OD532-OD600)-0.56×OD450]×VT/W
(4)
式中,MDA活性表示以mol/kg;W表示样品鲜重,单位g;VT表示提取酶液总体积,单位mL。
1.4超微结构观察分别在土壤含水量80%、60%、40%和另半边含水量80%、60%、40%及植株复水后含水量60%、40%时取样,取样部位为顶部叶片以下的2~3片功能叶片,根据以下操作制作透射和扫描电镜样品。首先将样品置于载玻片上,切成3 mm×1 mm规格的样条,随后将其放入戊二醛(2.5%)中固定2 h,并用0.1 mol/L的磷酸缓冲液(pH 7.4)漂洗3次,每次10 min,漂洗后在通风橱用1%的四氧化锇固定3 h,再用0.1 mol/L磷酸缓冲液(pH 7.4)漂洗3次,每次10 min。再分别用浓度为30%、50%、70%、90%、100%的乙醇对样品进行对水处理,其中浓度为30%、50%、70%的处理5~10 min,浓度为90%、100%的处理10~15 min,浓度为100%的脱水处理3次,其余各进行l次脱水处理。用浓度为100%的乙醇∶丙酮(比例1∶l)进行置换1次,然后使用浓度100%的丙酮进行置换1次,每次置换10 min。
经过置换后则进行渗透处理,方法为用丙酮∶Epon812树脂(3∶1)渗透2 h,丙酮∶Epon512树脂(1∶l)渗透4 h,丙酮∶Epon812树脂(1∶3)渗透4 h,纯Epon812树脂则渗透过夜。在样品过夜渗透处理时,同时将包埋板放入35、45、60 ℃的恒温箱内加温聚合过夜处理。然后在修块机上利用超薄切片机对位于处理好的带有梯形尖端的包埋块内的组织进行切片,厚度为5 000~7 000 nm。用含支持膜的样品载网将制好的切片捞出,将其放入垫有消毒后的滤纸培养皿中。随后进行染色处理,方法为醋酸铀一柠檬酸铅双染色法,具体如下:首先用醋酸双氧铀对样品常温染色20 min,再用双重蒸馏水进行3次洗涤,随后用柠檬酸铅常温染色15 min,再用双重蒸馏水进行3次洗涤,最后用滤纸吸取水分,将处理完成的样品放入培养皿中待检。在扫描电镜下观察被处理过的叶片的气孔数量及开放程度,测量气孔的长、宽用于计算气孔的密度,统计气孔的开闭情况。观察时,选取具有代表性的视野拍照,每个处理的电镜观察统计至少为8个视野,取其平均值。用透射电镜观察处理后叶片的叶绿体、线粒体变化情况,并选取有代表性视野进行分析。
2 结果与分析
2.1不同灌溉处理下马铃薯细胞层超微结构比较
2.1.1不同灌溉处理及梯度土壤含水量下气孔形态比较。对比图1中a和d,b和e,c和f可知,在同等土壤含水量的情况下,2种处理的样品中气孔器的密度差异明显,其中PRD灌溉处理的马铃薯叶片气孔器密度较同等土壤含水量中CK处理的马铃薯叶片气孔器密度低。由此可见,PRD灌溉处理的马铃薯叶片对于干旱环境的应激反应更加强烈,在同等干旱条件下,PRD灌溉培养的马铃薯会更大限度地通过关闭气孔减少蒸腾作用来减弱与缓冲干旱伤害。即在同等干旱条件下,PRD灌溉马铃薯会更大限度通过关闭气孔减少蒸腾作用来减弱与缓冲干旱伤害。

注:a.CK处理80%含水量;b.CK处理60%含水量;c.CK处理40%含水量;d.PRD处理80%含水量;e.PRD处理60%含水量;f.PRD处理40%含水量Note:a.80% moisture content in CK treatment;b.60% moisture content in CK treatment;c.40% moisture content in CK treatment;d.80% moisture content in PRD treatment;e.60% moisture content in PRD treatment;f.40% moisture content in PRD treatment 图1 不同处理对植物气孔器密度影响Fig.1 Effects of different treatments on the stomatal density of plant
由图2可知,在80%含水量时,PRD与CK处理的2种植物叶片气孔的闭合程度差异不大,但随着土壤含水量的降低,PRD灌溉处理的马铃薯叶片气孔的闭合度显著增加。在同等土壤含水量情况下,2种处理样品中气孔器的闭合程度差异明显,其中PRD灌溉处理的马铃薯叶片气孔器出现较明显的闭合。由此可见,PRD灌溉处理的马铃薯叶片对于干旱环境的应激反应更加强烈,因此在同等干旱条件下,PRD灌溉培养的马铃薯会更大限度地通过关闭气孔减少蒸腾作用来减弱与缓冲干旱伤害。因此在同等干旱条件下,PRD灌溉培养的马铃薯会更大限度的通过关闭气孔减少蒸腾作用来减弱与缓冲干旱伤害。
2.1.2不同灌溉处理及梯度土壤含水量下叶片细胞超微结构比较。由图3可知,含水量80%时2种不同处理下马铃薯叶片各细胞器结构清晰完整,叶肉细胞排列比较疏松,中央液泡膜完整且液泡充盈,细胞核、核膜清晰可见。线粒体以较为规则的形态少量清晰分布于细胞质中,双层被膜结构完整,嵴清晰可见。

注:a.CK处理80%含水量;b.CK处理60%含水量;c.CK处理40%含水量;d.PRD处理80%含水量;e.PRD处理60%含水量;f.PRD处理40%含水量Note:a.80% moisture content in CK treatment;b.60% moisture content in CK treatment;c.40% moisture content in CK treatment;d.80% moisture content in PRD treatment;e.60% moisture content in PRD treatment;f.40% moisture content in PRD treatment 图2 不同处理对植物气孔器闭合程度的影响Fig.2 Effects of different treatments on the stomatal closure degree of plant
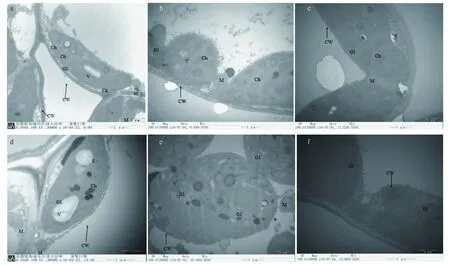
注:a.CK处理80%含水量;b.CK处理60%含水量;c.CK处理40%含水量;d.PRD处理80%含水量;e.PRD处理60%含水量;f.PRD处理40%含水量;Ch.叶绿体;CW.细胞壁;G1.基粒片层;M.线粒体;N.细胞核;S.淀粉粒;V.液泡Note:a.80% moisture content in CK treatment;b.60% moisture content in CK treatment;c.40% moisture content in CK treatment;d.80% moisture content in PRD treatment;e.60% moisture content in PRD treatment;f.40% moisture content in PRD treatment;Ch.Chloroplast;CW.Cell wall;G1.Grana lamella;M.Mitochondria;N.Nucleus;S.Starch grain;V.Vacuole 图3 不同处理对植物细胞结构的影响Fig.3 Effects of different treatments on the cell structure of plant
在试验初期含水量80%时,2个处理下的马铃薯叶片基粒片层排列有序且紧密,同时可以清晰看到较厚的基粒片层平行于叶绿体的长轴方向,对于植物光合作用十分有利。随着土壤含水率的下降,干旱刺激加重迫使马铃薯叶片叶绿体内的基粒片层膨胀溶解直至部分消融。此现象是叶片细胞严重受损、光合作用严重受阻的标志与信号。由图3可知,PRD处理下叶片细胞的受损程度低于CK处理。
由图3可知,在含水量80%时,片层清晰且有序排列、被膜和类囊体结构清晰的长椭圆形叶绿体紧贴细胞壁;含水量60%时叶绿体结构并未出现明显异常变化,这是因为马铃薯对于外界的干旱刺激有一定的自我调节能力。随着土壤含水量的降低,叶绿体结构受到不同程度的影响。含水量40%时叶绿体的超微结构开始变化,首先叶绿体基粒上的类囊体发生膨胀,从而导致间质片层的空间变大。基粒的排列不再保持有序,趋于随机的分布在叶绿体中。
含水量80%时2个处理对线粒体的影响较小,随着土壤含水量的逐渐下降,部分线粒体的嵴开始消融,线粒体肿胀,同时出现了叶绿体和线粒体部分彼此嵌合的现象。当土壤含水量降低至40%时,大部分线粒体已被膜结构包围直至降解消融。而另半边含水量的处理也与之相同。但PRD处理比CK的损害小,复水后干旱胁迫对线粒体造成的损害并没有恢复。
2.2不同灌溉处理对马铃薯抗氧化保护机制的影响当植物体受到外界的干旱刺激时,自身含氧自由基的生成和消融平衡会遭受到一定程度的破坏,对植物体造成损害。而抗氧化酶的存在可以促进含氧自由基的消融,有助于维持含氧平衡。SOD是植物体内重要的抗氧化酶中的一种,它的功效就是可以催化含氧自由基的消融反应。植物体内重要的抗氧化酶中还有POD,它与CAT均可以吸收和促进消融植物体内的H2O2,在干旱条件下有效保护了植物组织。然而,当含氧自由基产生的量超出了植物体抗氧化酶的处理能力时,含氧自由基过多积累会导致膜脂过氧化水平增高,这会使具有改变细胞膜功能的丙二醛(MDA)含量上升,导致细胞膜相对通透性变大,从而引起植物各种生理变化,对植物细胞造成伤害。
2.2.1不同灌溉处理对超氧化物歧化酶(SOD)活性的影响。SOD能够消除新陈代谢过程中生物体产生的有害物质,它是生命体固有的活性物质。SOD是植物处于逆境中最主要的一种抗氧化酶,防止超氧自由基对生物膜系统的氧化。它能够清除预防植物细胞的老化的活性氧和超氧阴离子自由基。
由图4可知,马铃薯在不同灌溉处理和不同时期SOD活性呈先逐渐上升后又逐渐下降,复水后逐渐上升的变化趋势。第一个含水量周期,即含水量80%~40%时SOD活性呈先缓慢上升后逐渐下降的变化趋势,且在土壤含水量60%时SOD氧化酶活性达到最大。这说明随着土壤含水量降低诱导叶片组织中SOD氧化酶表达,缓解由于干旱导致植株体内超氧离子的伤害,土壤含水量在60%以后逐渐下降,各个处理SOD活性下降,由于干旱胁迫严重导致缓解氧化伤害的能力降低。在复水生长过程中,又重新诱导 SOD活性上升,抵御活性氧对植株膜系统再次产生的伤害。2个灌溉处理中,PRD处理诱导SOD活性均显著高于CK处理,PRD处理对O2-清除能力较CK处理强,说明PRD处理诱导的SOD的抗氧化能力强于CK处理。

图4 不同处理对马铃薯SOD的影响Fig.4 Effects of different treatments on the SOD of potato
2.2.2不同灌溉处理对过氧化物酶(POD)活性的影响。过氧化酶POD是植物体内活性较高的一种氧化还原催化酶,它关系到植物体内多种生命活动作用,并直接影响着植物的生长发育状态。随着植物体的逐渐成熟,POD在植物体内的活性逐渐降低,因此POD活性剂含量状态是可间接用于检测植物体组织老化情况的一种指标。
由图5可知,PRD处理后的POD活性在各个时期均高于CK处理,且POD活性变化趋势相同。第一轮(含水量80%~40%)2种灌溉处理诱导的POD活性呈先逐渐上升后逐渐下降的变化趋势,当60%土壤含水量在POD活性达到最高值,之后随着干旱程度的加重POD活性逐渐下降。第二轮随着土壤含水量的逐渐降低POD活性也是呈先逐渐上升后逐渐下降的趋势,当含水量60%时POD的活性也达到最高。特别是复水后诱导了POD活性逐渐上升,抵御了活性氧对植株膜系统产生的伤害。

图5 不同处理对马铃薯POD的影响Fig.5 Effects of different treatments on the POD of potato
这说明适度的干旱可诱导POD活性上升,土壤含水量过高或过度干旱都会导致POD活性降低;此外还发现,与CK处理相比,经过PRD处理后的植株体内POD活性各时期均得到很大程度提高,说明植株在经过PRD诱导处理后会表现出更强的抗氧化能力。
2.2.3不同灌溉处理对过氧化氢酶(CAT)活性影响。过氧化氢酶(CAT)是一种酶类清除剂,它作为一种催化剂可在反应中促使H2O2的歧化分解,避免植物体内含氧自由基含量过高,对植物体造成损害。过氧化氢酶是催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物酶体内。
由图6可以看出,PRD处理后CAT活性在各个时期均高于CK处理,且CAT活性变化趋势相同。马铃薯植株在第一轮含水量处理中,即含水量80%~40%时,PRD和CK 2个灌溉处理中CAT活性变化总体呈先上升后下降的趋势,第二轮含水量处理中也同样;植株复水后,呈上升的变化趋势。因此,在马铃薯生长控水期间,适度干旱可诱导CAT活性升高,PRD处理能增强马铃薯CAT抗氧化活性,提高马铃薯植株对过氧化氢的清除能力,更有利于抵御过氧化氢积累对马铃薯植株造成的氧化伤害。

图6 不同处理对马铃薯CAT的影响Fig.6 Effects of different treatments on the CAT of potato
2.2.4不同灌溉处理对丙二醛(MDA)活性影响。丙二醛含量是植物体过氧化程度的重要评价指标之一。丙二醛是植物体过氧化反应的产物,因此当植物体过氧化程度较高时,丙二醛增加导致植物体内受损严重。植物体在逆境条件下易因细胞、组织、器官膜等过氧化严重受损而产生丙二醛。
从图7可以看出,随着土壤含水量下降,导致植株干旱程度逐渐加重,马铃薯植株MDA活性逐渐上升,植株复水后,干旱情况得到缓解,MDA活性又下降。在分根交替灌溉和对照2个灌溉处理中,不同土壤含水量时期PRD处理诱导的MDA活性均低于CK处理。
在不同的灌溉处理下,PRD和CK处理的丙二醛含量变化趋势是逐渐上升,即随着土壤含水量降低,植物受到活性氧伤害更加明显。由于PRD处理诱导的抗氧化酶活性增强,因而降低了丙二醛对植株的伤害。
2.3不同灌溉处理对马铃薯产量的影响从图8可以看出,在2种灌溉处理中,PRD处理产量高于CK处理,但是两者差异并不显著。该试验结果表明,在植株生长前期PRD处理使植株受到轻度的水分亏缺,从而可提高产量,原因是植株适度的水分亏缺诱导体内生化反应,复水后获得补偿生长效应,故分根交替灌溉有利于提高马铃薯产量。

图7 不同处理对马铃薯MDA的影响Fig.7 Effects of different treatments on the MDA of potato

图8 不同处理对产量的影响比较Fig.8 Effects of different treatments on the yield
3 结论与讨论
目前,不同植物的叶绿体、线粒体等超微结构在干旱等复杂环境下的变化,以及对外界刺激产生的自身调节生理机制得到了广泛研究。研究人员发现在干旱刺激下,叶片内较多的膜状结构会生成,较多的泡状结构填充在叶肉细胞中会代替叶绿体、线粒体等原有细胞器,导致液泡以及内膜系统降解叶肉细胞器,降低作物抗旱能力[15-20]。有研究表明,干旱刺激下叶肉细胞超微结构变化与抗旱性呈正相关,但关于分根交替灌溉马铃薯叶片及叶绿体超微结构变化与抗旱性关系至今仍鲜见报道。
该研究分根交替灌溉影响马铃薯植株的细胞指标,主要体现在对于植株叶片气孔器、叶绿体、线粒体形态的影响,在同等土壤含水量中气孔器密度较CK处理低,随着土壤含水量降低,气孔器出现明显闭合,PRD处理叶片细胞中叶绿体和线粒体的受损程度均低于CK处理,使马铃薯植株具有更好的抗旱性,并因此锻炼马铃薯对于干旱刺激的应激反应程度,提高马铃薯的抗旱能力。
根据Mehdy[21]提出的生物自由基伤害学说,当植物处于某种(如干旱)逆境条件下,植物细胞内产生活性氧自由基和清除代谢的平衡遭受破坏,使产生活性氧自由基的能力增强,进而加剧细胞的膜脂过氧化,给植物造成一定伤害[22-23]。同时植物在遭受干旱胁迫时,可以通过提高抗氧化酶活性来有效地防御和清除自由基保护细胞免受氧化伤害。该研究通过不同灌溉处理对抗氧化酶活性分析结果看出,随着土壤含水量的降低,叶片SOD、CAT和POD和MDA活性均是前期逐渐上升后期逐渐下降,其中PRD处理各项抗氧化酶活性均较CK处理高,MDA和活性氧的活性较对照处理低。这也证实前人的研究成果,即在水分胁迫强度比较轻、水分亏缺速度比较慢的情况下,马铃薯叶片中诱导抗氧化酶POD、SOD、CAT活性都是上升趋势,随着土壤水分胁迫逐渐加重,植株体内诱导抗氧化酶类POD、SOD和CAT活性下降,而MDA和活性氧等活性增强[24-27],这与该试验的结论一致。
综上所述,分根交替灌溉可以提高马铃薯抗旱能力。气孔器密度PRD处理较同等土壤含水量中CK处理低。随着土壤含水量的降低,马铃薯叶片气孔器出现明显闭合现象,PRD处理的叶片细胞中叶绿体和线粒体的受损程度均低于CK处理,从而更好保证了植株细胞器的功能,使马铃薯植株具有更好的抗旱性。分根交替灌溉能够增强马铃薯植株的抗氧化性。马铃薯植株受到不同程度干旱胁迫时,随着土壤含水量的降低,PRD处理的SOD、POD、CAT诱导活性均显著高于CK处理,即PRD处理对O2-、 H2O2清除能力强,更能抵御O2-、H2O2的积累对马铃薯植株造成的氧化伤害。同时,随着土壤含水量的降低,PRD处理诱导MDA活性均低于CK处理,说明植物受到活性氧毒害作用逐渐增强,PRD处理由于增强了抗氧化酶的活性,从而减少了丙二醛的积累。分根交替灌溉可在用水量降低的情况下保证马铃薯产量。马铃薯植株对干旱缺水反应敏感,PRD处理存在着补偿生长效应,PRD处理对马铃薯植株生长起促进作用。在植株生长前期PRD处理中,轻度的水分亏缺可提高产量,在同一生长期高于CK处理,PRD处理适当的水分亏缺可以促进马铃薯叶片的生长,在复水处理获得了一定补偿生长效应,加强了生理活性和干物质累积,因此适度水分亏缺后及时复水可使作物获得补偿生长效应,提高产量。
[1] 吴家梅,刘兆普,陈铭达,等.不同浓度的海水处理对库拉索芦荟叶绿素含量及其超微结构的影响[J].南京农业大学学报,2003,26(3):113-116.
[2] 华春,王仁雷.盐胁迫对水稻叶片光合效率和叶绿体超显微结构的影响[J].山东农业大学学报(自然科学版),2004,35(1):27-31.
[3] 于晶,周子珊,牟永潮,等.低温下不同抗寒性冬小麦叶片组织结构比较[J].东北农业大学学报,2010,41(4):7-11.
[4] DE SOUZA C R,MAROCO J R,DOS SANTOS T P,et al.Control of stomatal aperture and carbon uptake by deficit irrigation in two grapevine cultivars[J].Agriculture,ecosystems and environment,2005,106(2/3):261-274.
[5] QIN F F,DU F L,XU Q C,et al.Applications of xerophytophysiology in plant production:Partial root drying improves tomato crops[J].Journal of food,agriculture & environmet 2009,7(3/4):981-988.
[6] MOHAMMADKHANI A,NOURI EMAMZADEH M R,MIRJALILI A.Effect of partial root zone drying irrigation method on water use efficiency,yield and yield components of tomato[J].Journal of science and technology of agriculture and natural resources,2014,17(66):173-182.
[7] CASA R,ROUPHAEL Y.Effects of partial root-zone drying irrigation on yield,fruit quality,and water-use efficiency in processing tomato[J].Journal of horticultural science & biotechnology,2014,89(4):389-396.
[8] SHAO G C,GUO R Q,LIU N,et al.Photosynthetic,chlorophyll fluorescence and growth changes in hot pepper under deficit irrigation and partial root zone drying[J].African journal of agricultural research,2011,6(19):4671-4679.
[9] O’CONNELL M G,GOODWIN I.Water stress and reduced fruit size in micro-irrigated pear trees under deficit partial rootzone drying[J].Australian journal of agricultural research,2007,58(7):670-679.
[10] SPREER W,ONGPRASERT S,HEGELE M,et al.Yield and fruit development in mango(MangiferaindicaL.cv.Chok Anan)under different irrigation regimes[J].Agricultural water management,2009,96(4):574-584.
[11] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12] 张志良,瞿伟.植物生理学实验指导[M].3版.北京:高等教育出版社,2003.
[13] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2002.
[14] 何文亮,黄承红,杨颖丽,等.盐胁迫过程中抗坏血酸对植物的保护功能[J].西北植物学报,2004,24(12):2196-2201.
[15] 郑敏娜,李向林,万里强,等.水分胁迫对6种禾草叶绿体、线粒体超微结构及光合作用的影响[J].草地学报,2009,17(5):643-649.
[16] 白志英,李存东,屈平.干旱胁迫对小麦中国春-Synthetic 6x代换系叶片超微结构的影响[J].电子显微学报,2009,28(1):68-72.
[17] 李芳,王燕凌,李文兵,等.不同水位条件对刚毛柽柳叶绿体超微结构的影响[J].干旱区研究,2009,26(1):65-70.
[18] 郁慧,刘中亮,胡宏亮,等.干旱胁迫对5种植物叶绿体和线粒体超微结构的影响[J].植物研究,2011,31(2):152-158.
[19] 任丽花,黄敏敏,江枝和,等.干旱胁迫对圆叶决明叶片超微结构的影响[J].中国草地学报,2008,30(1):30-34.
[20] 桂意云,杨荣仲,周会.干旱及复水条件下甘蔗的生理响应与抗旱性简易鉴定[J].广东农业科学,2009(9):19-21.
[21] MEHDY M C.Active oxygen species in plant defense against pathogens[J].Plant Physiol,1994,105(2):467-472.
[22] SMIMOFF N.The role of active oxygen in the response of plants to water deficit and desiccation[J].New Phytol,1993,125(1):27-58.
[23] FRIDOVICH I.Superoxide dismutase[J].Ann Rev Biochem,1975,44:147-159.
[24] 赵丽英,邓西平,山仑.活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[25] 卢少云,陈斯平,陈斯曼,等.三种暖季型草坪草在干旱条件下脯氨酸含量和抗氧化酶活性的变化[J].园艺学报,2003,30(3):303-306.
[26] 阎秀峰,李晶,祖元刚.干旱胁迫对红松幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,1999,19(6):850-854.
[27] 王金胜,郭栋生,丁起盛,等.水分胁迫对玉米幼苗几种生理生化指标的影响及其与抗旱性的关系[J].山西农业大学学报,1992,12(2):137-140.

