氨(季铵)基纤维素的合成及应用进展
王 倩, 杜杰毫, 曹学锋, 敬 波, 谢海波*
(1. 贵州大学 材料与冶金学院 高分子材料与工程系,贵州 贵阳 550025;2. 湘潭大学 化学学院,湖南 湘潭 411105)
纤维素是地球上储量最丰富的生物可再生资源,具有价格低廉、易改性、可生物降解等特点[1]。纤维素衍生化是拓展纤维素应用的重要手段之一,如纤维素羧酸酯[2]、纤维素醚[3]、纤维素聚离子液体[4]、氨基纤维素[5]等功能材料,广泛应用于纺织、生物医用、光电、吸附与分离及水净化等领域[6-7]。其中,基于纤维素上的氨基进行化学修饰得到的氨(季铵)基纤维素衍生物,其分子链的侧基上含有亲水性羟基和氨(季铵)基,因此它们中基本具有亲水性,大部分溶于水。而且其分子量比较大,所以其水溶液具有一定的粘度、分散性较好和可以形成力学性能较好的水凝胶等特点[8-9]。从研究不同结构的氨(季铵)基纤维素的合成与性能之间的关系从而获得具有特殊功能的材料,使其在新的领域新的技术层面得到更加广泛的应用值得各国科学家不断去探索。
1 氨(季铵)基纤维素的合成方法
氨基化纤维素就是纤维素通过化学改性,在纤维素侧链引入氨基官能团,使纤维素从多羟基多糖转变为具有部分氨基化的碱性多糖聚合物;季铵基纤维素是基于氨基纤维素进一步季铵化或者使用小分子氨基化合物通过季铵化反应接枝到纤维素上。设计与制备氨(季铵)基纤维素的方法有很多,主要包括纤维素对甲苯磺酸酯亲核取代法、卤化纤维素取代法、纤维素环氧化合物开环法、纤维素酰胺酯胺解法、迈克尔加成反应策略、纤维素碳酸酯胺解法等。其中,用于氨(季铵)基纤维素制备最常见的方法是纤维素对甲苯磺酸酯亲核取代法。然而,基于不同的溶解体系、不同的反应条件和不同胺类/季铵类化合物,得到的氨(季铵)基纤维素的氨(季铵)基取代度和产率有着很大的差异。
1.1 纤维素对甲苯磺酸酯亲核取代法
将纤维素通过与小分子发生化学反应是纤维素衍生物的一种重要制备手段。纤维素对甲苯磺酸酯亲核取代法是基于纤维素羟基官能团通过亲核取代反应转化为良好的离去基团中间体,再在一定条件下被氨基化合物取代。其中,纤维素对甲苯磺酸酯中的磺酸酯基团为亲核取代反应的良好离去基团,被广泛用于氨基纤维素的制备,如图1中A1所示,或者将纤维素对甲苯磺酸酯的中间体先通过NaN3叠氮化,再通过还原剂将叠氮基团还原为胺,如图1中A2所示。
据McCormick等[10]首次报导,以DMAc/LiCl为纤维素溶剂,均相条件下和苯磺酸酰氯反应,制备了纤维素对甲苯磺酸酯,并进一步与不同结构的胺反应,制得氨基纤维素。Heinze等[11]用DMAc/LiCl复配型溶剂溶解纤维素后,以对苯甲磺酸氯为磺酰化试剂,制得了取代度为0.74~1.29的纤维素对甲苯磺酸酯,再通过纤维素对甲苯磺酸酯与 R(+)-、S(-)-和外消旋 1-苯乙胺发生亲核取代反应,制得取代度为 0.4~0.6即具有不同手性的氨基纤维素。
Klemm等[12]在McCormick等[10]和Heinze等[11]研究的基础上用DMAc/LiCl来溶解纤维素,得到取代度为0.4~2.3的纤维素对甲苯磺酸酯后,再在不同条件和不同温度下对邻二甲苯二胺进行取代,最后得到不同取代度的氨基纤维素。
Heinze等[13]也是将纤维素用DMAc/LiCl溶剂体系溶解,再与甲苯磺酰氯反应,得到纤维素对甲苯磺酸酯再与乙二胺进行反应,得到6-脱氧-6(X-氨基烷基)氨基纤维素衍生物,胺化不需要额外的溶剂,即所用的胺起始剂和反应介质的作用。亲核取代反应几乎完全进行,转化效率高。未被转化消耗的胺可以通过蒸馏容易地从沉淀中分离,并且损失较小(<20%),可用于进一步转化而不改变反应性。此方法为大规模制备氨基纤维素衍生物和更有效地进行应用试验提供了参考。Binder等[14]用 DMAc/LiCl体系溶解纤维素,制得了取代度为 1左右的纤维素对甲苯磺酸酯,并研究了不同种类的氨基化合物(一元胺、二元胺、三元胺等)和纤维素对甲苯磺酸酯反应的取代度的变化,最终得到取代度0.4~1.3的氨基纤维素。

图1 氨基纤维素的主要合成方法
氨可以与两个或多个甲苯磺酰基反应,从而使纤维素链交联,以及不完全取代在纤维素C-6上的反应,换句话说,这些反应不是区域选择性的。为了克服这些问题的一部分,Baumann等[15]使用DMAc/LiCl为溶剂,首先对纤维素进行对甲苯磺酰化,在不采取保护基的条件下,在二甲基亚砜为溶剂下,通过叠氮化反应,制备出C-6全取代、而C-2和C-3的对甲苯磺酰化不发生变化的叠氮化纤维素。随后,使用LiAlH4进行还原,其中C-6的叠氮基被还原为氨基,同时C-2和C-3的对甲苯磺酰基团完全去除,得到C-6全取代的氨基纤维素。
为了避免DMAc/LiCl做溶剂时,所带来的副反应以及纤维素降解等问题。Xie等[16]以绿色溶剂——离子液体做为溶剂,以吡啶为催化剂制备纤维素对甲基苯磺酸酯,最终得到取代度为0.73的氨基纤维素。基于此法,Xie等[17]用1-甲基-3烯丙基咪唑氯盐(AMIMCl)离子液体为溶剂,制备产率为62%、取代度为1.25的纤维素对甲基苯磺酸酯产物,再在以DMF为溶剂的情况下将对纤维素对甲基苯磺酸酯与四甲基胍进行亲核取代反应,最后得到取代度为0.18的胍基纤维素。如图2所示。

图2 对甲苯磺酸法制备胍基纤维素[17]
Zarth等[18]在N-甲基吡咯烷酮/LiCl和离子液体1-丁基-3-甲基咪唑氯盐(BMIMCl)为共溶剂下,通过在对甲苯磺酰氯存在下,研究N-甲基-2-吡咯烷酮、ε-己内酰胺、N-甲基-ε-己内酰胺和N-甲基-2-哌啶酮开环反应制备新型氨基纤维素酯。并通过改变反应条件,制备取代度在0.12~1.17的即具有聚电解质结构的新型氨基纤维素酯。研究发现,将样品溶解在水溶液中,在同等摩尔浓度下,粘度逐渐随取代升高而降低。如图3所示。

图3 酯内酰胺制备新型氨基纤维素酯[18]
另外,Heinze等[19]通过点击化学的方法制备氨基纤维素,首先通过 NaN3制备叠氮化纤维素,再用CuSO4⋅5H2O/维生素C钠来作为催化剂,通过与支化端炔类氨基化合物反应得到了具有超支化结构的氨基纤维素,但是,这种制备超支化结构的氨基纤维素的一个弊端为只能得到取代度较低(0.25)超支化氨基纤维素。值得庆幸的是由于超支化链末端含有很多氨基官能团,可以弥补这个弊端,如图4所示。

图4 超支化氨基化纤维素的合成[19]
Demircan等[20]通过简单的“超接枝反应”,使双(2-氯乙基)胺为衍生化试剂与纤维素甲苯磺酸酯发生取代反应,制备出一种新型可溶性的超支化纤维素氨基化合物。如图5所示。这种氨基化纤维素可以溶于各种极性非质子有机溶剂。离子液体作为新型溶解纤维素的绿色溶剂,相比于DMAc/LiCl体系,具有诸多独特的优点,其具有极低的蒸汽压、结构和性质易于调节、溶解能力强、易回收且不易燃等特点[21]。它将会成为制备纤维素对甲基苯磺酸酯的主要溶剂,进一步优化纤维素对甲苯磺酸酯亲核取代法制备氨(季铵)基纤维素的途径。

图5 超支化氯化聚乙烯亚胺化纤维素的合成[20]
1.2 卤化纤维素取代法
卤代纤维素反应法则是利用纤维素与二氯亚砜反应或环氧卤素化合物发生开环反应,得到氯化纤维素,接着利用带有氨基的化合物去取代氯化纤维素上的氯原子,得到带有氨基的纤维素衍生物。
Xie等[22]以SOCl2为氯化试剂,对纤维素进行化学修饰,制备取代度为0.89氯化纤维素,并以1-甲基咪唑为季铵化试剂进行反应,制备纤维素甲基咪唑氯盐化合物。如图6所示。
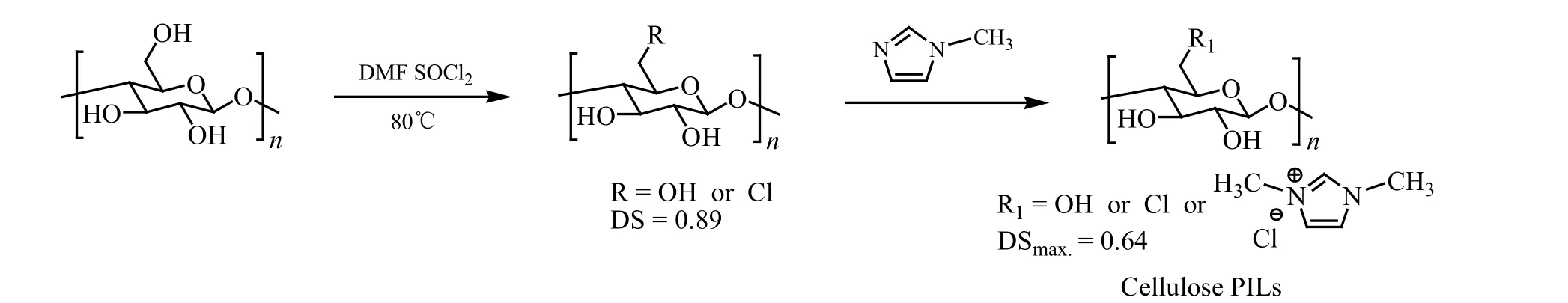
图6 氯化纤维素通过季铵化制备纤维素甲基咪唑氯盐化合物[22]
Bernard等[4]基于Xie等[22]的研究基础上,制备出纤维素咪唑和三乙胺两种氯盐化合物,并通过离子交换,制备具有不同阴离子(氟硼酸盐[BF4]-、六氟磷酸盐[PF6]-或双(三氟甲磺酰)亚胺[ [Tf2N]-)的纤维素衍生物。并研究不同阴离子其对CO2吸附能力的影响,结果表明阴离子结构直接影响CO2的吸附容量,两种纤维素衍生物的CO2的吸附容量按以下顺序增加:[Cl]-<[BF4]-<[Tf2N]-<[PF6]-。如图7所示。

图7 离子交换制备不同阴离子结构的纤维素衍生物[4]
Deng等[23]以相同的方法,以氯化亚砜为原料制备取代度为0.797的氯化纤维素,并在DMSO为溶剂下,以乙二胺为氨基化试剂,制备取代度为0.459的氨基纤维素(ADC)。该氨基纤维素可以进一步与3,5-二(1,1-二甲基乙基)-2-羟基苯甲醛反应,制备可以复配Mn(Ⅱ)的Salen配体,如图8所示。
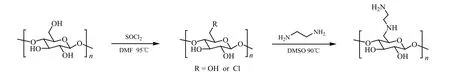
图8 氨基纤维素的制备[23]
1.3 纤维素环氧化合物开环法
Liesiene等[24]通过环氧氯丙烷与纤维素反应制备端基氯化纤维素,再发生闭环反应,制备具有环氧基团的纤维素衍生物。再与五乙撑六胺(PEHA)反应,制备具有固载酶蛋白功能的长支链的氨基纤维素,此法为开发一种新型的氨基纤维素提供了一种新的思路。如图9中d所示,之后又用戊二醛做原料,活化氨基纤维素。长氨基支链的引入使得氨基纤维素具有更高的活性,因此在亲和外源凝集素吸附剂的制备和酶的固定化上具有应用潜力。

图9 环氧氯丙烷制备氨基纤维素过程[24]

图10 功能化氨基纤维素的制备[25]
Xin等[25]以醋酸纤维素为原料,通过水解得到纤维素整体柱,再将其与环氧氯丙烷反应,得到环氧改性的纤维素整体柱,之后再与 1,2-双(2-氨基乙氧基)乙烷反应得到胺功能化的纤维素整体柱。最后再通过与戊二醛反应引入醛基,得到同时具备氨基和醛基的功能化纤维素。通过将纤维素改性,得到大的比表面积的均匀多孔材料,最小孔径达11.2 nm,可以在分离和纯化柱的固定相上得到应用。如图10所示。
Sharifi等[26]将纤维素粉末用NaOH水溶液处理后得到没有规则的紊乱结构的纤维素纤维。再将1,4-丁二醇二缩水甘油醚加入到悬浮液中进行表面改性处理,制备出环氧活化的纤维素,再与有机磷水解酶(ATCC 27551)反应,获得固载有有机磷水解酶的氨基纤维素。1,4-丁二醇二缩水甘油醚与纤维素的比为2 mL/g(V/w),仅需在30℃对纤维素修饰2.5 h,在磷酸盐缓冲液pH为7.0中将酶固定在活化纤维素上1 h即可得到所需氨基纤维素用于酶固定化过程。此过程操作简单,反应迅速,反应效率高。酶固定化过程如图11所示。
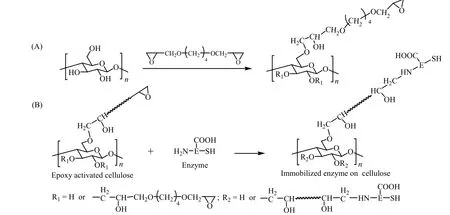
图11 固载有机磷水解酶的仲胺类纤维素的制备[26]
Zhang等[27]开发出一种低温水溶液溶解纤维素的技术,即氢氧化钠/尿素水溶液体系。该体系的发现大大促进了纤维素溶解理论及相关材料制备的研究。基于 NaOH/尿素/H2O水溶液体系,他们课题小组[28]成功通过开环反应成功将 3-氯-2-羟丙基三甲基氯化铵(HPTAC)接枝到纤维素链上,制得取代度为 0.20~0.63的季铵基纤维素,如图12所示。并通过条件优化,进一步研究了各种条件对纤维素取代度的影响,此方法只能获得取代度小于1的季铵基纤维素。

图12 NaOH/尿素/水溶液中纤维素和HPTAC的均相季铵化反应[27]
1.4 纤维素酰胺酯胺解法
酰胺酯胺解法是指将活化后的纤维素与带有氮原子的酯类化合物进行酰化反应,得到纤维素氨基酯。1984年Yoshio等[29]制备得到纤维素三(3,5-二甲基苯基氨基甲酸酯),主要过程如下:将纤维素悬浮分散在吡啶中,室温下氮气吹扫,再在纤维素悬浮液中加入 3,5-二甲基苯基异氰酸酯,产记为CDMPC。此法为合成氨基纤维素提供了一种新思路。Han等[30]在Yoshio等[29]的基础上,将CDMPC又与10-溴代癸酸进行衍生化反应,得到羧酸官能化纤维素三(3,5-二甲基苯基氨基甲酸酯),使其得到更广泛的应用。
Boufi课题组[31]以较温和的条件下,利用N,N-羰基二咪唑(CDI)作为活化剂对纤维素表面进行活化生成一种咪唑酯类纤维素衍生物,再利用氨基化合物进行修饰,制备出取代度为 0.2~0.42即具有氨基甲酸酯结构的氨基纤维素,如图13所示。该方法的发现,开发了一种从分子水平上制备氨基纤维素的方法,为氨基纤维素的制备提供新思路。

图13 N,N-羰基二咪唑活化纤维素纤维并与脂肪族十六胺(C16)的化学反应[31]
Vanthuyne等[32]首次报导了采用N-邻苯二甲酰基氨基酸氯化物将纤维素酰化来得到纤维素N-邻苯二甲酰基氨基酸酯。在吡啶存在的条件下,将纤维素与过量的N-邻苯二甲酰氨基酸氯化物在80℃反应40 h,纤维素几乎完全被酰化,取代度接近3。基于此,采用不同的酰化试剂(如N-邻苯二甲酰甘氨酸、亮氨酸、异亮氨酸等),同时制备了多种含氮取代基团的聚合物,其大部分化合物取代度约为3.0,如图14所示。

图14 纤维素N-邻苯二甲酰氨基酸酯(X=Cl)的合成[32]
Sirviö等[33]采用了一种新的反应性低共熔溶剂来合成纤维素氨基甲酸酯。以二甲基脲和氯化锌为原料,将纤维素溶解后再与甲基异氰酸酯反应得到DS为0.17的纤维素氨基甲酸酯,由于二甲基脲可以由二氧化碳制备,所以该方法可以用作可持续的方法来获得碱溶性的新型纤维素材料。Elschner等[34]将TMSC膜再生成纤维素,再在二甲基亚砜(DMSO)中用CDI活化,随后在水溶液中进行氨基与赖氨酸的结合得到纤维素赖氨酸氨基甲酸酯。如图15所示。纤维素赖氨酸氨基甲酸酯在pH=7.4情况下,可表现出低于纤维素六倍的纤维蛋白原的吸附性能(1.0 mg/m2)。
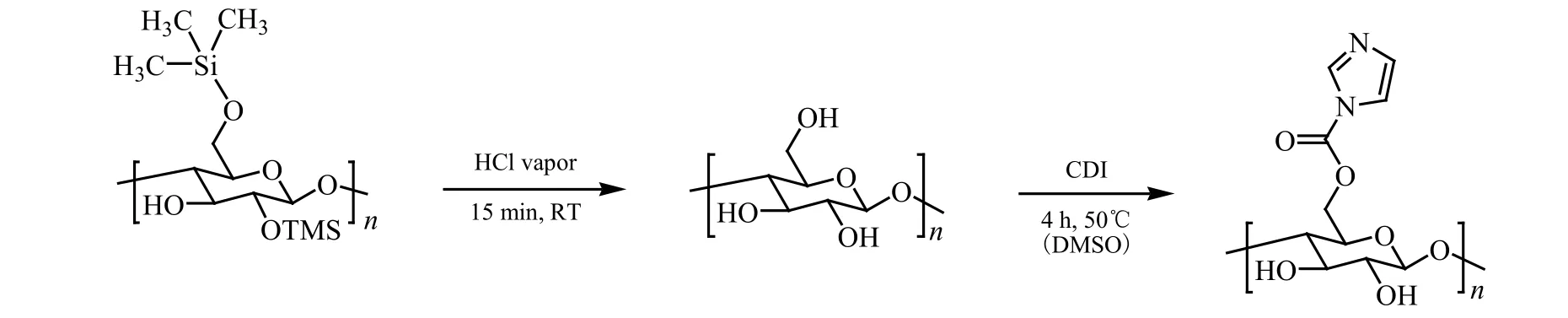
图15 纤维素赖氨酸氨基甲酸酯的合成[33]
1.5 迈克尔加成反应策略
这一方法主要是利用纤维素上的羟基与丙烯氰上的氢进行反应得到氰基纤维素,再用还原剂进行还原得到氨基纤维素,接着再继续双键上的氢与氨基上的氢进行反应,得到支链更多的氨基化纤维素。
现阶段大部分研究人员主要集中在如何将胺类小分子引入纤维素上,制备氨基纤维素。对于含氮的大分子如树状大分子、超支化分子等修饰纤维素却少有涉入。如图16所示,Hassan等[35]首先以丙烯腈(AN)为原料,通过烯醇缩合反应,制备氰基纤维素,并进一步用 BH3还原氰基纤维素制备树枝状氨基纤维素。为了得到末端含有氰基或者甲酯基团的树状的氨基纤维素,其中所用的氮源为丙烯腈和丙烯酸甲酯。最后以丙烯腈(AN)和丙烯酸甲酯(MA)为原料,制备末端树枝状氨基纤维素。并对制备的各个阶段氨基纤维素进行取代度测量和分析,发现第一代化合物有高达2.9的取代度,随着代数的增加,取代度逐渐减少,结晶度也相应减少,聚合物稳定性下降,形成的树枝状聚合物越来越不完善,这有可能是因为长支链导致空间位阻增大以及末端氨基官能团的相互作用引起的。

图16 不同纤维素基超支化衍生物的合成方案及理论结构[35]
1.6 纤维素碳酸酯胺解法
纤维素碳酸酯胺解反应是科学家近几年开始研究的方法,它是指纤维素首先与氯甲酸酯反应,制备纤维素碳酸酯,并通过与含有胺基的化合物发生反应,最终得到同时具备阴离子和阳离子性质的两性氨基纤维素酯。Pourjavadi等[36]首次使用氯甲酸苯酯为反应试剂,制备纤维素苯基碳酸酯。再以二乙氨丙酯为胺基化试剂,制备纤维素氨基酯,再通过季铵化反应,制备两性离子型氨基纤维素。如图 17所示。Heinze及其同事[37-43]分别通过DMA/LiCl和AMIMCl离子液体体系溶解纤维素,制备纤维素苯基碳酸酯,并通过胺解反应制备多种两性离子型氨基纤维素。
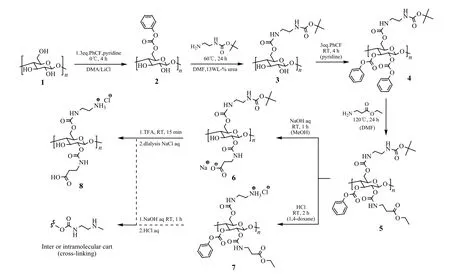
图17 纤维素碳酸酯制备氨基纤维素两性离子[36]
1.7 其他方法
其他合成氨基纤维素的方法有硝基还原法和氨基硅烷表面改性。其中,硝基还原法是通过制备硝基纤维素,再通过还原剂将硝基还原为氨基制备氨基纤维素。其中,Chang等[44]在LiCl/DMAc溶解纤维素,再与4-硝基苄基氯醚化反应,制备对硝基苄基纤维素,通过用铟金属作为还原剂、氯化铵的乙醇溶液中通过还原反应得到取代度约为1.0的氨基化苄基纤维素。
氨基硅烷表面改性是近几年广泛应用与纤维素表面改性制备氨基纤维素的方法,主要是使用氨基硅烷化合物,通过表面改性制备。Ha等[45-47]使用氨基丙基三乙氧基硅烷(APS)接枝微晶纤维素,并用于纤维素复合材料的相容剂,如图1G所示。Liang等[48]在纤维素纸上用氨基丙基三乙氧基硅烷表面改性制备氨基纤维素,并用于负载银纳米粒子,制备银纳米颗粒AgNPs。如图18所示。

图18 氨基纤维素纸负载银纳米粒子AgNPs[48]
2 氨(季铵)基纤维素的应用
由于带有氨基(季铵基)基团的纤维素兼具纤维素与氨基(季铵基)两者的优点,表现出良好的亲水性及生物功能性。因此,可以在酶的固载以及药物传递等方面得到应用,另外基于氨(季铵)基纤维素的特色结构,可以直接或者间接负载金属等手段来获得良好的催化活性等性质,可使其应用在催化、分离等领域。
2.1 基因载体以及酶蛋白的固载
氨(季铵)基纤维素因其良好的水溶性,大部分具有良好的生物相容性以及生物活性,被广泛应用于基因载体,发挥传递基因的作用。Zhou等[28]NaOH/尿素/水体系低温溶解体系中,制备一种新型的季铵化纤维素(QCs),并制备成基因载体,应用在生物分析上。一般来说,用于基因治疗的聚合载体的一个主要要求是没有细胞毒性。在293T细胞测试结果表明,季铵化纤维素的生物毒性要小于另外一种传统的聚已酰亚胺基因载体。并且,当QC-4/DNA复合物浓度为46 μg/mL时,293T细胞的活力为90%以上。同时,在荧光素酶测试中,检测到QCs/DNA具有较好的转染率,这说明在水溶液体系制备的季铵化纤维素是有效的基因载体试剂。

图19 寡聚胺结构氨基纤维素的制备[28]
Berlin P等[49]发现通过偶联剂共价固载氨基纤维素,可用于固载葡萄糖氧化酶(GOD)、辣根过氧化物酶(HRP)和乳酸氧化酶(LOD)的载体。通过实验结果表面,新型氨基纤维素膜,可以通过偶联反应形成酰胺或磺酰胺键,可使固定化HRP的酶活性比天然酶的酶活性高40倍。基于此,他们课题组[50]于2005年设计制备一类具有寡酰胺结构的新型氨基纤维素衍生物,如图 19所示。并制备成为透明的薄膜,再与Cu2+离子形成蓝色螯合物;该螯合物使氨基纤维素具有固载酶蛋白的功能,其固载方法如图20所示。结果表面,该固载方式分为两步,首先,Cu2+离子螯合物活化纤维素膜表面,然后氨基纤维素与酶蛋白发生键合固载。基于这种两步法固体酶蛋白的方法,可以通过控制酶蛋白和螯合剂的种类,并进一步改变酶蛋白与氨基纤维素的相互作用,来改变固载后的酶活性和酶稳定性。
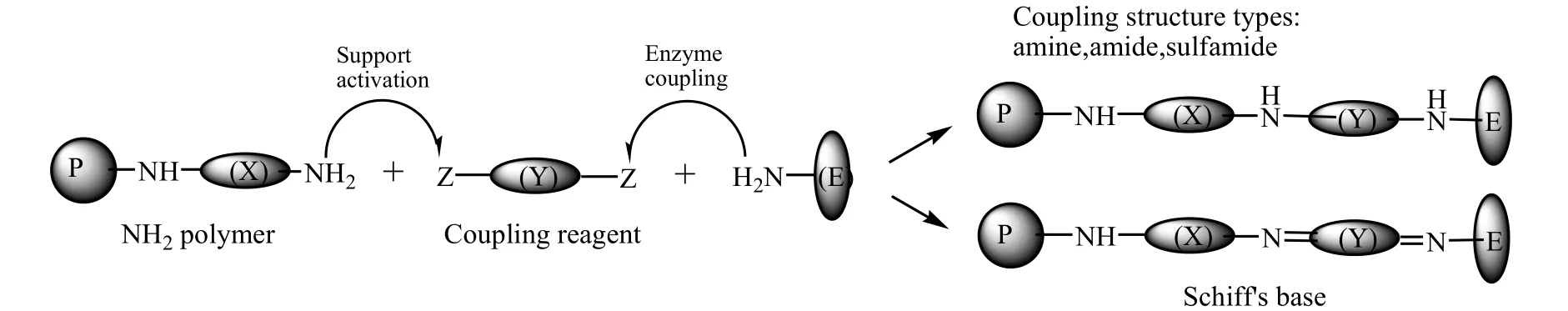
图20 双功能酶偶联反应的途径方案[50]
2.2 药物传递与缓释
氨(季铵)基纤维素由于具有良好的生物相容性和生物降解性,可以通过复杂的胺键之间的作用与药物结合,并应用于药物传递与缓释[51]。Movagharnezhad等[52]通过四步法成功制备出了可用于阿霉素递送的体外评估的氨基纤维素。首先,活化后的纤维素的羟基与溴乙酰溴的酰基溴反应。然后通过叠氮反应,使纤维素端基上带有叠氮基团。接着,通过采用TPP处理和添加NH2,NH2可以有利于将叠氮基转化成氨基。最后,为了得到具有算计结构的氨基纤维素,通过使用DCC/NHS活化叶酸,然后通过酰胺键将其反应到主链上。得到的氨基纤维素具有粗糙的表面,经过药物缓释实验证明,在pH=7.4的条件下,能够可控且缓慢释放,在药物释放和靶向传递药物上具有潜在的应用。
Songsurang等[53-54]成功合成了一种可用于口腔粘膜吸附胶束的疏水性的氨基纤维素药物载体,胶束直径为233 nm,其载药率可达到86.4%。并且,其体外释放性能也较好,在pH为6.8和7.4时,CPT持续释放至80%持续4天,这种载药率高、缓慢释放且持续时间长的特性使其在药物载体方面具有潜在的应用。
2.3 消毒、抗菌功能
通过在高分子材料中,加入少量氨(季铵)基纤维素,可制备具有抑制或杀灭细菌作用的材料。
Heinze等[55]使用静电纺丝技术,通过混纺6-脱氧-6(X-氨基烷基)氨基纤维素衍生物(TEAE)和聚乙烯醇(PVA)混合溶液,制备TEAE/PVA纳米纤维,并通过扫描电子显微镜(SEM)观察其对金黄色葡萄球菌的抗菌性能。结果表明,金黄色葡萄球菌在TEAE/PVA纳米纤维的生长速度极慢,不超过20%,表现出良好的抗菌活性。
Fei等[56]在弱碱性条件下,以3-氯-2-羟丙基三甲基氯化铵(CHPTAC)为原料,通过醚化反应制备表面具有季铵基团的纤维素膜(QCTA-RO膜),通过SEM测试,观察到改性后的QCTA-RO膜形态变化较小,表面粗糙不规则,结构保持较高亲水性,并表现出抗菌活性。对大肠杆菌和金黄色葡萄球菌的杀菌率分别是78.7%~89.0%和64.4%~76.6%,同时当渗透通量略有增加时,它们的盐抑制率高于92%。该膜的力学性能、热稳定性能不会因为改性而产生显著变化。这种将市售改性剂接枝到CTA-RO膜表面的简单温和的方法不仅可以形成具有良好抗菌性能的CTA-RO膜,而且在开发多功能CTA-RO膜的应用方面具有巨大的潜力。
Rouabhia等[57]将细菌纤维素上接枝几种不同的肽RGDC(精氨酸、甘氨酸、天冬氨酸、半胱氨酸)肽后再将庆大霉素引入表面进行进一步改性,产物记为BC-APTES。X射线光电子能谱(XPS)分析表明,BC-APTES的元素含量为0.7%,相当于接枝比为1∶12。由凝胶糖上测量的直径大小所确定,通过RGDC肽键移植到BC的庆大霉素显示显著的生长抑制。结果表明,产物在不损害人体纤维细胞的前提下对变形链球菌具有很好的杀菌效果,这一特性使其在改善伤口愈合等方面具有潜在应用。
2.4 催化作用
Xie等[22]利用季铵化制备咪唑盐纤维素,并对CO2和环氧化物的催化反应进行了研究。发现季铵化咪唑纤维素作为催化剂,在环氧化物为20 mmol、催化剂用量为5 mol%、CO2压力为2 MPa、120℃下反应6 h可达到较高的催化活性,其中环碳酸酯的产率最高可达95.1%,具有绿色、高效和可循环使用的特点。另外相比其他催化剂不同的是,此反应可在无溶剂条件下进行,使得分离和纯化更加简单,催化效率更高等,如图21所示。
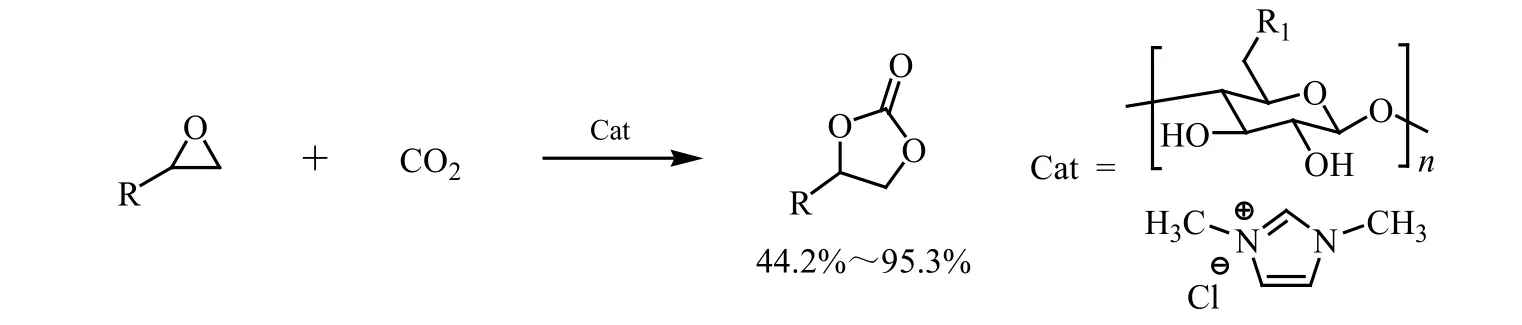
图21 季铵化咪唑纤维素对CO2和环氧化物制备环碳酸酯[22]
Wang等[58]分别使用 3-氨基丙基三甲氧基硅烷和3-(2-氨基乙基)-3-氨基丙基三甲氧基硅偶联剂与纤维素的羟基之间的缩合反应成功制备氨基功能化再生纤维素膜 RC-1N(3-氨基丙基三甲氧基硅烷),RC-2N(3-(2-氨基乙基)-3-氨基丙基三甲氧基硅),并在间歇反应器中催化Knoevenagel缩合反应。并分别对比改性前后的催化性能的变化,在相同催化剂量下,改性的RC-1N和RC-2N的产率分别从3%提高到40%和62%。因此,用氨基改性的纤维素膜有望成为在工业上应用的催化剂。
Sabaqian等[59]合成了负载有乙酸钯(Ⅱ)的偕胺肟官能化纳米纤维素磁性催化剂(纳米Fe3O4@AOFC/ Pd(Ⅱ)),可成功用于Suzuki交叉偶联反应。该催化剂在乙醇/水的溶剂中,55℃下反应45 min即可达到88%产率,其TON(转化摩尔数)为3385,TOF(转化频率)为4515,并且表现出高度稳定、易于处理、可生物降解、可回收以及重复使用等性质,为生物催化剂的合成提供了一种新的思路。
Heinze等[60]通过制备磁性纳米颗粒(MNPs),随后将不同聚合度的氨基纤维素用于涂覆MNPs,制备了有机介质中良好分散的杂化颗粒MNP@ACs,并用作原子转移自由基聚合中的非均相配体。并且可以在低Cu含量(5 ppm)制备分子量分布窄的(PDI<1.3)聚苯乙烯(PS),聚合后的混合颗粒可以通过外部磁场容易地除去,并在进一步的反应中重新使用。
Pourjavadi等[61]将咪唑型纤维素衍生物与碘化铜复配,得到新型负载的NHC-Cu(Ⅰ)配合物的纤维素衍生物,该物质可以一锅高效催化烷基/苄基卤化物或磺酸酯、末端炔烃与叠氮化钠在水合成1,2,3-三唑化合物。回收实验表明,催化剂循环使用7次后依然保持高达96%的催化活性。
Salimi等[62]通过3-氨基丙基三乙氧基硅烷(3-APTES)对纤维素进行连续表面官能化改性,再将表面的-NH2基团与琥珀酸酐缩合得到一种可在无溶剂条件下催化合成取代咪唑的催化剂,即(羧基-3-氧丙基氨基)-3-丙基甲硅烷基纤维素。这种催化剂在无溶剂、110℃条件下仅催化4-氯苯甲醛、苯偶酰和乙酸铵的反应4 h即可得到84%的咪唑衍生物,相比其他催化剂,具有高效、可重复使用、绿色环保、催化范围广且操作简单等优点,因此在催化合成医学化学的不同化合物方面具有潜在应用。
2.5 重金属的吸附与分离作用
Yu等[63]首先将棉纤维表面接枝甲基丙烯酸缩水甘油酯,然后将引入的环氧基与四亚乙基五胺(TEPA)反应(引发剂为硝酸铈铵)得到多氨基纤维素吸附剂。亚砷酸盐中砷的去除最佳pH值为7,去除砷酸盐中砷的最佳pH为5。另外砷(Ⅲ)的吸附容量为5.71 mg/g,更加显著的是砷(V)的吸附容量可高达75.13 mg/g。吸附行为受到共存离子的影响较小,吸附剂可以重复使用多达四个循环,而不会有太多的吸附能力损失。因此,多氨基纤维素可作为从水溶液中除去砷的潜在吸附剂。
Ghanbarian等[64]将磁性纤维素与三亚乙基四胺反应得到胺官能化的磁性纤维素。通过检测其对纤维素、MC和AFMC在最佳条件下的最大吸附容量分别为25、125和250 mg/g;因此证实改性步骤后吸附效率得到了改善,展现了其对于有毒Cr(Ⅵ)的生物吸附方面的潜力,如图22所示。Yakout等[65]将丙烯酰胺接枝到纤维素上,再与氧化石墨烯通过己二胺作为交联剂形成片层交联网状结构,水体中Cu(Ⅱ)和Pb(Ⅱ)可用该产物来吸附。通过吸附进行研究,发现合成的氨基纤维素可以达到较高的吸附效率(~51%)。这项工作对与自来水、海水均有较好的处理效果,并且价格低廉,为大规模水处理提供了一种良好的思路。

图22 铬(Ⅵ)吸附之前(a)和之后(b)的SEM图谱[64]
Lu等[66]成功的制备了表面氨基改性的细菌纤维素功能材料。通过利用该材料对 Cu2+、Pb2+和Cd2+等有毒金属离子的吸附热力学和动力学研究发现,其吸附为单分子层吸附,吸附过程是吸热反应,符合Langmuir等温方程和伪二阶动力学模型。
Tang等[67]合成了一种氨基纤维素用作Cu(Ⅱ)吸附剂,在pH范围为3.5~7.0的范围,该吸附剂均能保持在94%以上的吸附效率,最大吸附容量可达102 mg/g,与以往报导的类似吸附剂相比,其吸附性能大大改善,同时此吸附剂可以通过0.1 mol/L的HCl再生来达到循环使用的目的,因此此氨基纤维素可作为从水溶液中去除和回收Cu(Ⅱ)的高效吸附剂的一种新材料。
2.6 其他应用
2.6.1 pH 的检测
Stromberg等[68]基于8-羟基芘-1,3,6-三磺酸盐(HPTS)的特性性质,将其通过磺酰胺键接枝到醋酸纤维素上,制备新型氨基纤维素,并制成一种薄膜光学传感器。实验发现,该传感器在生理范围(pH 6.641~7.742)中表现出无与伦比的pH敏感性和准确性,精确度达到了0.002 9,并在细胞外溶液中pH改变后可观察到细胞印记和细胞延伸。该传感器的成功制备,将有效的促进生物生长方面的研究。
2.6.2 作为刺激响应颗粒乳化剂
Du等[69]提出了一种用非均相改性纤维素纳米晶体(CNCs)稳定的水性Pickering乳液及其作为功能聚苯乙烯微球制备模板的应用。首先,通过包括腙反应和酰胺化反应的两步化学过程,将 18碳烷基长链选择性引入 CNCs的还原端。然后将所获得的非均相改性 CNCs(CNC-C-18)用作乳化剂以形成水包油Pickering乳液。CNC-C-18纳米粒子含量低,可形成高度稳定的水包油Pickering乳液。由于18碳烷基链和CNC之间的C=N键连接的pH响应稳定性,引入的18碳烷基链可以在合适的酸性条件下完全裂解,并且这赋予形成的Pickering乳液pH触发的去乳化特性。用苯乙烯/二乙烯基苯混合油代替正己烷后,通过Pickering乳液自由基共聚反应生成具有富含氨基的表面交联PS微球,然后进行酸处理。NCs在作为制备刺激响应颗粒乳化剂方面展现出了良好的性能。
2.6.3 用于荧光标记的生物和成像系统
Tang等[70]使用L-亮氨酸氨基酸作为纤维素纳米晶体(CNCs)和pH指示剂染料的连接体成功制备了构建用于pH感测的荧光纳米颗粒。CDCF荧光素可通过L-亮氨酸氨基酸间隔连接成功标记到CNCs上,在标记反应过程中纤维素结构稳定。产生pH敏感的CNCs(F-A-CNCs)荧光特性由荧光光谱仪表征,并通过共焦激光扫描显微镜(CLSM)成像。结果表明,F-A-CNCs的荧光强度随着缓冲液的pH从2.28增加到10.84而增加。预计荧光标记的纳米颗粒在生物和成像系统中具有潜在的应用。
2.6.4 分离纯化
氨基纤维素在分离纯化领域也显示了较好的应用前景。李永波等[71]将氨基纤维素通过静态和动态研究实验,发现氨基纤维素对于溶液中砷的吸附可达到93%,在吸附过程中,洗脱回收率可达98%,并且流动速度快可大量吸附并且脱附容易,因此可作为一种较好的阴离子交换剂用来富集分离砷酸根离子。Pei等[72]通过对纤维素纳米纤维进行表面处理,纤维素上的羟基与缩水甘油基三甲基氯化铵进行季铵化反应得到季铵化的纳米涂层,分散体由宽度为1.6~2.1 nm长度为1.3~2.0 mm的单个纤维素Ⅰ型纳米纤维组成。尽管孔隙度很高(37%~48%),但是仍然表现出高的拉伸强度(200 MPa)和杨氏模量(10 GPa)。同时还具有高的阴离子染料吸附能力,其吸附能力随着纤维素三甲基氯化铵的含量增加而增加。
2.6.5 气体分离
Saedi等[73]设计制备一种同时具有三级胺和三唑环的新型氨基纤维素,并通过与聚乙烯醇共混,制备AC-PVA共混物,并以聚砜为基材,制备AC-PVA/聚苯乙烯PS复合薄膜。并研究该复合薄膜在不同的进料压力、温度和进料温度对CO2渗透、CH4的渗透和CO2/CH4选择性研究,结果发现该薄膜对CO2渗透率为10.64 GPU,CO2/CH4的选择透过系数为101.3,显示出较好的性质。
2.6.6 蛋白分离
基于张俐娜课题组的NaOH/尿素/水溶液体系[27],Dai等[74]将溶解后的纤维素溶液通过与醚化剂3-氯-2-羟丙基三甲基氯化铵进行季铵化反应,得到微球。接着,将壳聚糖在反相悬浮体系中与季铵化纤维素进行交联最终得到季铵化的纤维素/壳聚糖微球。该微球对来自β-酪蛋白、α-酪蛋白和脱脂奶的磷酸肽表现出非常高的选择性。由于纤维素、壳聚糖来源广泛,价格低廉,富集过程方便简单,因此为磷酸化肽的富集提供了一种简便易行的方法。
3 展望
现阶段对氨(季铵)基纤维素的研究主要集中在新的氨(季铵)基纤维素衍生物的合成以及它们在生物、化学化工、工农业中的应用上,而对于其新方法的探索和发现仍然发展缓慢。其中,纤维素及其衍生物的溶液粘度、取代度大小、反应能耗将成为制约氨(季铵)基纤维素研究发展的难点。今后工作,首先是合成不同结构、不同官能团的氨(季铵)基纤维素,以希望它们能提供更多的氨(季铵)基纤维素种类,进而为其应用的开发提供基础;其次要寻找到氨(季铵)基纤维素在生活生产中的应用,多发现问题,善于运用这些材料;另外,还要深入氨(季铵)基纤维素及其衍生物本身的结构和物理化学性能之间的关系,有了好的理论做指导,才能把氨(季铵)基纤维素材料得心应手的应用于现实生活中。最后,笔者相信氨(季铵)基纤维素的研究将会在各位学者和科学家的共同不懈努力下不断进步。
[1] Bledzki A K, Gassan J. Composites reinforced with cellulose based fibres[J]. Progress in Polymer Science, 1999, 24(2): 221-274.
[2] Danjo T, Iwata T. Syntheses of cellulose branched ester derivatives and their properties and structure analyses[J]. Polymer,2018, 137: 358-363.
[3] Ghori M U, Grover L M, Asare-Addo K, et al. Evaluating the swelling, erosion, and compaction properties of cellulose ethers[J]. Pharm Dev Technol, 2018, 23(2): 183-197.
[4] Bernard F L, Duczinski R B, Rojas M F, et al. Cellulose based poly(ionic liquids): Tuning cation-anion interaction to improve carbon dioxide sorption[J]. Fuel, 2018, 211: 76-86.
[5] Heinze T, Genco T, Petzold-Welcke K, et al. Synthesis and characterization of aminocellulose sulfates as novel ampholytic polymers[J]. Cellulose, 2012, 19(4): 1305-1313.
[6]汪森, 张蓉蓉, 许小娟, 等. 天然聚多糖的溶解机理及溶液性质[J]. 高分子学报, 2017, 9: 1426-1443.
[7]张金明, 张军. 基于纤维素的先进功能材料[J]. 高分子学报, 2010, 12: 1376-1398.
[8] Matthias Pohl, Nico Michaelis, Frank Meister, et al. Biofunctional surfaces based on dendronized cellulose[J].Biomacromolecules, 2009, 10(2): 382-389.
[9] Pohl M, Meister M F. Biofunctional surfaces based on dendronized cellulose[J]. Biomacromolecules, 2009, 10(2): 382-389.
[10] McCormick C L, Callais P A. Derivatization of cellulose in lithium chloride and N,N-dimethylacetamide solutions[J]. Polymer,1987, 28(13): 2317-2323.
[11] Heinze T, Koschella A, Magdaleno-Maiza L, et al. Nucleophilic displacement reactions on tosyl cellulose by chiral amines[J].Polymer Bulletin, 2001, 46(1): 7-13.
[12] Becher J, Liebegott H, Berlin P, et al. Novel xylylene diaminocellulose derivatives for enzyme immobilization[J]. Cellulose,2004, 11(1): 119-126.
[13] Heinze T, Pfeifer A, Koschella A, et al. Solvent-free synthesis of 6-deoxy-6-(ω-aminoalkyl)amino cellulose[J]. Journal of Applied Polymer Science, 2016, 133(39): 43987-43993.
[14] Mais U, Knaus S, Binder W, et al. Functionalization of Cellulose[M]. 2018.
[15] Liu C, Baumann H. Exclusive and complete introduction of amino groups and their N-sulfo and N-carboxymethyl groups into the 6-position of cellulose without the use of protecting groups[J]. Carbohydrate Research, 2002, 337(14): 1297-1307.
[16] Xie H, King A, Kilpelainen I, et al. Thorough chemical modification of wood-based lignocellulosic materials in ionic liquids[J].Biomacromolecules, 2007, 8(12): 3740-3748.
[17] Xie H, Cao X, Shan S, et al. Guanidine cellulose for biocompatible nanoparticles phase transfer[J]. Chemistry Select, 2017,2(32): 10555-10558.
[18] Zarth C S P, Koschella A, Pfeifer A, et al. Synthesis and characterization of novel amino cellulose esters[J]. Cellulose, 2011,18(5): 1315-1325.
[19] Pohl M, Michaelis N, Meister F, et al. Biofunctional surfaces based on dendronized cellulose[J]. Biomacromolecules, 2009,10(2): 382-389.
[20] Demircan D, Zhang B. Facile synthesis of novel soluble cellulose-grafted hyperbranched polymers as potential natural antimicrobial materials[J]. Carbohydrate Polymers, 2017, 157: 1913-1921.
[21] Zhu S, Wu Y, Chen Q, et al. Dissolution of cellulose with ionic liquids and its application: A mini-review[J]. Green Chemistry,2006, 8(4): 325-327.
[22] Chen Q, Peng C, Xie H, et al. Cellulosic poly(ionic liquid)s: Synthesis, characterization and application in the cycloaddition of CO2to epoxides[J]. Rsc Advances, 2015, 5(55): 44598-44603.
[23] Deng X, Zhi Y, Shan S, et al. Effective and reusable microcrystalline cellulosic Salen complexes for epoxidation of alpha-pinene[J]. Cellulose, 2018, 25(2): 1281-1289.
[24] Jolita Aniulyte J B, and Jolanta Liesiene,. Activation of cellulose-based carriers with pentaethylenehexamine[J]. Proc Estonian Acad Sci Chem, 2006, 55(2): 61-69.
[25] Xin Y, Xiong Q, Bai Q, et al. A hierarchically porous cellulose monolith: A template-free fabricated, morphology-tunable, and easily functionalizable platform[J]. Carbohydrate Polymers, 2017, 157: 429-437.
[26] Sharifi M, Robatjazi S-M, Sadri M, et al. Covalent immobilization of organophosphorus hydrolase enzyme on chemically modified cellulose microfibers: Statistical optimization and characterization[J]. Reactive and Functional Polymers, 2018, 124: 162-170.
[27] Cai J, Zhang L, Zhou J, et al. Novel fibers prepared from cellulose in NaOH/urea aqueous solution[J]. Macromolecular Rapid Communications, 2004, 25(17): 1558-1562.
[28] Song Y, Sun Y, Zhang X, et al. Homogeneous quaternization of cellulose in NaOH/urea aqueous solutions as gene carriers[J].Biomacromolecules, 2008, 9(8): 2259-2264.
[29] Okamoto Y, Kawashima M, Hatada K. Chromatographic resolution. 7. Useful chiral packing materials for high-performance liquid chromatographic resolution of enantiomers: Phenylcarbamates of polysaccharides coated on silica gel[J]. Journal of the American Chemical Society, 1984, 106(18): 5357-5359.
[30] Han M, Jin X, Yang H, et al. Controlled synthesis, immobilization and chiral recognition of carboxylic acid functionalized cellulose tris(3,5-dimethylphenylcarbamate)[J]. Carbohydrate Polymers, 2017, 172: 223-229.
[31] Alila S, Ferraria A M, Botelho do Rego A M, et al. Controlled surface modification of cellulose fibers by amino derivatives using N,Nʼ-carbonyldiimidazole as activator[J]. Carbohydrate Polymers, 2009, 77(3): 553-562.
[32] Vanthuyne N, Roussel C. Cellulose chiral induction during the synthesis of cellulose N-phthaloyl-amino acid esters[J].Cellulose, 2013, 20(4): 2057-2067.
[33] Sirviö J A, Heiskanen J P. Synthesis of alkaline-soluble cellulose methyl carbamate using a reactive deep eutectic solvent[J].Chem Sus Chem, 2017, 10(2): 455-460.
[34] Elschner T, Bračič M, Mohan T, et al. Modification of cellulose thin films with lysine moieties: A promising approach to achieve antifouling performance[J]. Cellulose, 2017, 25(1): 537-547.
[35] Hassan M L. Preparation and thermal stability of new cellulose-based poly(propylene imine) and poly(amido amine)hyperbranched derivatives[J]. Journal of Applied Polymer Science, 2006, 101(3): 2079-2087.
[36] Pourjavadi A, Seidi F, Afjeh S S, et al. Synthesis of soluble N-functionalized polysaccharide derivatives using phenyl carbonate precursor and their application as catalysts[J]. Starch/Staerke, 2011, 63(12): 780-791.
[37] Elschner T, Heinze T. A promising cellulose-based polyzwitterion with pH-sensitive charges[J]. Beilstein J Org Chem, 2014, 10: 1549-1556.
[38] Elschner T, Scholz F, Miethe P, et al. Rapid flow through immunoassay for CRP determination based on polyethylene filters modified with omega-aminocellulose carbamate[J]. Macromol Biosci, 2014, 14(11): 1539-1546.
[39] Heinze T, Wondraczek H, Elschner T, et al. Process for the functionalization of a surface: WO, 2014147168A1[P]. 2014-9-25.
[40] Elschner T, Doliska A, Bracic M, et al. Film formation of ω-aminoalkylcellulose carbamates - A quartz crystal microbalance(QCM) study[J]. Carbohydr Polym, 2015, 116: 111-116.
[41] Elschner T, Heinze T. Cellulose carbonates: A platform for promising biopolymer derivatives with multifunctional capabilities[J]. Macromolecular Bioscience, 2015, 15(6): 735-746.
[42] Elschner T, Ludecke C, Kalden D, et al. Zwitterionic cellulose carbamate with regioselective substitution pattern: A coating material possessing antimicrobial activity[J]. Macromol Biosci, 2016, 16(4): 522-534.
[43] Salimi H, Aryanasab F, Banazadeh A R, et al. Designing syntheses of cellulose and starch derivatives with basic or cationic N-functions: Part Ⅰ-cellulose derivatives[J]. Polymers for Advanced Technologies, 2016, 27(1): 5-32.
[44] Chang S, Condon B, Edwards J V. Preparation and characterization of aminobenzyl cellulose by two step synthesis from native cellulose[J]. Fibers and Polymers, 2010, 11(8): 1101-1105.
[45] Kim H, Park S, Yang Y, et al. Investigation of optimum amino group introduction conditions to microcrystalline cellulose(MCC) surface by silanization[J]. Polymer-Korea, 2016, 40(6): 925-932.
[46] Kim H, Yang Y, Hwang K, et al. Preparation and properties of polyethylene composites using microcrystalline cellulose (MCC)with carbon dioxide adsorbable amino groups as filler[J]. Polymer-Korea, 2017, 41(6): 1011-1018.
[47] Yang Y, Kim H, Lim K-H, et al. Preparation and characterization of polyurethane composites using amino-functionalized microcrystalline cellulose (MCC) as fillers[J]. Polymer-Korea, 2018, 42(1): 147-156.
[48] Liang M, Zhang G, Feng Y, et al. Facile synthesis of silver nanoparticles on amino-modified cellulose paper and their catalytic properties[J]. Journal of Materials Science, 2018, 53(2): 1568-1579.
[49] Tiller J C, Rieseler R, Berlin P, et al. Stabilization of activity of oxidoreductases by their immobilization onto special functionalized glass and novel aminocellulose film using different coupling reagents[J]. Biomacromolecules, 2002, 3(5): 1021-1029.
[50] Jung A, Berlin P. New water-soluble and film-forming aminocellulose tosylates as enzyme support matrices with Cu2+-chelating properties[J]. Cellulose, 2005, 12(1): 67-84.
[51]宋杰, 侯永发. 纤维素衍生物在固定酶和药物中的应用[J]. 天然产物研究与开发, 1997, 1: 71-76.
[52] Movagharnezhad N, Najafi Moghadam P. Folic acid linked amino-cellulose for in vitro evaluation of doxorubicin delivery:Synthesis and characterization[J]. Starch Stärke, 2016, 68(1-2): 92-99.
[53] Songsurang K, Siraleartmukul K, Muangsin N. Mucoadhesive drug carrier based on functional-modified cellulose as poorly water-soluble drug delivery system[J]. Journal of Microencapsulation, 2015, 32(5): 450.
[54] Songsurang K, Siraleartmukul K, Muangsin N. Mucoadhesive drug carrier based on functional-modified cellulose as poorly water-soluble drug delivery system[J]. J Microencapsul, 2015, 32(5): 450-459.
[55] Roemhild K, Wiegand C, Hipler U-C, et al. Novel bioactive amino-functionalized cellulose nanofibers[J]. Macromolecular Rapid Communications, 2013, 34(22): 1767-1771.
[56] Fei P, Liao L, Meng J, et al. Non-leaching antibacterial cellulose triacetate reverse osmosis membrane via covalent immobilization of quaternary ammonium cations[J]. Carbohydrate Polymers, 2018, 181: 1102-1111.
[57] Rouabhia M, Asselin J, Tazi N, et al. Production of biocompatible and antimicrobial bacterial cellulose polymers functionalized by RGDC grafting groups and gentamicin[J]. ACS Appl Mater Interfaces, 2014, 6(3): 1439-1446.
[58] Wang W, Bai Q, Liang T, et al. Preparation of amino-functionalized regenerated cellulose membranes with high catalytic activity[J]. International Journal of Biological Macromolecules, 2017, 102: 944-951.
[59] Sabaqian S, Nemati F, Nahzomi H T, et al. Palladium acetate supported on amidoxime-functionalized magnetic cellulose:Synthesis, DFT study and application in Suzuki reaction[J]. Carbohydrate Polymers, 2017, 177: 165-177.
[60] Fidale L C, Nikolajski M, Rudolph T, et al. Hybrid Fe3O4@amino cellulose nanoparticles in organic media - Heterogeneous ligands for atom transfer radical polymerizations[J]. Journal of Colloid and Interface Science, 2013, 390: 25-33.
[61] Pourjavadi A, Habibi Z. Cellulose-immobilized NHC-Cu(Ⅰ) complex: An efficient and reusable catalyst for multicomponent synthesis of 1,2,3-triazoles[J]. RSC Adv, 2015, 5(120): 99498-99501.
[62] Salimi M, Nasseri M A, Chapesshloo T D, et al. (Carboxy-3-oxopropylamino)-3-propylsilylcellulose as a novel organocatalyst for the synthesis of substituted imidazoles under solvent-free conditions[J]. RSC Adv, 2015, 5(43): 33974-33980.
[63] Yu X, Tong S, Ge M, et al. Synthesis and characterization of multi-amino-functionalized cellulose for arsenic adsorption[J].Carbohydrate Polymers, 2013, 92(1): 380-387.
[64] Ghanbarian M, Nabizadeh R, Nasseri S, et al. Potential of amino-riched nano-structured MnFe2O4@cellulose for biosorption of toxic Cr (Ⅵ): Modeling, kinetic, equilibrium and comparing studies[J]. International Journal of Biological Macromolecules,2017, 104: 465-480.
[65] Yakout A A, El-Sokkary R H, Shreadah M A, et al. Cross-linked graphene oxide sheets via modified extracted cellulose with high metal adsorption[J]. Carbohydrate Polymers, 2017, 172: 20-27.
[66] Lu M, Zhang Y-m, Guan X-h, et al. Thermodynamics and kinetics of adsorption for heavy metal ions from aqueous solutions onto surface amino-bacterial cellulose[J]. Transactions of Nonferrous Metals Society of China, 2014, 24(6): 1912-1917.
[67] Tang Y, Ma Q, Luo Y, et al. Improved synthesis of a branched poly(ethylene imine)-modified cellulose-based adsorbent for removal and recovery of Cu(Ⅱ) from aqueous solution[J]. J Appl Polym Sci, 2013, 129(4): 1799-1805.
[68] Stromberg N, Mattsson E, Hakonen A. An imaging pH optode for cell studies based on covalent attachment of 8-hydroxypyrene-1,3,6-trisulfonate to amino cellulose acetate films[J]. Analytica Chimica Acta, 2009, 636(1): 89-94.
[69] Du W, Guo J, Li H, et al. Heterogeneously modified cellulose nanocrystals-stabilized pickering emulsion: Preparation and their template application for the creation of PS microspheres with amino-rich surfaces[J]. Acs Sustainable Chemistry & Engineering,2017, 5(9): 7514-7523.
[70] Tang L, Li T, Zhuang S, et al. Synthesis of pH-sensitive fluorescein grafted cellulose nanocrystals with an amino acid spacer[J].Acs Sustainable Chemistry & Engineering, 2016, 4(9): 4842-4849.
[71]李永波, 窦艳梅. 通过氨基纤维素对砷酸根富集性能的研究[J]. 沈阳大学学报(自然科学版), 1998, 4: 82-86.
[72] Pei A, Butchosa N, Berglund L A, et al. Surface quaternized cellulose nanofibrils with high water absorbency and adsorption capacity for anionic dyes[J]. Soft Matter, 2013, 9(6): 2047-2055.
[73] Saedi S, Seidi F, Moradi F, et al. Preparation and characterization of an amino-cellulose (AC) derivative for development of thin-film composite membrane for CO2/CH4separation[J]. Starch-Starke, 2016, 68(7-8): 651-661.
[74] Dai L, Jin S, Fan M, et al. Preparation of quaternized cellulose/chitosan microspheres for selective enrichment of phosphopeptides[J]. Analytical and Bioanalytical Chemistry, 2017, 409(13): 3309-3317.

