贵州特色苦荞食品黄酮与免疫调节作用评价
李勇,曾海英,2,*
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省薏苡工程技术研究中心,贵州贵阳550025)
随着人们生活质量的提高,社会对健康的意识逐渐增强,保健食品越来越受到人们的喜爱,荞麦作为一种药食同源的杂粮不仅营养丰富而且具有很强的保健作用,现代研究表明:苦荞黄酮有降血糖血脂、抗疲劳、抗缺血、抗氧化、增强机体免疫力等多种保健作用[1-3]。尽管苦荞黄酮保健作用强,但不同产品、不同工艺,苦荞食品黄酮的保留率及保健功效特性等是否存在较大差异,或荞麦的添加量与苦荞食品的保健功效关联性等研究均未见报道。因此,本研究着眼于贵州荞麦,以地方特色荞食为研究对象,通过对苦荞茶、苦荞米、苦荞面粉、苦荞挂面以及苦荞羹5类荞食进行黄酮组分分析,并对其免疫调节作用进行综合评价,采用模糊数学综合评价法得出5类荞食的免疫调节作用差异性,探讨黄酮含量与免疫调节作用的关联性,为贵州特色苦荞食品的研发与推广提供前期研究数据及技术支撑。
1 材料与方法
1.1 材料与试剂
苦荞米、苦荞茶、苦荞面粉、苦荞挂面、苦荞羹:贵州省内苦荞生产企业;KM小鼠,6周~8周龄,雌雄各半,SPF级,体重18 g~22 g:重庆腾鑫生物技术有限公司,实验动物合格证号为:SCXK(军)2012-0011;免疫球蛋白 G(immunoglobulin G,IgG)、免疫球蛋白 M(immunoglobulin M,IgM)测定试剂盒:上海鼓臣生物技术有限公司;2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB):成都西亚试剂有限公司;环磷酰胺:江苏恒瑞医药股份有限公司;瑞氏染料:天津市光复精细化工研究所;鸡红细胞、补体(豚鼠血清):贵州大学酿酒与食品工程学院贵州省农畜产品贮藏与加工重点实验室自制。
1.2 仪器与设备
1220型液相色谱仪:美国安捷伦公司;TU-1810紫外分光光度计:北京普析通用仪器有限责任公司;FW100高速万能粉碎机:天津市泰斯特仪器有限公司;TGL20M台式高速冷冻离心机:长沙迈佳森仪器设备有限公司;光吸收酶标仪SpectraMax 190:美谷分子仪器(上海)有限公司;MoticAE31倒置相差显微镜:麦克奥迪实业集团有限公司。
1.3 方法
1.3.1 样品黄酮类成分测定
样品处理:取经粉碎样品1 g,用60%的乙醇,料液比1∶25(g/mL),50℃超声浸提30 min(超声功率600 W,频率40 kHz),离心取上清液,加5 mL 60%乙醇清洗然后离心合并上清液重复3次,于50 mL容量瓶中定容,摇匀,过0.22 μm微孔滤膜,取滤液备用。
色谱条件:Agilent C18(150 mm×4.6 mm,5 μm);流动相:甲醇-0.4%磷酸溶液(1∶1,体积比),流速:1.0 mL/min,柱温:35.0℃,检测波长:360 nm,进样量:20 μL。
标准曲线:精密称取芦丁对照品20.00 mg,槲皮素对照品4.00mg,山奈酚-3-O-芸香糖苷对照品4.00 mg,分别置于10 mL容量瓶中,用甲醇溶解并定容至刻度,摇匀,取 0.5、1.0、1.5、2.0 mL 于 10 mL 容量瓶中,用甲醇定容至刻度,摇匀,即得芦丁对照品溶液浓度分别为 0.10、0.20、0.30、0.40 mg/mL,山奈酚-3-O-芸香糖苷和槲皮素对照品溶液浓度分别为0.02、0.04、0.06、0.08 mg/mL。通过高效液相色谱(high performance liquid chromatography,HPLC)测定,绘制标准曲线。
1.3.2 样品乙醇提取物制备
取经粉碎样品100 g,60%乙醇,料液比1∶25(g/mL),50℃超声浸提30 min(超声功率600 W,频率40 kHz),离心取上清液,加200 mL 60%乙醇摇匀然后离心合并上清液,真空浓缩至5 g,即1 g醇提样品相当于20 g原样。
1.3.3 构建小鼠免疫低下模型
参照肖雪筠[4]等方法稍作修改,KM小鼠,随机分为空白对照组、环磷酰胺对照组、其中苦荞茶组(tartary buckwheat tea group,TBT)、苦荞米组(tartary buckwheat rice group,TBR)、苦荞面粉组(tartary buckwheat flour group,TBF)、苦荞挂面组(tartary buckwheat noodles group,TBN)、苦荞羹组 (tartary buckwheat paste group,TBP),各设置高、中、低 3个灌胃剂量组,灌胃剂量分别为 600、300、150 mg/kg·bw,每组 10 只。各组小鼠腹腔注射环磷酰胺溶液,注射量为60 mg/kg·bw,空白对照组腹腔注射等剂量的生理盐水,连续3 d,构建环磷酰胺所致小鼠免疫功能低下模型。小鼠免疫功能低下模型建立后,实验各组按照各自剂量灌胃,空白对照组及环磷酰胺对照组灌胃等剂量的生理盐水。
1.3.4 脾脏和胸腺指数的测定
小鼠连续灌胃9天后,禁食不禁水,24小时后,颈椎脱臼处死小鼠,取小鼠脾脏、胸腺,称重记数,计算脾脏指数及胸腺指数。脾脏指数=脾脏重量(mg)/体重(g),胸腺指数=胸腺重量(mg)/体重(g)。
1.3.5 血清中IgG、IgM含量的测定
小鼠连续灌胃10天后,摘眼球取血,1500 r/min离心10 min,取血清,然后按照IgG、IgM测定试剂盒的使用说明书进行。
1.3.6 血清溶血素水平的测定
小鼠连续灌胃6天后,各鼠腹腔注射2%的鸡红细胞混悬液0.2 mL,4天后,摘眼球取血,1500 r/min离心10 min,取血清,用生理盐水稀释至100倍,取1 mL,加10%的鸡红细胞悬浮液0.5 mL、10%的补体1 mL,混合均匀于37℃水浴30 min,置0℃冰箱中中止反应。1500 r/min离心5 min,取上清液于450 nm处测吸光度值。与不加血清的生理盐水试管作对照。颈椎脱臼处死小鼠。
1.3.7 耳肿胀率的测定
小鼠连续灌胃6天后,于腹部涂抹8%的硫化钠去毛,均匀涂抹 5%DNFB 50 μL,3天后,于小鼠左耳均匀涂抹1%DNFB 20 μL,于右耳均匀涂抹20 μL丙酮溶液进行对照,24小时后,颈椎脱臼处死,用打孔器取直径8 mm的耳片,称重,计算肿胀率,肿胀率/%=(左耳/右耳-1)×100。
1.3.8 单核-巨噬细胞功能的测定
小鼠连续灌胃6天后,每只小鼠腹腔注射4%的淀粉肉汤1 mL,以引诱体内的巨噬细胞向腹腔聚集;间隔2小时后,每只小白鼠注射1%的鸡红细胞悬液1 mL。再间隔2 h,颈椎脱臼处死,室温保持在27℃避免尸体僵硬,剪开腹壁皮肤,腹腔注射生理盐水 2 mL,用手轻柔5 min,吸取腹液1 mL均匀涂于载玻片上,立即37℃孵育30 min,用生理盐水缓慢冲洗1 min,吹干,染色进行观察。
计数:油镜下观察,以巨噬细胞数200个为记数范围,同时记数其中吞噬鸡红细胞的巨噬细胞数,记录结果,计算吞噬率,吞噬率/%=吞噬鸡红细胞的巨噬细胞/200×100。
2 结果与分析
2.1 样品黄酮类成分测定
样品、混合对照品色谱图见图1,样品黄酮类成分测定见图2。
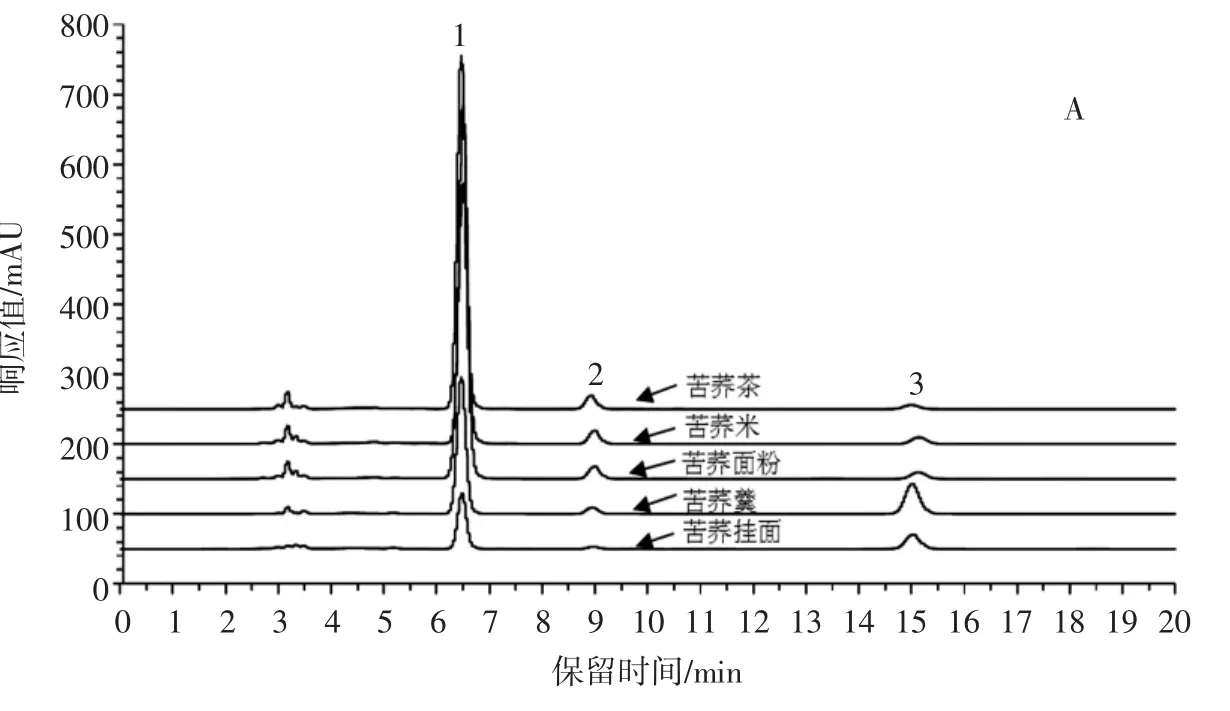
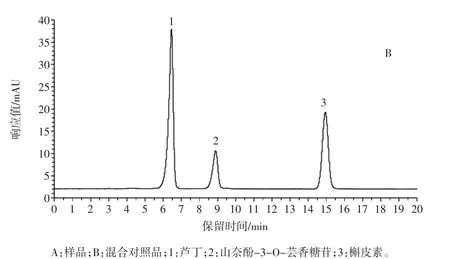
图1 样品、混合对照品色谱图Fig.1 Chromatogram of samples and mixed reference substances

图2 样品黄酮类成分测定Fig.2 Determination of samples flavonoids
由图2可以看出,不同苦荞食品中总黄酮由芦丁、山奈酚-3-O-芸香糖苷、槲皮素组成,芦丁为主要成分,且含量呈显著性差异(P<0.05)。苦荞茶的总黄酮、芦丁、山奈酚-3-O-芸香糖苷含量最高,分别为19.83、19.04、0.67 mg/g;苦荞羹的槲皮素含量最高,达0.87 mg/g。
2.2 乙醇提取物对小鼠脾脏和胸腺指数的影响
脾属于外周免疫器官,是动物体内最大的免疫器官。胸腺属于中枢淋巴器官,是T细胞分化成熟的主要场所,胸腺指数、脾脏指数的大小可反映机体免疫功能的强弱[5-6],各荞食醇提物对小鼠脾脏和胸腺指数的影响见表1。

表1 乙醇提取物对小鼠脾脏和胸腺指数的影响(M±SD,n=10)Table 1 Effects of ethanol extract on mouse spleen and thymus index(M±SD,n=10)mg/g
由表1可知,小鼠免疫低下模型成立(空白对照组与模型对照组比较P<0.01)。各剂量组脾脏和胸腺指数较模型对照组均有所增加,且呈现剂量效应。TBT、TBR高剂量组胸腺指数增加显著(P<0.05),其中TBT高剂量组胸腺指数最高,达4.99 mg/g;TBT、TBR高剂量组脾脏指数增加极显著(P<0.01),其中TBT高剂量组脾脏指数最高,达7.78 mg/g。表明各荞食醇提物能修复小鼠脾脏和胸腺或促进其发育,其中TBT效果最明显。
2.3 乙醇提取物对小鼠IgG、IgM含量的影响
免疫球蛋白是免疫活性分子中的一类,按结构分为5类,分别称免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白 M(immunoglobulin M,IgM)、免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白D(immunoglobulin D,IgD)和免疫球蛋白E(immunoglobulin E,IgE),其中 IgG、IgM 的含量高、分布广,是全身性体液免疫反应的主要效应分子,IgG、IgM的含量高低可反映出机体体液免疫能力的强弱[7],各样品醇提物对小鼠IgG、IgM含量的影响见表2。

表2 乙醇提取物对小鼠IgG、IgM含量的影响(M±SD,n=10)Table 2Effects of ethanol extract on mouse IGG、IGM conten(tM±SD,n=10) mg/100 mL
由表2可知,小鼠免疫低下模型成立(空白对照组与模型对照组比较P<0.01)。各剂量组IgG、IgM含量较模型对照组均有所增加,且呈现剂量效应。TBT、TBR、TBF、TBP高剂量组、TBT、TBR中剂量组IgG含量增加极显著(P<0.01),TBF 中剂量组增加显著(P<0.05),其中TBT高剂量组IgG含量最高,达1092.71 mg/100 mL;TBT、TBR、TBF高剂量组IgM含量增加极显著(P<0.01),TBP 高剂量组、TBT、TBR、TBF 中剂量组增加显著(P<0.05),其中TBT组IgM含量最高,达 168.75 mg/100 mL。表明各荞食醇提物均可提高血清中IgG、IgM含量,其中以TBT组的效果最为明显。
2.4 乙醇提取物对小鼠血清溶血素水平的影响
溶血素是指任何能使红细胞溶解并释放出血红蛋白的物质,属于特异性体液免疫,血清中溶血素含量能反映出机体体液免疫能力的强弱[8-9],各样品醇提物对小鼠血清溶血素水平的影响见表3。
由表3可知,小鼠免疫低下模型成立(空白对照组与模型对照组比较P<0.01)。各剂量组血清溶血素水平较模型对照组均有所提高,且呈现剂量效应。TBT、TBR、TBF高剂量组、TBT中剂量组提高极显著(P<0.01),TBP 高剂量组、TBR、TBF 中剂量组显著 (P<0.05),其中TBT组血清溶血素OD450值最高,达0.49。表明各荞食醇提物均可提高血清溶血素水平,其中TBT组的效果最为明显。
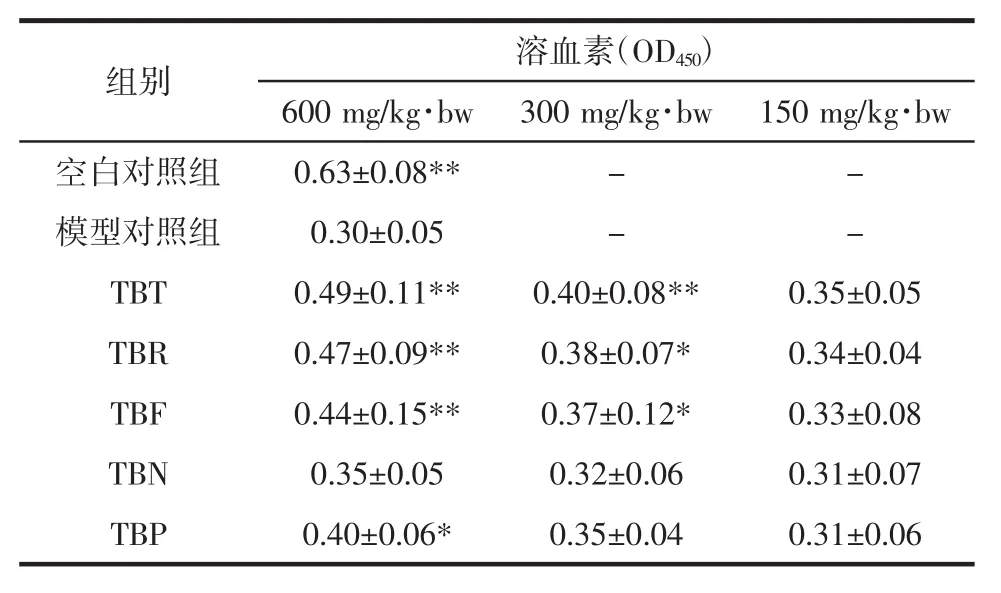
表3 对免疫低下小鼠血清溶血素水平的影响(M±SD,n=10)Table 3 Effects of ethanol extract on mouse serum hemolysin levels(M±SD,n=10)
2.5 乙醇提取物对小鼠耳肿胀率的影响
迟发型过敏反应属于细胞免疫,当抗原进入机体后,机体产生致敏淋巴细胞,当再次受到同一抗原刺激后,单核-巨噬细胞向局部聚集和吞噬抗原而引起皮肤局部肿胀的一种反应,其肿胀厚度可反映细胞免疫功能的强弱[10-11],各样品醇提物对小鼠耳肿胀率的影响见表4。
由表4可知,小鼠免疫低下模型成立(空白对照组与模型对照组比较P<0.01)。各剂量组耳肿胀率较模型对照组均有所增加,且呈现剂量效应。TBT、TBR、TBF高剂量组增加极显著(P<0.01),TBP高剂量组TBT、TBR、TBF中剂量组增加显著(P<0.05)。其中TBT组耳肿胀率最高,达122.09%。表明各荞食醇提物均可提高耳肿胀率,其中以TBT组的效果最为明显。

表4 乙醇提取物对小鼠耳肿胀率的影响(M±SD,n=10)Table 4 Effects of ethanol extract on mouse ear swelling rate(M±SD,n=10)
2.6 乙醇提取物对小鼠单核-巨噬细胞吞噬率的影响
单核-巨噬细胞能对外来异物进行识别和清除,具有强大的吞噬杀伤作用,吞噬率可以反映机体非特异性免疫功能的强弱[12-13],各样品醇提取物对小鼠单核-巨噬细胞吞噬率的影响见表5。

表5 乙醇提取物对小鼠单核-巨噬细胞吞噬率的影响(M±SD,n=10)Table 5 Effects of ethanol extract on mouse mononuclearmacrophage phagocytic rate(M±SD,n=10)
由表5可知,小鼠免疫低下模型成立(空白对照组与模型对照组比较P<0.01)。各剂量组吞噬率较模型对照组均有所增加,且呈现剂量效应。TBT、TBR、TBF高剂量组增加极显著(P<0.01),其中TBT组耳肿胀率最高,达49.20%。表明各荞食醇提物均可提高吞噬细胞吞噬率,其中以TBT组的效果最为明显。
2.7 模糊数学综合评价
由于免疫学评价方法涉及多个指标,很难用单一的标准评价5种苦荞食品的免疫调节作用的强弱,模糊分析法可以按照单因素中各指标间的隶属度关系,各因素的对实验结果的贡献率,建立模糊评价的函数,对多个因素结果进行处理,得到最终模糊总评,所以采用模糊数学综合评价5种苦荞食品免疫调节作用的强弱。
2.7.1 因素集及权重集
由2.2~2.6分析结果可知,各荞食醇提物与免疫调节作用存在剂量效应,且以高剂量组免疫调节作用最强,在此以各荞食醇提物高剂量组免疫学评价指标为因素集,即U={腺指数,脾脏指数,IgG含量,IgM含量,血清血溶素水平,耳肿胀率,吞噬率};综合考虑腺指数、脾脏指数、IgG含量、IgM含量、血清学溶素水平、耳肿胀率、吞噬率7个指标的重要性程度分配权重集为α={0.1,0.1,0.1,0.1,0.2,0.2,0.2}。
2.7.2 单因素隶属度函数及隶属度矩阵
本研究用环磷酰胺构建小鼠免疫低下模型,按免疫学评价方法判定5种苦荞食品免疫调节作用,各项指标大小均介于模型组与空白组之间,则实验组各指标相对于空白组与模型组的大小可以代表其免疫调节作用的强弱,所以属度函数采用升半梯型函数模型,见图3,式(1)。
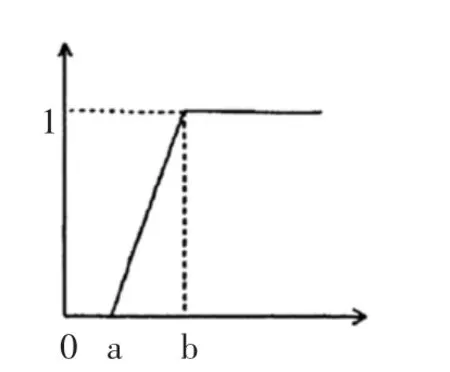
图3 升半梯型函数模型Fig.3 Ascending ladder type function model

式中:rij为第i个因素指标第j个样品的隶属度,且0≤rij≤1;b为第i个因素指标的最大值,即空白对照组;a为第i个因素指标的最小值,即模型对照组。
根据式(1)得出隶属度矩阵(R),式(2)。
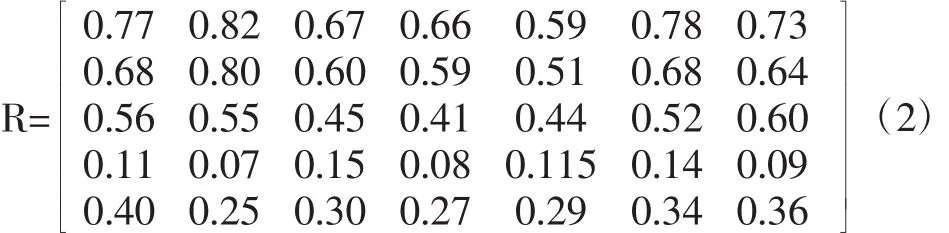
根据(2)结合2.2~2.6实验数据,计算结果见评价矩阵(3)

选取评价函数(4),α 为权重集 α={0.1,0.1,0.1,0.1,0.2,0.2,0.2},得出总评价 S,见表6。
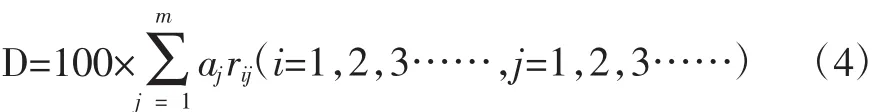

表6 模糊数学综合评价结果Table 6 Comprehensive evaluation result of fuzzy mathematics
根据表6可知,TBT、TBR、TBF、TBN、TBP 组模糊总评结果均为正数,说明各荞食醇提物均能提高免疫低下小鼠的免疫活性,其中TBT组评分最高,达71.13分。表明各荞食醇提物均有免疫正向调节作用,其能力依次为苦荞茶>苦荞米>苦荞面粉>苦荞羹>苦荞挂面。
2.8 样品黄酮总量与免疫调节作用关联性分析
黄酮总量与模糊总评间的关系见图4。

图4 黄酮总量与模糊总评间的关系Fig.4 Relationship between total flavonoids and fuzzy total evaluation
根据图4可知,荞食总黄酮含量与免疫调节模糊总评间呈极显著(r=0.989,P<0.01)的关联性。表明各荞食醇提物能增强免疫低下小鼠的免疫能力,且与其黄酮含量呈正相关。前人大量研究也均表明,苦荞黄酮可增强机体的非特异性免疫、细胞免疫和体液免疫功能,提高机体的免疫能力[4,14-15]。
3 结论
由实验结果可知,贵州5种苦荞食品醇提物各剂量组均可提高免疫低下小鼠的胸腺指数和脾脏指数、血清中IgG、IgM含量、血清血溶素水平、耳肿胀率及单核-巨噬细胞吞噬率,说明贵州5种苦荞食品具有一定的免疫调节作用。5种苦荞食品免疫调节功效不一,且具剂量效应,并与其黄酮含量呈极显著的关联性(P<0.01)。说明苦荞食品醇提物的免疫调节作用与黄酮含量呈正相关,但苦荞食品醇提物究竟是哪种成分在调节免疫功能方面发挥着作用,还需实验去进一步探讨与验证。
[1] 赵震宇,刘平怀,马莎莎,等.药食同源植物牛大力的研究进展[J].食品科学,2017,38(9):293-306
[2] 谭玉荣,陶兵兵,关郁芳,等.苦荞类黄酮的研究现状及展望[J].食品工业科技,2012,33(18):377-381
[3]方玉梅,谭萍.六盘水苦荞麦黄酮的体外抗氧化活性的研究[J].食品研究与开发,2017,38(11):5-8
[4] 宋金星,薛协超,党冰怡,等.0~28日龄SPF仔大鼠免疫功能变化规律的研究[J].黑龙江畜牧兽医,2017(9):245-247
[5] 张文兰,白力,胡同平.抗IgG、IgM、IgA型心磷脂抗体和抗β2糖蛋白1抗体在系统性红斑狼疮患者中的意义[J].免疫学杂志,2017(1):59-62
[6]Hossain M K,Wall K A.Immunological Evaluation of Recent MUC1 Glycopeptide Cancer Vaccines[J].Vaccines,2016,4(3):25
[7] 吴高峰,黄占旺,刘宛玲,等.纳豆菌制剂对抗生素介导小鼠的免疫调节作用及细胞因子分泌的影响[J].中国食品学报,2018(2):22-29
[8] 李自辉,张宁,董婉茹,等.玄参多糖对正常生理小鼠和免疫低下状态小鼠免疫功能的影响[J].中国药房,2017,28(10):1316-1319
[9]Xu X,Bi D,Wan M.Characterization and Immunological Evaluation of Low-Molecular-Weight Alginate Derivatives[J].Current Topics in Medicinal Chemistry,2016,16(8):874-887
[10]周茜,吴梦颖,王唯霖,等.多糖型扇贝沙司对小鼠免疫功能和抗氧化活性的影响[J].中国食品学报,2018(2):30-36
[11]Aira L E,Hernández P,Prada D,et al.Immunological evaluation of rheumatoid arthritis patients treated with itolizumab[J].Mabs,2016,8(1):187-195
[12]李虹霞,杨蜜蜜,刘伏山,等.复方甘草酸苷对自身免疫性肝炎患者肝脏单核巨噬细胞吞噬功能的影响及机制[J].山东医药,2017,57(24):31-33
[13]张静,杨旭东,郭丽君,等.利用隶属函数法分析葛根种质资源品质的研究[J].中药材,2017,40(6):1314-1317
[14]王强,张乃锋,崔凯,等.植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪生长性能、营养物质消化率及血清指标的影响[J].动物营养学报,2018(1):170-179
[15]张涛,张廷,张永霞.一种清热降压苦荞茶饮及其制备方法:CN106260335A[P].2017-01-04

