光照和营养盐对浮游动物和浮游植物生物量及其营养联系的影响
王松波,余俊爽,曹艳敏,吴来燕
水生态系统中浮游植物和浮游动物生物量的预测是一项基础并富有挑战的工作。不同地理尺度的研究发现总磷对这两类生物均具有很好的预测能力(Pinto-Coelho et al.,2005;Wang et al.,2007a;Søndergaard et al.,2018;朱广伟等,2018)。通常情况下,磷被认为是限制湖泊浮游植物初级生产力的主要营养元素(Sterner,2008),然而在某些生境下,氮也可能成为主要的限制性营养元素(Filstrup et al.,2018;Søndergaard et al.,2018)。光照是湖泊食物网的能量来源基础,其入射强度对浮游植物的光合作用至关重要(赵巧华等,2018),而风浪引起的沉积物再悬浮等因素可减弱水体光照强度,导致浮游植物的生物量和生产量降低(Schallenberg et al.,2004;Torremorell et al.,2009)。Karlsson et al.(2009)研究发现,在有色物质含量丰富的贫营养湖泊中,浮游植物初级生产量受光照而非营养盐限制。光的可获得性也强烈影响浮游植物个体大小及其形态多样性(Caputo et al.,2008),甚至影响固氮蓝藻的优势性(Filstrup et al.,2016)。已有的研究发现,光照和营养盐的交互作用能显著影响浮游植物生物量(Dickman et al.,2006;Mette et al.,2011;Zhang et al.,2012),但这种交互作用在浮游植物生物量的预测研究中还鲜见报道。
作为水生食物链中的初级消费者,浮游动物生物量既受食物可获得性的影响(McCauley et al.,1981;Carpenter et al.,2016),还受鱼类捕食强度的影响(Wang et al.,2007b;Havens et al.,2015)。相关研究发现当光的可获得性高于营养盐时,浮游植物会产生富碳贫磷现象(即高碳磷比),导致浮游植物营养质量变差,从而降低浮游动物对其的同化利用效率(Sterner et al.,1997;Diehl,2007)。研究显示,高磷需求的溞类(Daphnia),其生物量不仅与湖泊混合层深度(光输入的替代指标)呈显著负相关(Berger et al.,2006),还与悬浮物碳磷比呈显著负相关(Hessen,2006;McCarthy et al.,2010)。此外,高营养、低光照围隔中的食物不仅能提高初级生产者和初级消费者之间的能量传递效率(Rowland et al.,2015;Kelly et al.,2016),还能增加能量向鱼类的传递效率(Dickman et al.,2008)。因此,光照和营养盐可以通过调节食物质量和数量影响浮游动物的发展。
本研究对湖北省内 14个水体进行春季采样并分析,旨在:(1)验证光照和营养盐的交互作用能否提高多元线性回归模型对浮游植物和浮游动物生物量的预测能力;(2)探讨光照和营养盐对浮游动、植物间营养联系的影响,以期为提出更高效的湖泊生态系统管理策略提供理论借鉴。
1 材料与方法
1.1 野外采样
于2014年和2015年的4月20日—5月9日间,采集湖北省内14个水体水样,其中湖泊4个,水库10个(表1)。为保证入射光强大致相同,采样均安排在晴天的10:00左右。每个水体设置3个采样点,现场利用塞氏盘测定样点透明度(Secchi depth,SD),LI-COR 1400光量子计用于测定水体0.2、0.5、1.0、1.5、2.0、2.5、3.0 m等深度处的光照强度。利用5 L有机玻璃采水器从水面以下0.5 m处开始,间隔1.0 m往下分别采集15或20 L水样,混合均匀后取2.5 L水样带回实验室用于营养盐和叶绿素a(Chl a)测定。浮游甲壳动物样品通过垂直拖曳 64 µm 浮游生物网采集,上提速度约 0.5 m·s-1,采样深度为沉积物界面之上0.5 m到水面。采集后保存于5%福尔马林溶液中。
1.2 环境因子分析
以Chl a质量浓度(ρChla)表示浮游植物生物量。取200~800 mL的混合水样经GF/C膜过滤,滤膜对折后置于冰箱中冷冻保存,然后用10 mL 90%丙酮于4 ℃下避光抽提16 h,离心后取上清液在分光光度计上分别测定波长630、645、663和750 nm处吸光度。过滤后的水样经碱性过硫酸钾消解,分别测定波长220 nm和275 nm处吸光度,可得水体总溶解性氮(total dissolved nitrogen,TDN)质量浓度(ρTDN)。水体总溶解性磷(total dissolved phosphorus,TDP)质量浓度(ρTDP)则将水样经过硫酸钾消解后并通过钼酸铵比色法测得。上述环境因子的测定方法参考《水和废水监测分析方法(第4版)》(国家环境保护总局,2002)。各个水体的营养状态用综合营养状态指数(trophic state index,TSI)来衡量(Zhang et al.,2012),该指数以TDP、Chl a和SD为基础进行计算。公式如下:
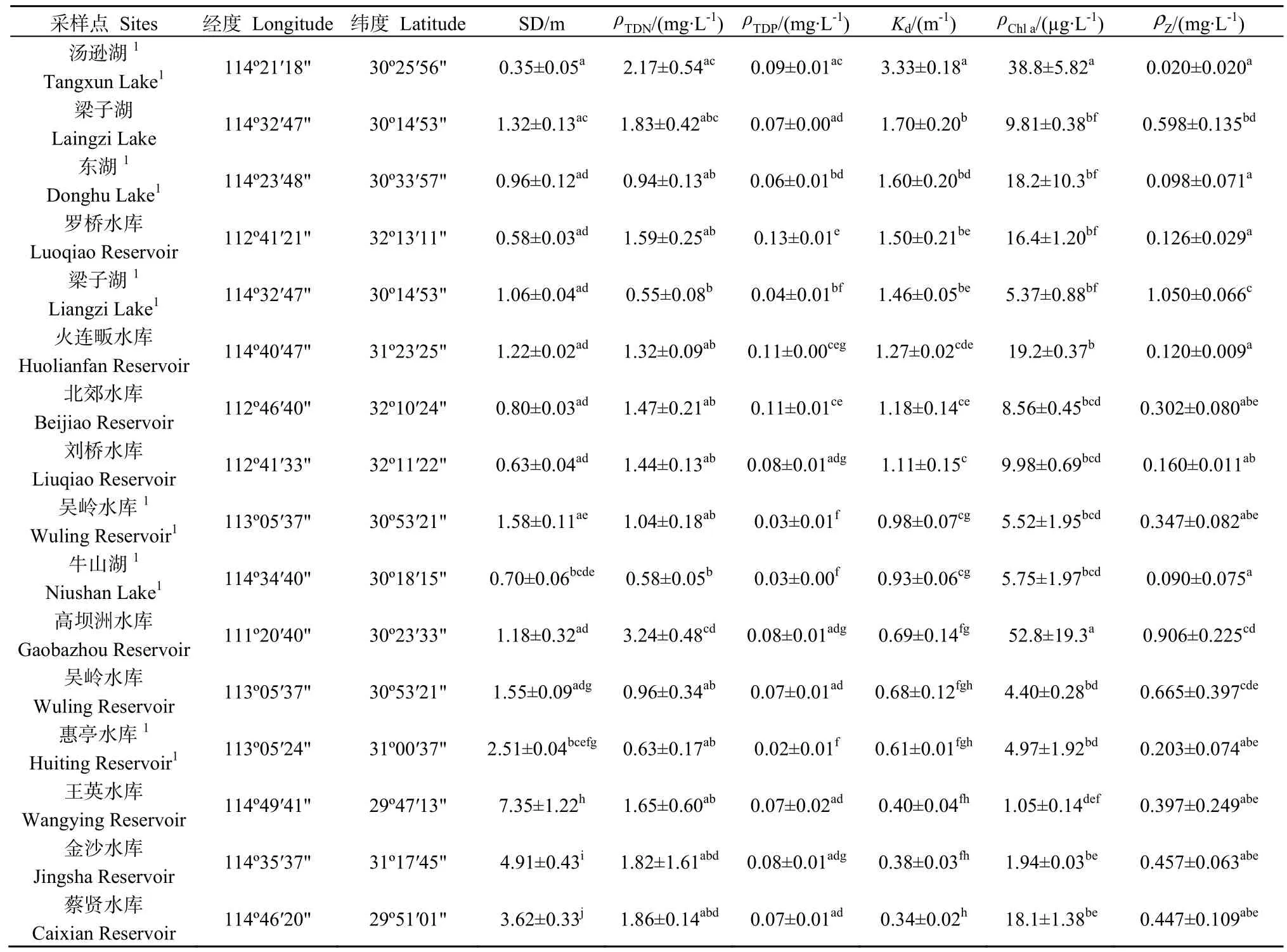
表1 采样水体的湖沼学特征Table 1 Limnological characteristics of the water bodies
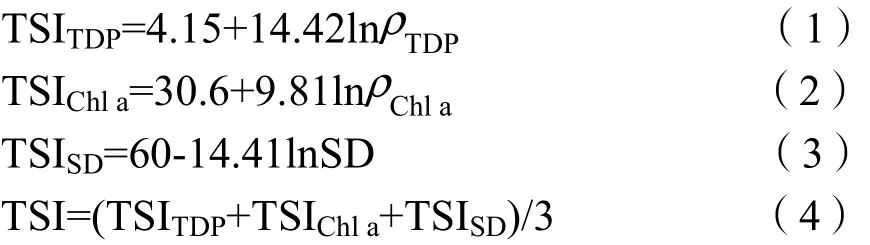
漫射衰减系数(Kd)通过下式计算:

式中,E(z)表示深度为z时的光照强度;E0表示水表面的光照强度;通过建立 lnE(z)=f(z),即可得到Kd(时志强等,2013)。
1.3 浮游甲壳动物分析
浮游甲壳动物物种组成和密度通过解剖镜和显微镜进行鉴定和计数,除数量较少的小型物种鉴定到属外,其余物种均鉴定到种。枝角类和桡足类的鉴定参考工具书(蒋燮治等,1979;沈嘉瑞,1979)。每一样品计数完毕后随机选取30个优势物种进行体长测定,数量较少的物种则尽可能多地测量体长,然后利用体长-体重回归方程估算浮游动物湿重,桡足类的无节幼体未包含在本文分析之中。浮游动物和浮游植物的生物量之比(ρZ/ρP)可间接表征两者之间的营养联系,这一指标也被广泛用于指示浮游动物对浮游植物的摄食压力(Havens et al.,2013)。
1.4 统计分析
运用 SPSS 17.0软件进行单因素方差分析(Tukey方法)、Pearson相关分析和逐步线性回归分析(使用向前选择法)。在进行相关分析和逐步线性回归分析之前,先对各变量(采样点的平均值)进行对数转换(lgx)以保证其服从正态分布。统计分析显著性水平设置为α=0.05。
2 结果与分析
2.1 光照、营养盐和浮游生物生物量
采样水体Kd变化范围为0.34~3.33 m-1,平均值为1.13 m-1,最大值出现在汤逊湖,最小值出现在蔡贤水库。ρTDN变化范围为 0.55~3.24 mg·L-1,平均值为1.43 mg·L-1,最大值出现在高坝洲水库,最小值出现在 2014年的梁子湖。ρTDP变化范围为0.02~0.13 mg·L-1,平均值为 0.07 mg·L-1,最大值出现在罗桥水库,最小值出现在惠亭水库。根据 TSI值,25%的水体处于中营养状态,其余75%处于富营养状态。ρChla变化范围较大,最大值出现在高坝洲水库(52.8 µg·L-1),其质量浓度约为王英水库(1.05 µg·L-1)的50倍。梁子湖浮游甲壳动物生物量最高,为 1.050 mg·L-1,而汤逊湖仅为 0.020 mg·L-1。不同水体同一参数的差异比较见表1。
2.2 浮游生物生物量与光照和营养盐的关系
Pearson相关分析显示:Chl a与Kd(r=0.526,P=0.036)和光照×营养盐(r=0.57~0.70,P<0.05)均呈显著正相关,而与营养盐质量浓度的相关关系不显著(P>0.05);浮游甲壳动物生物量仅与Kd呈显著负相关(r=−0.544,P=0.029);ρZ/ρP与 Kd(r=−0.651,P=0.006)和光照×营养盐(P<0.05)也呈显著负相关(表 2)。逐步线性回归分析显示:Kd在浮游甲壳动物生物量预测中最为重要(R2=0.30,P=0.029);Kd×TDN 在ρChla(R2=0.47,P=0.003)和ρZ/ρP(R2=0.45,P=0.004)的预测中最为重要(表3,图1)。线性回归分析发现:随着TSI增加,ρZ/ρP显著下降(R2=0.64,P<0.001)(图1)。
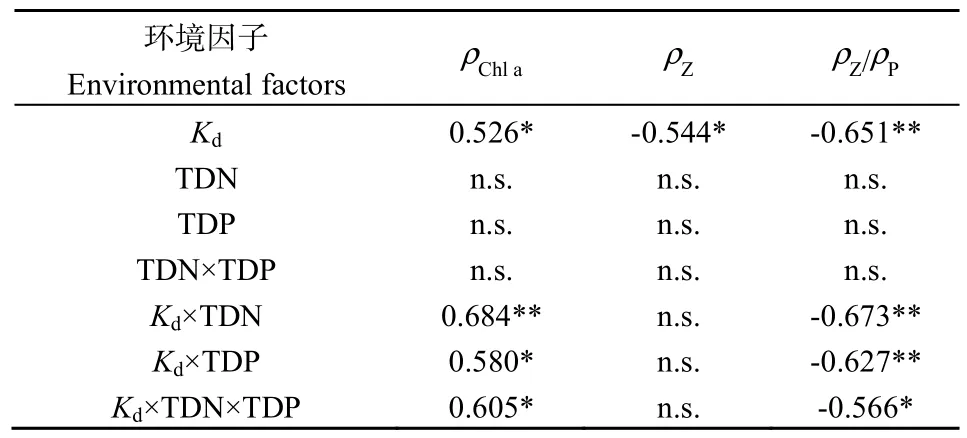
表2 浮游生物生物量与光照和营养盐的Pearson相关分析Table 2 Pearson correlation between plankton biomass and light and nutrients

表3 浮游生物生物量与光照和营养盐的逐步线性回归Table 3 Stepwise linear regressions between plankton biomass and light and nutrients
3 讨论
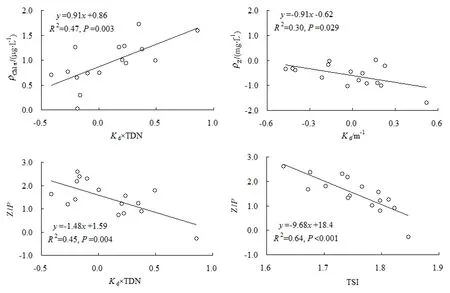
图1 浮游生物生物量与光照和营养盐的线性回归Fig. 1 Linear regressions between plankton biomass and light and nutrients
浮游植物的生长和现存量受多种因素影响,其中光照和营养盐的影响尤为重要。水体中的低光照通常伴随着高密度的藻类颗粒物(Silsbe et al.,2006;Bachmann et al.,2017),但当低光照由非藻类颗粒物引起时(时志强等,2013),藻类生长就会受到光限制(Philips et al.,1997;Wu et al.,2014)。因此,有研究认为,在以悬浮无机颗粒物为主的浑浊水体中,营养盐对Chl a质量浓度的调节作用不大(Wu et al.,2014;Soria-Píriz et al.,2017)。本研究中,与光照相比,营养盐与Chl a质量浓度之间的相关性并不显著,但不能因此得出光限制正在起作用的结论。在鄱阳湖和 Okeechobee湖可能存在光限制的区域,较低的光照可获得性对应着较低的浮游植物生物量(Philips et al.,1997;Wu et al.,2014)。然而,本研究中,Kd和Chl a呈显著正相关,表明较低的光照可获得性对应着较高的浮游植物生物量。Kd独自解释了Chl a质量浓度27.7%的变化,46.8%的变化则由光照和氮的交互作用所解释。本研究中,25%的水体处于中营养状态,其余75%处于富营养状态。由于在中营养状态水体中浮游动物对浮游植物存在着较高的牧食压力(Havens et al.,2013),当剔除掉这些点位后,Chl a与营养盐之间也存在显著正相关关系,且与TDN(r=0.79,P=0.002)的相关性优于TDP(r=0.66,P=0.021),表明本研究水体中部分浮游植物群落可能受氮元素限制,这可能也是Kd×TDN对Chl a有更强预测能力的原因。野外调查和室内实验均显示浮游植物Chl a质量浓度受光照和营养盐的共同影响(Dickman et al.,2006;Zhang et al.,2012)。Caputo et al.(2008)也发现浮游植物群落中各功能类群的优势性受营养盐和光照的交互作用影响。
采用回归分析预测浮游动物生物量时,总磷(TP)的预测能力通常优于Chl a(Pinto-Coelho et al.,2005;Wang et al.,2007a)。本研究中,浮游甲壳动物的生物量与营养盐和Chl a均不存在显著的相关关系。由于鱼类捕食作用的存在,亚热带湖泊中浮游动物的生物量通常很低,其与湖泊营养盐间仅存在微弱的相关关系(Bays et al.,1983;Wang et al.,2007a)。在新西兰湖泊中,鱼类生物量与Chl a之间存在显著的正相关关系,但这种相关性在浮游动物与 Chl a之间并未被发现(Jeppesen et al.,2000)。本研究中,除梁子湖、王英水库和高坝洲水库外,其他水体均存在商业性鱼类养殖,且以滤食性的鲢鳙鱼为主要养殖对象。因此,本研究浮游甲壳动物可能受强烈的鱼类捕食控制(Li et al.,2017)。Wang et al.(2007b)报道在亚热带养殖性湖泊中,当TP质量浓度高于0.097 mg·L-1时,浮游甲壳动物的生物量并不再随着TP的增加而增加。虽然本研究未测定TP质量浓度,但大部分的TDP质量浓度也接近或超过0.097 mg·L-1。在Apopka湖,Havens et al.(2009)发现当TP质量浓度约为0.10 mg·L-1时,浮游动物生物量的分布也无规律可循。多元回归分析显示,Kd可单独解释30%的浮游甲壳动物生物量变化;此外,Daphnia在群落中的相对生物量也与 Kd呈显著负相关关系(r=−0.68,P=0.015),表明Kd可作为富营养水体中浮游动物生物量预测的一个重要指标。
在浅水湖泊中,浮游动物和浮游植物的生物量之比通常随着水体营养水平的上升而下降(McCauley et al.,1981;Wang et al.,2007b)。在本研究中,ρZ/ρP随着Kd和TSI的增加也显著下降,表明浮游动物和浮游植物之间的营养联系在低光照、高营养的环境下变弱。虽然Daphnia、Bosmina和哲水蚤是大部分采样水体中的优势物种(王松波等,2018),但其生物量远低于温带湖泊(Hessen et al.,2006)。若将Chl a和浮游动物湿重(分别乘以66和0.12)分别转换成相应的干重(Jeppesen et al.,2000;McCauley et al.,1981),则 75%的ρZ/ρP变化范围为0.09%~11.4%,这一结果与在佛罗里达浅水湖泊中的研究结果(2%~10%)较为吻合;25%的ρZ/ρP变化范围为 27%~69%,与温带浅水湖泊中的报道(约40%)相接近(Havens et al.,2013)。在本研究具有高ρZ/ρP比的4个湖泊中(梁子湖、金沙水库、王英水库和吴岭水库,均为中营养状态),大型牧食者(Daphnia和 Sinocalanus dorrii)占到了浮游甲壳动物群落总密度的 88%~95%,表明在这些湖泊中浮游动物对浮游植物的摄食压力较大。然而,在低ρZ/ρP比的富营养湖泊中,浮游动物对浮游植物的低摄食压力可能源于鱼类对大型浮游动物的捕食或不可食浮游植物数量的增加(Havens et al.,2013;都雪,2014);同时,枝角类还能从细菌中获得碳源(Sison-Mangus et al.,2015),这也会减少它们对富营养水体中浮游植物的依赖。
4 结论
(1)Chl a与营养盐浓度不存在显著相关性,但与Kd呈显著正相关;浮游甲壳动物生物量仅与Kd呈显著负相关,表明Kd有可能成为浮游动、植物现存量预测的一个重要指标。
(2)光照和总溶解性氮的交互作用提高了多元线性回归模型对ρChla和ρZ/ρP的预测,而Kd能更好预测浮游甲壳动物生物量。
(3)随着湖泊富营养化程度提高,ρZ/ρP比值显著下降,说明浮游动物和浮游植物之间的营养联系在高营养、低光照的环境下变弱。
BACHMANN R W, HOYER M V, CROTEAU A C, et al. 2017. Factors related to Secchi depths and their stability over time as determined from a probability sample of US lakes [J]. Environmental Monitoring and Assessment, 189(5): 206.
BAYS J S, CRISMAN T L. 1983. Zooplankton and trophic state relationships in Florida lakes [J]. Canadian Journal of Fisheries and Aquatic Sciences, 40(10): 1813-1819.
BERGER S A, DIEHL S, KUNZ T J, et al. 2006. Light supply, plankton biomass, and seston stoichiometry in a gradient of lake mixing depths[J]. Limnology and Oceanography, 51(4): 1898-1905.
CAPUTO L, NASELLI-FLORES L, ORDOÑEZ J, et al. 2008.Phytoplankton distribution along trophic gradients within and among reservoirs in Catalonia (Spain) [J]. Freshwater Biology, 53(12):2543-2556.
CARPENTER S R, COLE J J, MICHAEL L, et al. 2016. Response of plankton to nutrients, planktivory and terrestrial organic matter: a model analysis of whole-lake experiments [J]. Ecology Letters, 19(3):230-239.
DICKMAN E M, NEWELL J M, GONZÁLEZ M J, et al. 2008. Light,nutrients, and food-chain length constrain planktonic energy transfer efficiency across multiple trophic levels [J]. Proceedings of the National Academy of Sciences of the United States of America,105(47): 18408-18412.
DICKMAN E M, VANNI M J, HORGAN M J. 2006. Interactive effects of light and nutrients on phytoplankton stoichiometry [J]. Oecologia,149(4): 676-689.
DIEHL S. 2007. Paradoxes of enrichment: effects of increased light versus nutrient supply on pelagic producer-grazer systems [J]. American Naturalist, 169(6): 173-191.
FILSTRUP C T, HEATHCOTE A J, KENDALL D L, et al. 2016.Phytoplankton taxonomic compositional shifts across nutrient and light gradients in temperate lakes [J]. Inland Waters, 6(2): 234-249.
FILSTRUP C T, WAGNER T, OLIVER S K, et al. 2018. Evidence for regional nitrogen stress on chlorophyll a in lakes across large landscape and climate gradients [J]. Limnology and Oceanography, 63:S324-S339.
HAVENS K E, BEAVER J R, MANIS E E, et al. 2015. Inter-lake comparisons indicate that fish predation, rather than high temperature,is the major driver of summer decline in Daphnia and other changes among cladoceran zooplankton in subtropical Florida lakes [J].Hydrobiologia, 750: 57-67.
HAVENS K E, BEAVER J R. 2013. Zooplankton to phytoplankton biomass ratios in shallow Florida lakes: an evaluation of seasonality and hypotheses about factors controlling variability [J]. Hydrobiologia,703(1): 177-187.
HAVENS K E, ELIA A C, TATICCHI M I, et al. 2009. Zooplanktonphytoplankton relationships in shallow subtropical versus temperate lakes Apopka (Florida, USA) and Trasimeno (Umbria, Italy) [J].Hydrobiologia, 628: 165-175.
HESSEN D O, FAAFENG B A, BRETTUM P, et al. 2006. Nutrient enrichment and planktonic biomass ratios in lakes [J]. Ecosystems,9(4): 516-527.
HESSEN D O. 2006. Determinants of seston C꞉P-ratio in lakes [J].Freshwater Biology, 51(8): 1560-1569.
JEPPESEN E, LAURIDSEN T L, MITCHELL S F, et al. 2000. Trophic structure in the pelagial of 25 shallow New Zealand lakes: changes along nutrient and fish gradients [J]. Journal of Plankton Research,22(5): 951-968.
KARLSSON J, BYSTRÖM P, ASK J, et al. 2009. Light limitation of nutrient-poor lake ecosystems [J]. Nature, 460(7254): 506-509.
KELLY P T, CRAIG N, SOLOMON C T, et al. 2016. Experimental whole-lake increase of dissolved organic carbon concentration produces unexpected increase in crustacean zooplankton density [J].Global Change Biology, 22(8): 2766-2775.
LI Y, XIE P, ZHANG J, et al. 2017. Effects of filter-feeding planktivorous fish and cyanobacteria on structuring the zooplankton community in the eastern plain lakes of China [J]. Ecological Engineering, 99:238-245.
MCCARTHY V, IRVINE K. 2010. A test of stoichiometry across six Irish lakes of low-moderate nutrient status and contrasting hardness [J].Journal of Plankton Research, 32(1): 15-29.
MCCAULEY E, KALFF J. 1981. Empirical relationships between phytoplankton and zooplankton biomass in lakes [J]. Canadian Journal of Fisheries and Aquatic Sciences, 38(4): 458-463.
METTE E M, VANNI M J, NEWELL J M, et al. 2011. Phytoplankton communities and stoichiometry are interactively affected by light,nutrients, and fish [J]. Limnology and Oceanography, 56(6): 1959-1975.
PHILIPS E J, CICHRA M, HAVENS K, et al. 1997. Relationships between phytoplankton dynamics and the availability of light and nutrients in a shallow sub-tropical lake [J]. Journal of Plankton Research, 19(3):319-342.
PINTO-COELHO R P, PINEL-ALLOUL B P, MÉTHOT G, et al. 2005.Crustacean zooplankton in lakes and reservoirs of temperate and tropical regions: variation with trophic status [J]. Canadian Journal of Fisheries and Aquatic Sciences, 62(2): 348-361.
ROWLAND F E, BRICKER K J, VANNI M J, et al. 2015. Light and nutrients regulate energy transfer through benthic and pelagic food chains [J]. Oikos, 124(12): 1648-1663.
SCHALLENBERG M, BURNS C W. 2004. Effects of sediment resuspension on phytoplankton production: teasing apart the influences of light, nutrients and algal entrainment [J]. Freshwater Biology, 49(2):143-159.
SILSBE G M, HECKY R E, GUILDFORD S J, et al. 2006. Variability of chlorophyll a and photosynthetic parameters in a nutrient-saturated tropical great lake [J]. Limnology and Oceanography, 51(5):2052-2063.
SISON-MANGUS M P, MUSHEGIAN A A, EBERT D. 2015. Water fleas require microbiota for survival, growth and reproduction [J]. The ISME Journal, 9(1): 59-67.
SØNDERGAARD M, LAURIDSEN TL, JOHANSSON L S, et al. 2018.Nitrogen or phosphorus limitation in lakes and its impact on phytoplankton biomass and submerged macrophyte cover [J].Hydrobiologia, 795(1): 35-48.
SORIA-PÍRIZ S, GARCÍA-ROBLEDO E, PAPASPYROU S, et al. 2017.Size fractionated phytoplankton biomass and net metabolism along a tropical estuarine gradient [J]. Limnology and Oceanography, 62(S1):S309-S326.
STERNER R W, ELSER J J, FEE E J, et al. 1997. The light: nutrient ratio in lakes: the balance of energy and materials affects ecosystem structure and process [J]. American Naturalist, 150(6): 663-684.
STERNER R W. 2008. On the phosphorus limitation paradigm for lakes [J].International Review of Hydrobiology, 93(4-5): 433-445.
TORREMORELL A, LLAMES M E, PÉREZ G L, et al. 2009. Annual patterns of phytoplankton density and primary production in a large,shallow lake: the central role of light [J]. Freshwater Biology, 54(3):437-449.
WANG S B, XIE P, WU S K, et al. 2007a. Crustacean zooplankton distribution patterns and their biomass as related to trophic indicators of 29 shallow subtropical lakes [J]. Limnologica, 37(3): 242-249.
WANG S B, XIE P, WU S K, et al. 2007b. Crustacean zooplankton size structure in aquaculture lakes: is larger size structure always associated with higher grazing pressure? [J]. Hydrobiologia, 575(1): 203-209.
WU Z S, HE H, CAI Y J, et al. 2014. Spatial distribution of chlorophyll a,and its relationship with the environment during summer in Lake Poyang: a Yangtze-connected lake [J]. Hydrobiologia, 732(1): 61-70.
ZHANG M, YU Y, YANG Z, et al. 2012. The distribution of phytoplankton along trophic gradients and its mediation by available light in the pelagic zone of large eutrophic lakes [J]. Canadian Journal of Fisheries and Aquatic Sciences, 69(12): 1935-1946.
都雪. 2014. 长江中下游湖泊浮游动物群落生态学研究[D]. 北京: 中国科学院大学.
国家环境保护总局编. 2002. 水和废水监测分析方法[M]. 第4版. 北京:中国环境科学出版社.
蒋燮治, 堵南山. 1979. 中国动物志: 淡水枝角类[M]. 北京: 科学出版社.
沈嘉瑞. 1979. 中国动物志: 淡水桡足类[M]. 北京: 科学出版社.
时志强, 张运林, 王明珠, 等. 2013. 长江中下游浅水湖泊水下辐照度漫射衰减特征研究[J]. 环境科学, 34(2): 517-524.
王松波, 耿红, 吴来燕, 等. 2018. 食物和理化因子对浮游甲壳动物群落结构的影响[J]. 湖泊科学, 30(3): 723-731.
赵巧华, 孙国栋, 王健健, 等. 2018. 水温、光能对春季太湖藻类生长的耦合影响[J]. 湖泊科学, 30(2): 385-393.
朱广伟, 秦伯强, 张运林, 等. 2018. 2005—2017年北部太湖水体叶绿素a和营养盐变化及影响因素[J]. 湖泊科学, 30(2): 279-295.

