红叶石楠在干旱胁迫下的生理响应
朱涵明月,洪 霞,朱天辉*
(1.四川农业大学风景园林学院,四川 成都 611130;2.重庆市梁平区气象局,重庆 梁平 405200)
红叶石楠(Photiniafraseri)是蔷薇科石楠属杂交种的统称,原产亚热带地区,引种我国长江流域并在城市园林绿地中得到广泛应用。红叶石楠有很强的适应性,耐低温,耐土壤瘠薄,有一定的耐盐碱性和耐干旱能力,关于非生物因子胁迫下林木抗逆性报道较多[1~3 ],而干旱是自然界常见的逆境胁迫因素,不仅制约植物的生长发育与产量,也会引起植被结构与功能的时空变化,植物对干旱胁迫的适应过程和受伤害程度与干旱胁迫强度以及植物自身的抗性紧密联系,并从生化代谢、生理功能[4]和形态适应等多种形式表现出来,但国内外有关红叶石楠抗旱性研究较少,本文通过人工控制水分胁迫,研究红叶石楠的膜透性与丙二醛含量、蒸腾作用与光合速率、根系生长特性与根活力变化,探索其抗旱机理,评价其抗旱性,为红叶石楠绿化种植提供理论与实践支持。
1 材料与方法
1.1 试验材料与控水设计
以1 a生红叶石楠为材料,采用盆栽方法(塑料桶高35 cm,直径25 cm。试验土按园土∶腐殖质∶细砂=5∶1∶1比例混合,每桶装土10 kg),将长势一致、无病虫的红叶石楠苗木定植于塑料桶内(苗高35 cm),每桶栽植1株。试验地设在四川农业大学温江校区温室大棚内,720株红叶石楠苗木购于青州三景花卉苗木有限公司。
控水方法采用孔艳菊[5]中植物水分梯度划分法:对照75%~80%(占土壤最大持水量的百分数)、轻度胁迫55%~60%、中度胁迫40%~45%、重度胁迫30%~35%。每处理6重复,每重复30株。试验观测前控制水分,达到上述4个水分梯度时开始试验测定。期间每天下午测定土壤容积含水量并补充当天失去的水分,保持各处理水平达到设定的含水量。试验时用保鲜膜覆盖塑料桶表面以防止水分蒸发。
1.2 观测指标
1.2.1 膜透性与丙二醛含量(MDA)测定
胁迫试验开始第1天、第10天、第20天、第30天、第40天用DDS-11A型电导率仪测定红叶石楠膜透性[6],用电导率表示膜伤害程度。丙二醛含量(MDA)采用硫代巴比妥酸法测定
1.2.2 净光合速率、蒸腾速率日变化测定
胁迫试验开始第1天、第10天、第20天、第30天、第40天上午10时选取功能叶5片测定净光合速率;在胁迫20 d(中期)时测定蒸腾速率,6.00~18.00每两小时测定1次,TSP-1便携式光合测定系统测定净光合速率、蒸腾速率,每叶叶片均读数6次取期均值。
1.2.3 根生长系特性与抗旱指标测定
在胁迫试验中期(20 d)运用TTC法[7]测定根系活力、甲烯蓝法[7]测定根系吸收面积。在胁迫试验末期(40 d),将各处理的根系冲洗干净后,测定根系长度和直径,主根和侧根长度(同一植株的多个侧根,取其均值)用直尺测量,根直径用游标卡尺测定,并统计直径0~2和≧2 mm的侧根数量。计算不同干旱胁迫下主根和侧根长度、侧根数量相对于对照的增幅。
1.3 统计分析
数据采用SPSS16.0方差分析和最小显著差异法(LSD)比较不同处理间数据差异。
2 结果与分析
2.1 干旱胁迫对红叶石楠细胞膜的伤害
逆境伤害首先作用于质膜,膜透性增加是膜系统受破坏的表现之一,膜透性的测定常作为植物抗性研究的一个重要生理指标。
表1显示,干旱胁迫程度和作用时间与红叶石楠膜伤害(膜透性用电导率表示)有一定相关性,但在对照、轻度、中度胁迫间差异不显著,细胞膜透性整体增幅很小,在轻度和中度胁迫后期膜系统适应性恢复,而重度胁迫膜透性持续增高,可造成红叶石楠膜较大伤害。
同一作用时间下,随着胁迫程度的加重,丙二醛含量呈上升状态(见表2),除重度胁迫外,对照、轻度、中度胁迫间差异不显著;同一胁迫程度下,丙二醛含量随作用时间逐渐升高,至第20天达峰值,以后处于相对稳定状态,表明红叶石楠有一定抗旱能力,丙二醛含量可作为检测红叶石楠抗旱性的重要指标。
表1干旱胁迫下红叶石楠膜相对电导率变化趋势
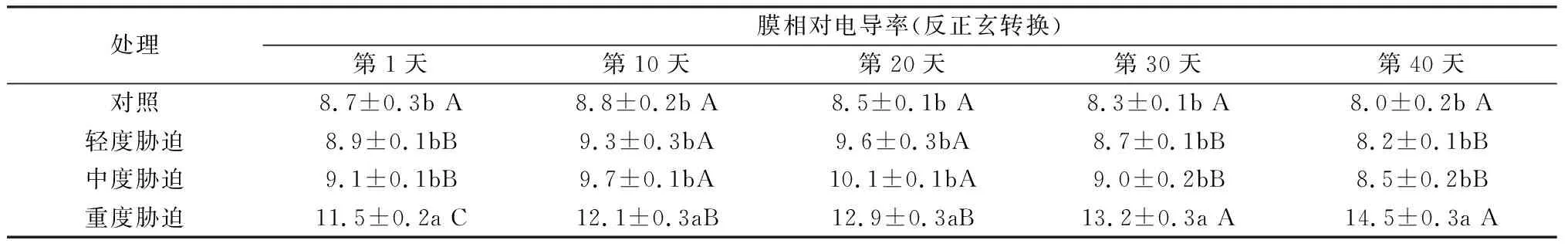
Tab.1 Change of electrolyte leakage of Photinia fraseri under water stress
注:表中数据为平均数±SD,不同小写字母为同时间下不同胁迫间的差异显著性(LSD,P<0.05)。不同大写字母为相同胁迫下不同时间的差异显著性(LSD,P<0.05)。
表2干旱胁迫下红叶石楠丙二醛含量变化
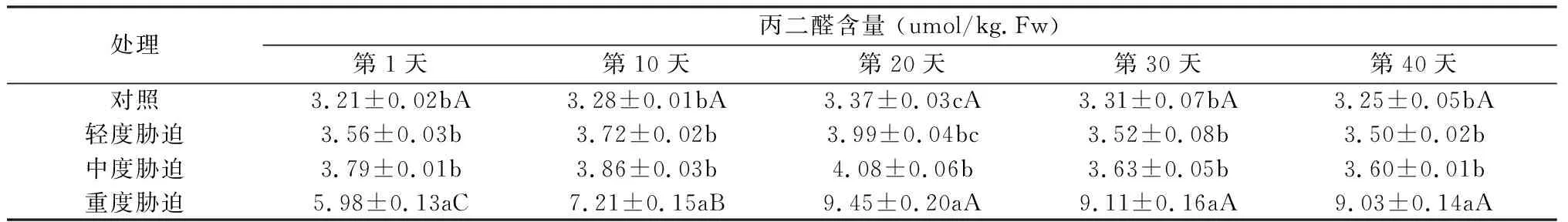
Tab.2 Change of MDA of Photinia fraseri under water stress
注:表中数据为平均数±SD,不同小写字母为同时间下不同胁迫间的差异显著性(LSD,P<0.05)。不同大写字母为相同胁迫下不同时间的差异显著性(LSD,P<0.05)。
2.2 干旱胁迫对红叶石楠净光合速率的影响
干旱胁迫对红叶石楠光合速率的影响如表3所示, 与对照相比,随着干旱胁迫时间的增加,叶片净光合速率为下降趋势,胁迫处理的净光合速率显著低于对照。 干旱胁迫程度与光合速率下降成正比,但净光合速率在较长时间维持在较高水平,说明红叶石楠有忍耐较长时间干旱能力。
2.3 红叶石楠蒸腾速率对干旱胁迫的响应
蒸腾速率日变化呈先升后降的单峰曲线(见表4)。对照、轻度、中度胁迫,蒸腾速率在12:00时达到峰值,随后开始下降,重度胁迫处理蒸腾速率在12:00后变化幅度不大,下降趋势不明显.试验表明红叶石楠可通过降低蒸腾速率以减少水分消耗,对水分亏缺环境具有一定的适应能力。
表3红叶石楠叶片净光合速率对干旱胁迫的响应
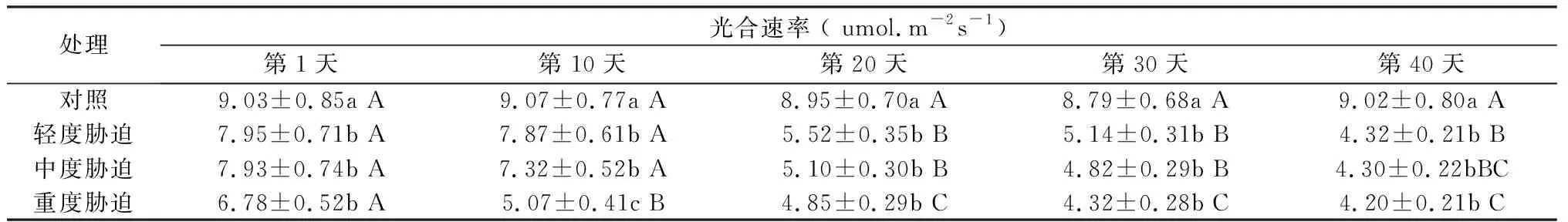
Tab.3 Response of net photosynthetic rate of Photinia fraseri to water stress
注:表中数据为平均数±SD,不同小写字母为同时间下不同胁迫间的差异显著性(LSD,P<0.05)。不同大写字母为相同胁迫下不同时间的差异显著性(LSD,P<0.05)。
表4干旱胁迫下红叶石楠蒸腾速率日变化

Tab.4 Daily change of transpiration rate of Photinia fraseri under water stress
注:表中数据为平均数±SD,不同小写字母为同时间下不同胁迫间的差异显著性(LSD,P<0.05)。不同大写字母为相同胁迫下不同时间的差异显著性(LSD,P<0.05)。
2.4 干旱胁迫对红叶石楠根系生长特性的影响
(1)对根系长度的影响 干旱胁迫可抑制红叶石楠主根伸长生长(见表5),根长生长表现为对照 〉轻度胁迫 〉中度胁迫 〉重度胁迫。轻度胁迫条件下,主根长度与对照差异不显著。侧根长度在干旱胁迫时呈增加趋势,重度胁迫〉中度胁迫〉轻度胁迫〉对照,与对照差异显著,表明在干旱条件下红叶石楠通过增加侧根长度,从而扩大了吸收范围,表现出对土壤干旱的适应性特征[8]。
(2)对侧根数量的影响 随着干旱胁迫的加剧,红叶石楠侧根数量减少(见表6),直径0~2 mm和≧2 mm的侧根均表现为对照 〉轻度胁迫 〉中度胁迫 〉重度胁迫,但只有在中度、重度胁迫时差异显著,说明红叶石楠对干旱有一定忍耐性。
表5干旱胁迫对红叶石楠根长的影响
Tab.5 Response of root length ofPhotiniafraserito water stress
注:表中数据为平均数±SD,同列中不同字母表示差异显著(LSD,P<0.05)。
表6干旱胁迫对红叶石楠侧根数量的影响
Tab.6 Response of branch root number ofPhotiniafraserito water stress

0~2 mm≧2 mm数量增幅(%)数量增幅(%)对照30±3a08±2a0轻度胁迫26±2a-13.37±2a-12.5中度胁迫20±1b-33.33±1b-62.5重度胁迫11±1c-63.31±0b-87.5
注:表中数据为平均数±SD,同列中不同字母表示差异显著(LSD,P<0.05)。
2.5 干旱胁迫对红叶石楠根系活力的影响
试验表明,干旱胁迫程度与根系吸收面积、根系活力成反比(见表7),即干旱胁迫程度的加剧,二者呈下降趋势。重度胁迫与其他处理差异显著,轻度胁迫、中度胁迫与对照在无显著差异,其根系活力、根系吸收面积能维持在一个较高水平,说明红叶石楠在一定程度干旱胁迫下,能保持较高的吸收水分和养分能力,这是园林植物抗干旱胁迫能力的一种体现。
表7红叶石楠根系活力对干旱胁迫的响应
Tab.7 Response of root activity ofPhotiniafraserito water stress
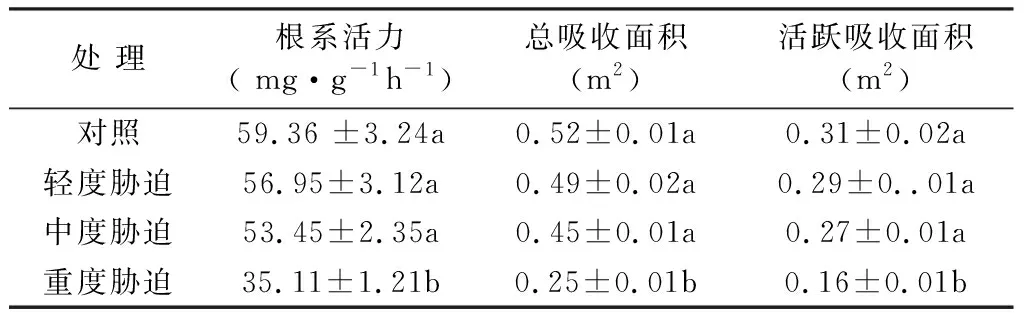
处 理根系活力( mg·g-1h-1 )总吸收面积(m2)活跃吸收面积(m2)对照59.36 ±3.24a0.52±0.01a0.31±0.02a轻度胁迫56.95±3.12a0.49±0.02a0.29±0..01a中度胁迫53.45±2.35a0.45±0.01a0.27±0.01a重度胁迫35.11±1.21b0.25±0.01b0.16±0.01b
注:表中数据为平均数±SD,同列中不同字母表示差异显著(LSD,P<0.05)。
4 讨论与结论
水分是植物生长的重要环境因子,影响着植物形态、生理生化代谢及地理分布范围,植物对水分胁迫的响应包含着极其复杂的生理生化变化,并形成了受遗传性制约的适应机制[ 9-11 ]。本试验表明干旱胁迫对红叶石楠的生理指标与根系特征产生重要影响,各项指标在干旱胁迫下都有所变化,在一定程度上反映了红叶石楠对水分亏缺的调整适应。细胞膜不仅是细胞与环境发生物质交换的主要通道,也是感受环境最敏感部分,处于干旱环境中的植物有一个共同特征就是膜系统受到破坏,质膜相对透性增加,红叶石楠在轻度、中度干旱胁迫下其膜透性相对变化平稳,说明该植物本身存在一定程度抗旱调节机制。丙二醛是反映植物膜在逆境下伤害的指标,是膜脂过氧化的最终产物,其含量高低可以反映植物遭受逆境伤害程度[12],随着胁迫程度加剧,丙二醛含量呈上升趋势,说明细胞膜出现不同程度的损坏,但轻度、中度干旱胁迫下丙二醛含量上升幅度小,这与相对电导率结果一致。
蒸腾强度影响着植物水分状况,在一定程度上反映了植物调节水分损失的能力及适应干旱环境能力的大小[13].蒸腾速率日变化为先升后降,且比净光合速率下降的幅度大,说明红叶石楠在干旱胁迫下通过降低蒸腾速率以减少水分消耗,提高水分利用效率,具有较强避旱能力。
综合以上结果与分析,红叶石楠在不同干旱胁迫下的膜透性与丙二醛含量、净光合速率、蒸腾速率、根生长系特性与活力有显著差异,轻度干旱胁迫下红叶石楠各项指标显著优于其他处理,表明红叶石楠能够适应一定的水分亏缺环境,对轻度干旱有较强耐受能力。
参考文献:
[1] 张卫华,张方秋,张守攻,等.马占相思抗旱性生理指标的选择研究[J].中南林学院学报,2005,25(6):56~59.
[2] 张玲,王华、汪天,等.不同桉树品种在低温胁迫下的生理反应[J].安徽农业大学学报,2014,41(3):456~461.
[3] 王红梅,包维楷,李芳兰.不同干旱强度胁迫下白刺花幼苗叶片的生理生化反应[J].应用环境生物学报,2008,14(6):757~762.
[4] 赵和文,崔金腾,王杰,等.干旱胁迫下常春藤响应的生理生化机制[J].中国农学通报,2013,29(7):12~19.
[5] 孔艳菊,孔明高,胡学俭,等.干旱胁迫对黄栌幼苗几个生理指标的影响[J].中南林学院学报,2006,26(4):43~46.
[6] 张志良.植物生理学实验指导[M].北京:高等教育出版社,1990:165~681.
[7] 袁晓华,张中汉.植物生理生化实验[M].北京:高等教育出版社,1983,128~133.
[8] 朱新强,张新颖,师尚礼,等.干旱胁迫下4个苜蓿品种根系抗旱性的比较[J].甘肃农业大学学报,2012,47(1):103~107.
[9] Damiano R,Rossano M,Comparison of water status indicators for yonug peach tree[J].Irrigation Science,2003,22(1):39~46.
[10] Feanaasez R J,Reynold J F.Potential growth and drought tolerance of eight desert grasses[J].Oncologic,2000,123:90~98.
[11] Egert M,Tevini M.Inluence of drought on some physiological parameters symptomatic for oxiditative stresses in leaves of cvives(Alliums schoenoprasum)[J].Environmental and Experimental Botany,2002,48:43~49.
[12] Hodges D M,Delong J M,Fomey C F,et al.Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta.1999,207:604~611.
[13] 曾凡江,张希明,李小明,等.柽柳的水分生理特性研究进展[J].应用生态学报,2002,13(5):611~614.
[14] Wison JB,Shoot competition and root competition[J].Journal of Applied Ecology,1988,25(1):279~296.
[15] Guow H,Li B,Zhang X S.Architectural plasticity and growth responses of Hippophae rhamnoides and Caragana intermedia seedlings to simulated water stress[J].Journal of Arid Environments 2007,69(3):385~399.
[16] 束良佐,刘英慧.硅对盐胁迫下玉米幼苗生长的影响[J].农业环境保护,2001,20(1):38~40.
[17] 赵忠,李鹏.渭北黄土高坡主要造林树种根系分布特征及抗旱性研究[J].水土保持学报,2002,16(1):96~99.
[18] 宋海星,李生秀.玉米生长空间对根系吸收特性的影响[J].中国农业科学,2003,36(8):899~904.

