草酸对铜绿假单胞菌NY3降解烃的作用研究
肖 婷, 聂麦茜, 聂红云, 朱洪胜, 乔 琪, 陈 军
(西安建筑科技大学 环境与市政工程学院,陕西 西安 710055)
随着石油及其产品的开发利用,烃类污染问题已经严重影响人类生存环境,致使人类不得不寻求一种经济有效的治理方法。生物降解法因具有低成本、高效、无二次污染等优势而受到广泛关注[1-2]。能降解烃类污染物的微生物种类繁多[3-4],其中铜绿假单胞菌(Pseudomonasaeruginosa)作为降解石油烃的优势菌有以下优点[5-9]:①在自然界中分布广泛,且易于从环境中分离;②适应能力强,能以多种烃为碳源和能源进行代谢且有丰富的胞外分泌物;③有代谢烷烃的优势基因,因此具有较好的应用前景。近年来研究发现,小分子有机酸广泛存在于自然界及其各类污染物代谢体系中。好氧微生物降解烃过程中所产生的小分子有机酸可使降解液pH大大降低[10-11]。因此,烃的降解体系中常常有小分子有机酸共存。草酸是最简单的二元有机羧酸,有较强的酸性,是自然环境中微生物酶促反应矿化各类污染物的中间产物[12-16],也是植物常见的代谢产物,尤其是真菌类的代谢产物[17-18]。研究发现,一些小分子有机二酸作为共代谢碳源时,能促进铜绿假单胞菌对烃类物质降解效率[19]。因此本研究选取草酸作为共代谢碳源,旨在通过实验掌握草酸对铜绿假单胞菌NY3降解烃类物质效果的影响,并对其影响原因、机理做了进一步分析,为利用共代谢机制修复烃类污染问题提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 铜绿假单胞菌NY3(属于假单胞菌属,革兰阴性菌),由本实验室分离并鉴定[20]。
1.1.2 试剂和培养基 无机盐培养基制备[21]:NH4NO31 g,磷酸盐缓冲液(K2HPO4·3H2O 81.22 g,NaH2P O4·2H2O 42.9 g)25 mL,微量元素(FeSO4·7H2O 4.5 g/L,CoCl2·6H2O 0.024 g/L,ZnSO4·7H2O 0.418 g/L,MnSO4·H2O 0.258 g/L,NiCl2·6H2O 10.024 g/L,Na2MoO4·2H2O 0.109 g/L,CuCl2·2H2O 0.017 g/L,H3BO30.062 g/L)1 mL,1 mol/L MgSO4·7H2O 0.5 mL,1 mol/L CaCl2·2H2O 0.1 mL,定容至1 000 mL,调pH 7.5。121 ℃灭菌30 min后备用。LB培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,调pH 7.5,溶解于1 000 mL蒸馏水中,121 ℃灭菌30 min后备用。
1.2 方法
1.2.1 NY3菌种子液的制备 NY3在无菌条件下接种于100 mL的 LB培养基中,31 ℃、150 r/min好氧培养24 h,OD600达到1.6±0.05,备用。
1.2.2 草酸对NY3菌以烃为碳源的生长特性的影响作用 取上述无机盐培养基100 mL于250 mL锥形瓶中,无菌操作下加入150 μL十四烷,外加草酸,使其质量浓度分别达到0.5、1.0、2.5、5.0 g/L,调pH值为(7.5±0.05),以未加草酸为对照。分别按10%(体积分数)接种。31 ℃、150 r/min恒温培养,定时取样,测定pH并用平板计数法测定活菌数(cfu/mL)(以此表示菌体生长量)。
1.2.3 草酸共存对NY3菌降解十四烷效率的影响 按照1.2.2的方法制得上述5种培养液,于8 h采样,同步测定培养液中菌体的生长量(用平板计数法测定活菌数(cfu/mL))和十四烷的去除率。十四烷萃取方法:用正己烷(30~60 ℃)萃取剩余十四烷,十二烷为内标,两组平行样,利用安捷伦 6890N 单检测器(GC-FID)测定十四烷的降解率。计算方法:十四烷降解率(%)=((十四烷初始浓度-色谱测定的剩余含量)/初始浓度)×100%。
1.2.4 草酸共存NY3菌生长胞外液降解烃类污染物的作用 取上述无机盐培养基100 mL于250 mL锥形瓶中,无菌操作下加入150 μL十六烷,外加草酸,使其质量浓度达到1 g/L,调pH值为(7.5±0.05),按10%(体积分数)接种,以未加草酸为对照体系。31 ℃、150 r/min恒温培养,24 h后采样离心(4 000 r/min,20 min),菌体备用,上清液过0.22 μm的水膜得到两种胞外液。取胞外液各10 mL分别加入30 μL的十四烷,仍以150 r/min,31 ℃恒温培养,降解8、24、48 h采样,按照1.2.3方法用正己烷萃取剩余十四烷,待测备用。上述备用的菌体用等体积的无机盐重悬,取重悬菌液各10 mL分别加入30 μL的十四烷,降解8、24、48 h采样,按照1.2.3方法用正己烷萃取剩余十四烷,待测备用。
1.2.5 两种碳源条件下胞外上清液紫外光谱扫描 按照1.2.4方法得到两种胞外液,以纯水为空白用紫外分光光度计进行波长扫描,确定紫外吸收峰区间。
1.2.6 NY3菌胞外液中PCA的相对含量与其降解十四烷效率的关系 按照1.2.2的方法投加十六烷、NY3种子液以及不同浓度草酸,使其质量浓度达到0.5、1.0、5.0 g/L,调pH值为(7.5±0.05),以未加草酸为对照。150 r/min,31 ℃恒温培养24 h后,按照1.2.4的方法制得胞外液。取胞外液各10 mL分别加入30 μL的十四烷,仍以150 r/min、31 ℃恒温培养,降解12 h采样,按照1.2.3方法用正己烷萃取剩余十四烷,待测备用。取上述胞外液各2 mL过固相萃取柱(SupelcleanTM ENVITM-18 3 mL Tubes ),用1 mL甲醇(色谱级)洗脱,利用液质联用仪测定PCA的含量。
1.2.7 投加PCA对NY3菌胞外液降解十四烷的影响 取上述无机盐培养基100 mL于250 mL锥形瓶中,无菌操作下加入150 μL十四烷,外加草酸,使其质量浓度达到1 g/L,调pH值为(7.5±0.05),按10%(体积分数)接种。150 r/min、31℃恒温培养。24 h后采样,按照1.2.4的方法离心过膜得到胞外液。在5 mL胞外液中加入10 μL的正十四烷,投加PCA,使其最终质量浓度分别为0.05、0.20和0.50 mg/L。降解12 h采样,按照1.2.3方法用正己烷萃取剩余十四烷,待测备用。
1.2.8 气相色谱测定烷烃的方法和条件[22]用安捷伦6890N单检测器气相色谱仪(FID检测器)测定十四烷去除率。气相条件:5% phenyl Methyl Siloxane HP-5毛细管气相色谱柱(30 m×320 μm×0.25 μm)。载气:99.99%高纯氮气。气相方法:进样口温度250 ℃,分流比50.0∶1。检测器温度300 ℃,氢气流量40 mL/min,空气流量450 mL/min。程序升温:初始160 ℃,保留1 min,再以20 ℃/min升温至260 ℃,保留1 min。
1.2.9 飞行质谱的测定条件[19]质谱条件:流动相A为超纯水,流动相B为甲醇。梯度洗脱程序:0 min,10%B;1 min,10%B;20 min,90%B;23 min,100%B;23.1 min,10%B。流速0.2 mL/min,柱温40 ℃,样品室温度20 ℃,进样量10 μL。在负离子模式下采集数据,采集范围100~800 m/z。
2 结果与分析
`2.1 草酸对NY3菌以烃为碳源生长特性的影响
草酸对NY3菌以十四烷为碳源生长及发酵液pH变化趋势如图1所示。由图1A可知,当NY3菌以十四烷为唯一碳源时,其活菌数在接种后即迅速增加,并在50 h时达到最大(1.394 8×109cfu/mL);而当外加草酸质量浓度为0.5、2.5、5.0 g/L时,NY3菌生长均受到不同程度的抑制,仅在草酸质量浓度为1.0 g/L时,NY3菌在50 h生长的活菌数(1.522 4×109cfu/mL)略高于以十四烷为唯一碳源的体系。超过5次重复实验均得到一致结果:共存草酸不能提高NY3菌细胞生长速度。而图1B结果表明,生长液pH变化趋势大致相同。说明草酸共存作用对NY3菌发酵液pH并无显著影响。但34 h后,外加1.0 g/L草酸的体系中,pH下降速度快,说明该体系中烃类降解转化为酸类的速度要快些。
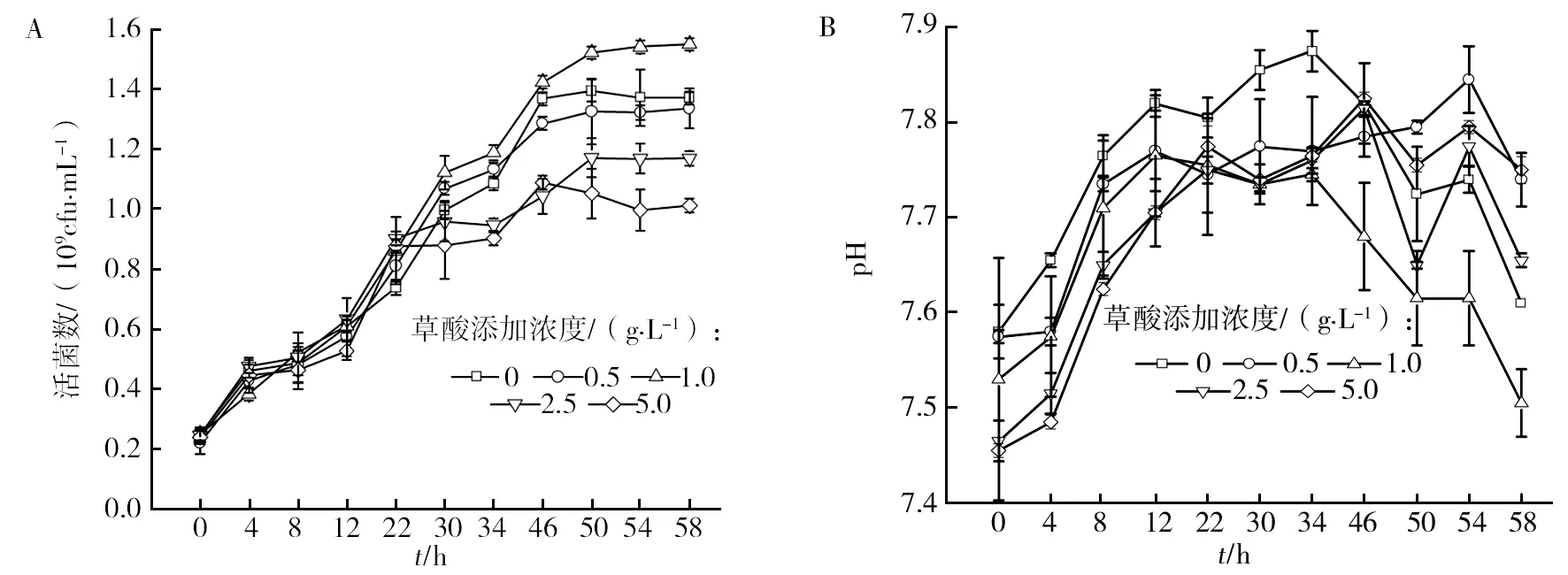
图1 草酸对NY3菌以烃为碳源生长特性的影响Fig.1 Effects of oxalic acid on the growth characteristics of NY3 with hydrocarbon as carbon source A:草酸对NY3菌以十四烷为碳源的生长曲线;B:草酸对NY3菌以十四烷为碳源的产酸特性A:growth curve of oxalic acid against fourteen strains of NY3 bacteria as carbon source;B:Acid production characteristics of oxalic acid against fourteen strains of NY3 bacteria as carbon source
2.2 草酸共存对NY3菌降解十四烷效率的影响
按照1.2.3中的实验方法,测定8 h内NY3菌生长体系中十四烷降解效率,结果如图2所示。由图2可知,各种草酸浓度均对NY3菌降解十四烷有促进作用。
当草酸投加质量浓度为0~1.0 g/L时,NY3菌对十四烷的降解率随投加浓度增加而增加,十四烷去除率最大可提高15.2%;继续增加草酸浓度,NY3菌对十四烷的降解率反而降低。因此,适量草酸促进NY3菌对十四烷的降解率,当其质量浓度为1.0 g/L时,促进最为明显。与8 h相应的NY3菌细胞生长量相比,外加草酸对细胞生长有一定程度的抑制,且抑制趋势与草酸对十四烷降解去除的促进趋势正好相反。当草酸质量浓度为1.0 g/L时,NY3菌的生长受到较大抑制,其生长量最低,比不加草酸时降低约15.3%,但烃降解率却提高了15.2%。

图2 NY3菌以“十四烷+草酸”碳源生长8 h烃去除效率及其细胞生长量相关性Fig.2 The correlation of alkanes removal efficiency and cell growth of NY3 which can metabolize the "tetradecane+oxalic acid" as carbon source after 8 h
2.3 草酸共存NY3菌生长胞外液降解烃类污染物的作用
按照1.2.4中实验方法,NY3菌分别以“C16”和“C16+1.0 g/L草酸”为碳源生长24 h时,离心分离菌体和培养液,分别用该菌体细胞及胞外上清液降解十四烷,降解效率如图3所示。由图3A可知,两种碳源条件下生长的NY3菌细胞,其对十四烷的降解率均随降解时间延长而增加。两种菌体细胞在24 h内对十四烷的降解率并无显著区别,降解48 h时,以“C16+草酸”为碳源生长的菌细胞对十四烷的降解才显示出明显优势。而由图3B可知,利用细胞生长胞外上清液降解十四烷,草酸共存条件下的胞外上清液降解效率明显提高,胞外上清液降解8、24、48 h时,十四烷降解率分别提高了28.0%、28.1%和26.3%,且48 h内这种降解优势几乎未减弱。因此,共存草酸对NY3菌降解十四烷的促进作用主要存在于胞外液中。
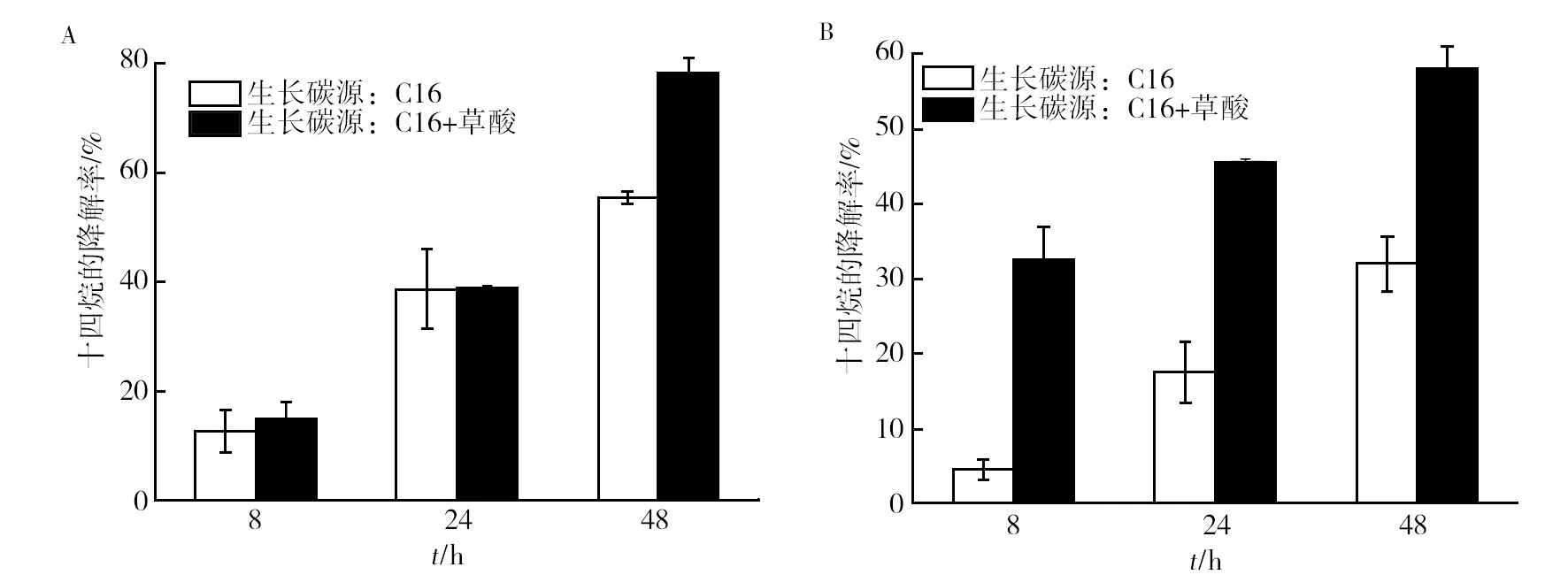
图3 草酸共存NY3菌生长胞外液降解烃类污染物的作用Fig.3 The effects of extracellular fluid on hydrocarbon pollutants degradation by NY3 which coexistence of oxalic acidA:两种生长体系中菌体对十四烷的降解率;B:两种生长体系中胞外液对十四烷的降解率。两种生长体系的碳源分别为C16和“C16+草酸”无机盐培养基A:degradation of tetradecane in bacteria of two growth systems;B:degradation of tetradecane in extracellular fluid of two growth systems;The carbon sources of the two growth systems were C16 and ″C16+oxalic acid″ inorganic salt medium respectively
2.4 草酸共存条件下NY3菌生长胞外上清液的特性分析
2.4.1 草酸共存条件下胞外上清液 两种碳源条件下NY3菌生长胞外上清液外观特征如图4所示。由图4可知,以烃(十六烷)为唯一碳源时胞外上清液呈淡绿色;而草酸共存时胞外液则呈很浅的黄绿色。由于NY3菌是一株铜绿假单胞菌,胞外分泌物十分丰富,其胞外分泌的有色物质主要有绿脓菌素(Pyo)、1-羟基吩嗪(1-OH-PHZ)、吩嗪-1-酰胺(PCN)和吩嗪-1-羧酸(PCA)[23]。由于Pyo在pH值为中性时一般为深绿色[7,24],其颜色深浅与Pyo的浓度相关,因此,共存草酸可能抑制了NY3菌对Pyo的分泌。共存草酸时胞外液呈现的浅黄色与PCA和PCN的颜色一致。据此推测,共存草酸显然改变了NY3菌胞外有色物质的分泌。

图4 草酸共存条件下胞外上清液外观特征Fig.4 The appearance characteristics of extracellular supernatant in the coexistence of oxalic acid
2.4.2 两种碳源条件下胞外上清液紫外光谱图特征 由于NY3菌胞外有色物质均有紫外可见吸收,因此,分别测定了购买的四种吩嗪类物质纯品(Pyo、HPE、PCN和PCA)紫外光谱,同时测定NY3菌在两种生长碳源条件下胞外液的紫外吸收,结果如图5所示。由图5可知,无论草酸共代谢作用是否存在,NY3菌均能分泌出这四种吩嗪类物质。对比两种生长碳源条件下胞外液的紫外光谱,其差别在于225~285 nm之间的吸收峰。其中共存草酸时,胞外上清液在250 nm左右的吸收峰明显高于单一碳源时的情形。对比四种吩嗪类纯品的紫外可见吸收可知,250 nm正是PCA的一个最大吸收峰。因此,共存草酸可提高胞外上清液中PCA的相对含量增加。
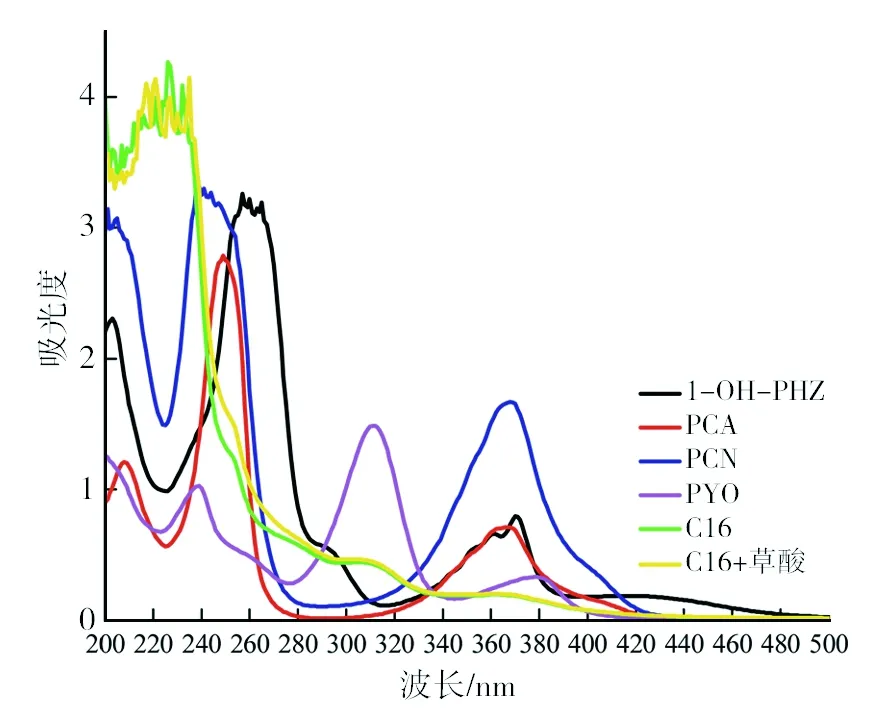
图5 两种碳源条件下胞外上清液紫外光谱图特征Fig.5 Ultraviolet spectra of extracellular supernatants from two kinds of carbon sources
2.5 NY3菌胞外液中PCA的相对含量与其降解十四烷效率的关系
按照1.2.7中方法提取胞外聚合物。为进一步验证PCA相对含量增加可明显提高胞外液对烃的降解效率,按照1.2.6方法,NY3菌以“不同浓度草酸+十六烷”生长24 h,离心,收集胞外液,同时测定胞外液中PCA含量和12 h内其对十四烷的降解率,结果如图6所示。由图6A可知,草酸浓度影响胞外液中PCA的含量,而胞外液对十四烷的降解率随胞外液中PCA分泌量呈正相关性。同样的按照1.2.6方法,NY3菌以“1.0g/L草酸+十六烷”生长24h,离心,收集胞外液,分别将不同浓度的纯品PCA加入到NY3菌胞外液中,并测定加入PCA后胞外液对十四烷降解率,结果如图6B所示。图6B结果显示,随着NY3菌胞外液中外加PCA含量的增加,其在相同时间内对十四烷的降解率增加。该结果进一步验证了胞外液中的PCA含量的增加可增加其对十四烷的降解率。
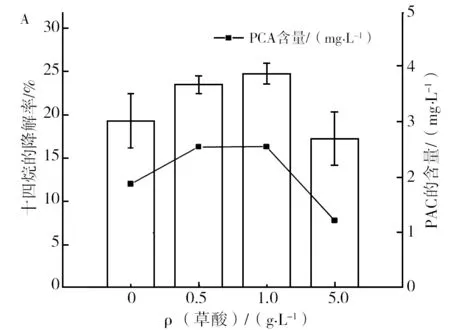
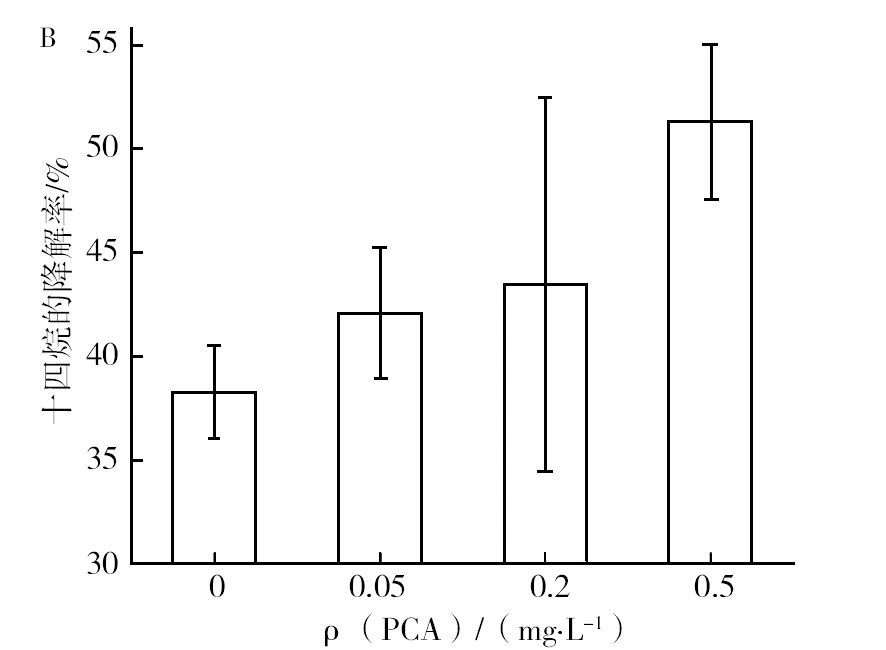
图6 NY3菌胞外液中PCA的相对含量与其降解十四烷效率的关系Fig.6 The correlation between the concentration of Phenazine-1-carboxylic acid in extracellular fluid and the synchronous degradation rate of tetradecanein the metabolic system of NY3 A:草酸共代谢体系胞外液中PCA量与其降解十四烷的关系;B:投加PCA对NY3菌胞外液降解十四烷的影响A:relationship between PCA content in extracellular fluid of oxalate co-metabolism system and degradation of tetradecane;B:the effect of adding PCA on the degradation of tetradecanein by extracellular fluid of NY3 bacteria
3 讨 论
研究表明,自然界中能完全矿化污染物的降解菌占总降解菌数量不到10%,大多数微生物是通过共代谢作用来降解污染物的[25]。课题组前期研究发现,一些有机酸作为共代谢碳源时,能促进铜绿假单胞菌降解烃类物质[19],但是具体的降解机理研究较少。草酸又名乙二酸,是最简单的二元羧酸,由于分子中是由两个羧基直接相连,它的酸性比其他二元酸都强,同时也是生物体常见的一种代谢产物。本文研究了草酸作为共代谢碳源对铜绿假单胞菌NY3生长及其降解烃类物质的影响,并对其促进降解的具体机理做了初步探索。研究得到以下结论:①草酸共代谢不能促进NY3菌在降解十四烷过程中的细胞繁殖,但可以促进NY3菌对十四烷的降解效率。草酸对NY3菌降解十四烷的促进作用与其对NY3菌细胞生长趋势一致,当草酸质量浓度为10 g/L时,NY3菌细胞生长抑制作用最大,对十四烷降解率的促进作用也最为显著,约可提高15.2%。②草酸共代谢不能显著增加NY3菌细胞对十四烷的降解,但可明显增加NY3菌胞外液对十四烷的降解。与没有草酸共代谢体系相比,草酸共代谢体系的胞外液对十四烷的降解率约提高28%。③草酸可提高NY3菌胞外液中PCA的分泌量,PCA分泌量越高,胞外液对十四烷的降解率越高。外加PCA的NY3菌胞外液对十四烷的降解率随着PCA浓度的增加而增加。因此可以说,草酸可通过促进NY3菌对PCA的分泌而增加其对十四烷的降解效率。
目前研究不仅专注于提高铜绿假单胞菌对烃类物质的降解效果,还对其降解的具体机理进行了初步探索,为优化NY3菌对石油烃污染的环境修复能力提供参考。
参考文献:
[1] 赵鑫,韩研,梁文,等.铜绿假单胞菌生物降解特性的研究进展[J]. 基因组学与应用生物学, 2012,31(40):406-414.
[2] 吕雷,朱米家,王珂.石油污染土壤的生物修复技术研究进展[J]. 安徽农业科学,2014,42(22):7585-7589.
[3] Englert C. Kenzie EJ. Bioremediation of petroleum products in solid [A]. Calabrese EJ, Kostecki PT. Principles and Practices for petroleum contaminated soils[C]. Ann. Arbor.MI, 1992.
[4] Harayama S, Kasai Y, Hara A. Microbial communities in oil-contaminated seawater[J].Environmental Biotechnology, 2004, 15(3):205-214.
[5] Belha A,Desnoues N,Elmerieh C.Alkane biodegradation inPseudomonasaeruginosastrains isolated from a Polluted zone:identifieation ofalkB andalkB-related genes[J].Research in Microbiology,2002,153(6):339-344.
[7] 徐鹏.石油烃代谢菌分泌绿脓菌素对其降解过程的影响作用研究[D]. 西安:西安建筑科技大学, 2013.
[8] O′Malley YQ, Reszka KJ,Spitz DR,et al.Pseudomonasaeruginosapyocyanin directly oxidizes glutathione anddecreases its levels in airway epithelial cells[J]. Eur Biochem,2004,287(1):94-103.
[9] Reszka KJ, O′Malley Y,McCormick ML, et al. Oxidation of pyocyanin, a cytotoxic product fromPseudomonasaeruginosa, by microperoxidase 11 and hydrogen[J].Free Radic Biol Med, 2004,36(11):1448-1459.
[10] 卢剑.鼠李糖脂在铜绿假单胞菌NY3代谢烃过程中的生理作用研究[D]. 西安:西安建筑科技大学, 2014.
[11] 胡睿.NY3菌发酵碳源对所产Rha特性影响及其对烃降解促进机理研究[D]. 西安:西安建筑科技大学, 2015.
[12] 黄焕林.二噁烷高效降解菌A.baumanniiDD1的降解特性及其群体感应初探[D].杭州:浙江工商大学, 2015.
[13] 李海燕.蒽醌染料的矿化过程及其相关中间产物分析[J]. 安全与环境学报, 2016,16(2):254-257.
[14] 龚丹.蒽醌染料的TiO2光催化降解产物分析及其降解过程研究[D]. 武汉:武汉纺织大学,2013.
[15] 陈小英,刘智武,裘建平,等.紫外-臭氧联合矿化水溶液的活性蓝19染料[J]. 浙江工业大学学报,2010,38(5):486-490.
[16] 李国亭,曲久辉,张西旺,等.光助电催化降解偶氮染料酸性橙Ⅱ的降解过程研究[J]. 环境科学学报,2009,29(1):175-180.
[17] Bary AD. Comparative morphology and biology of the fungi,mycetozoa and bacteria[J]. Nabu Press, 2015.
[18] Foster JW. Chemical Activities of Fungi[M]. New York: Academic Press,1994:648.
[19] 黄璐.铜绿假单胞菌NY3胞外分泌物对烃类降解的作用研究[D]. 西安:西安建筑科技大学, 2015.
[20] Nie M, Yin X, Ren C, et al. Novel rhamnolipid biosurfactants produced by a polycyclic aromatic hydrocarbon-degrading bacteriumPseudomonasaeruginosastrain NY3[J].Biotechnology Advances, 2010,28(5): 635-643.
[21] 樊晓宇,聂麦茜,徐鹏,等.左氧氟沙星对铜绿假单胞菌所产表面活性剂特性的影响作用[J].精细化工,2012,29(3):245-249.
[22] 马霞,聂麦茜,卢剑,等. 鼠李糖脂对铜绿假单胞菌 NY3 表面特性及其烃降解效率的影响[J].环境科学学报,2014,34(10):2462-2468.
[23] Mavrodi DV, Bonsall RF, Delaney SM, et al. Functional analysis of genes for biosynthesis of pyocyanin and phenazine-1-carboxamide fromPseudomonasaeruginosaPAO1[J] Bacteriol,2001,183(21): 6454-6465.
[24] Ernst AH. Friedheim. Pyocyanine, an accessory respiratory pigment[J].Exp.Med,1931,54(2):207-221.
[25] 罗玮. 难降解污染物微生物共代谢作用研究进展[J]. 土壤通报, 2012,43(6):1515-1521.

