Mg2+ 对米曲霉HMP-F28所产α-CPA及β-CPA的调控作用
田小月, 路 旭, 王 楠, 胡江春1, *
(1.沈阳药科大学 制药工程学院,辽宁 沈阳 110016;2.中国科学院 沈阳应用生态研究所,辽宁 沈阳 110016; 3.中国科学院大学,北京 100049)
植物抗性与植物激素有着密切的关系,以吲哚乙酸(IAA)为代表的植物生长素可使植物抗病性降低[1],阻滞IAA信号转导却能够增强植物抗病性[2-5]。植物在建立SAR(系统获得性抗性)的过程中也伴随着IAA相关基因表达下调[6],这应与IAA可使细胞壁松弛而有利于病原菌侵染有关[7]。从机理上看,IAA发挥生理作用的一个重要机制是通过与细胞壁上的过氧化酶HRP-C形成复合物并产生活性氧(ROS)[8-9]。IAA与植物HRP-C特异性相结合[10-11]并被催化氧化的过程可被IAA类似物阻断,如真菌代谢产物hypaphorine就是典型的IAA拮抗剂[12-14]。它与IAA均具有吲哚乙酸结构母核,可竞争性地与HRP-C结合,发挥拮抗IAA的作用。这说明与IAA及其拮抗剂hypaphorine具有类似结构母核的吲哚生物碱有可能通过竞争性地抑制IAA信号系统而使植物获得抗病性。CPA类代谢产物(Cyclopiazonic acids, 环匹阿尼酸)是主要由青霉属和曲霉属真菌代谢产生的一类含氮杂环类次生代谢产物。Schabort发现5种异构酶的氧化环化酶(CpaO)可催化前期发酵产物β-CPA氧化环化生成α-CPA,证实β-CPA为α-CPA的直接前体[15]。在CPA生物合成过程中首先合成cAATrp,再通过CpaD酶催化作用下添加DMAPP的DMA到cAATrp的C4位置上形成CPA的直接前体β-CPA[16]。因此,从CPA生物合成途径角度看α-CPA是终产物,也是CPA产生菌株的主要代谢产物,而β-CPA则是含量相对较少的中间产物(图1)[17-18]。我们在筛选诱导植物抗性微生物代谢产物的过程中发现米曲霉(Aspergillusoryzae) HMP-F28所产生的CPA类化合物是潜在的诱导植物抗性的先导化合物[19]。通过结构对比发现,CPA类化合物与IAA及hypaphorine具有类似吲哚乙酸结构母核。因此推测CPAs可能与hypaphorine的作用机制相似,即作为IAA的类似物通过竞争性地与HRP-C结合而抑制IAA的作用,从而使植物获得抗性。如图1所示:α-CPA为β-CPA经氧化环化生成的五环结构,具有很强的结构刚性。β-CPA由于未发生环化而具有更好的结构自由度(flexibility)。这一结构特性使β-CPA更类似于IAA及hypaphorine的化学特性,因而具有更好的诱导植物抗性的潜力。在本研究中,采用基于SPE-LC-MS方法对AspergillusoryzaeHMP-F28所产CPA类代谢产物进行了快速指纹识别,并发现Mg2+可以显著改变二者的相对含量。对两个代谢产物进行外源性调控可以使菌株富集β-CPA,这些对于进一步研究二者抑制活性差异及作用机制具有重要意义。
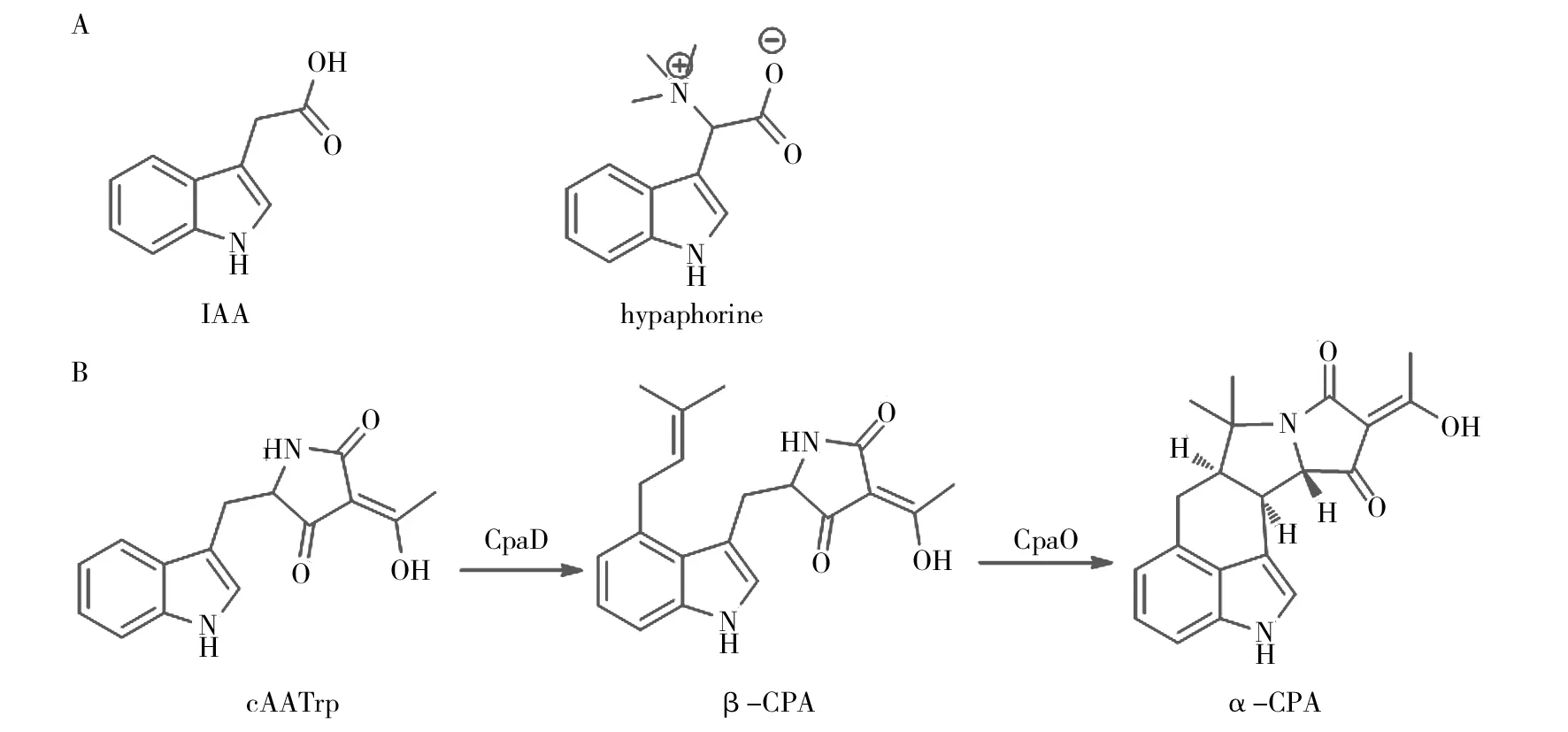
图1 CPAs、hypaphorine与IAA相似的吲哚结构母核(A)、cAATrp经CpaD酶催化成β-CPA,β-CPA后氧化环化成CPA示意图(B)Fig.1 The cyclopiazonic acids (CPAs) and the hypaphorine share a similar indolic scaffold with IAA(A),the conversion of cAATrp into β-CPA is catalyzed by the CpaD,and β-CPA is enzymatically converted into α-CPA by the CpaO(B)
1 材料与方法
1.1 材料
1.1.1 菌株 自大连凌水桥附近海域潮间带采集的繁茂膜海绵(Hymeniacidonperleve)中分离得到真菌菌株AspergillusoryzaeHMP-F28,保存于中国科学院沈阳应用生态研究所农业微生物课题组。
1.1.2 培养基(质量分数,%) 固体培养基(PDA培养基):土豆浸液20,蔗糖2,海盐2.5,琼脂2,pH自然;液体发酵培养基(改良察氏培养基):蔗糖3,NaNO30.2,K2HPO40.1,KCl 0.05,MgSO4·7H2O 0.05,FeSO4·7H2O 0.001,海盐2.5,pH自然。
1.1.3 主要仪器与试剂 血球计数板;BX41光学显微镜(日本OLYMPOS);PEP-SPE官能化聚苯乙烯/二乙烯苯萃取柱(天津博纳艾杰尔科技);Phenomenex C18柱(250 mmol/L×4.6 mmol/L,5 μm,美国菲罗门);Waters ACQUITY UPLC BEH C18色谱柱(100 mmol/L×2.1 mmol/L,1.7 μm,美国沃特世);赛默飞TSQ Quantum Access MAX三重四级杆液质联用仪(赛默飞世尔科技);乙腈(色谱纯,国药集团);无水甲醇(色谱纯,天津博迪化工);其他试剂均为分析纯。
1.2 方法
1.2.1 供试菌株发酵 将A.oryzaeHMP-F28单菌落孢子接种于含不同浓度(0、10、20、40、80、160、320、400、480 mmol/L)Mg2+液体发酵培养基中,每250 mL三角瓶中装液量为50 mL(20%),28 ℃、180 r/min摇瓶培养8 d。发酵结束后,低压抽滤分离菌体与发酵液,弃菌体。

1.2.3 HPLC-MS/分析 色谱柱:Waters ACQUITY UPLC BEH C18色谱柱(100 mmol/L×2.1 mmol/L,1.7 μm);紫外(UV)检测波长:220 nm、285 nm;流速:1 mL/min;柱温箱温度:35 ℃;进样量:20 μL。HPLC-MS对CPAs定性分析条件:HPLC串联TSQ Quantumn系列三重四级杆质谱仪。LC-MS条件:离子源类型为电喷雾离子源(ESI源);正离子模式;喷雾电压3 kV;气化温度300 ℃;鞘气体压力40 kV;辅助气体压力10 kV;毛细管温度270 ℃;毛细管补偿35 kV;扫描范围450~600 Da。经过分析确定CPAs的最佳洗脱梯度。
2 结果与分析
2.1 PEP-SPE的样品预处理
通过对PEP-SPE柱的上样量及洗脱条件考察,HPLC分析确定PEP-SPE柱的上样量为100 mL;通过比较不同浓度(70%、80%、90%、100%)的甲醇洗脱液的HPLC指纹图谱,发现4 mL 80%甲醇洗脱液可将PEP-SPE柱中的代谢产物完全解吸附洗脱并且无物质残留。为除去次生代谢产物中的非CPAs,经HPLC分析发现4 mL 30%甲醇可以去除次生代谢产物中的异香豆素及倍半萜类化合物而保留目标化合物CPAs,再以4 mL 80%甲醇洗脱液解吸附可以获得该HMP-F28的目标化合物CPAs,如图2所示。
2.2 HMP-F28的CPAsHPLC指纹图谱及LC-MS对CPA类代谢产物的定性分析
在改良察氏培养基中添加不同浓度(0~480 mmol/L)的Mg2+,发现当Mg2+浓度为400、480 mmol/L 时,菌体的生长受到了明显抑制,菌体几乎不生长。在0~80 mmol/L 的范围内,13号峰(β-CPA)不存在,在80~320 mmol/L的范围内随着Mg2+浓度的增加,13号峰开始出现并逐渐增强,故选择加入Mg2+浓度为320 mmol/L的发酵液的HPLC指纹图谱进行分析。用30%甲醇去除HMP-F28次级代谢产物中的非CPAs杂质,再经4 mL 80%甲醇洗脱液解吸附获得该菌的CPAs。HPLC指纹图谱显示出多个色谱峰,大部分具有CPA类化合物在285 nm处的特征性吸收。进一步通过LC-MS对这些色谱峰进行分析,经解析色谱峰的质谱发现主要有15个化合物,其中11个为潜在CPAs,如图3所示(编号为1、2、10、12的峰除外)。

图2 甲醇洗脱液的HPLC指纹图谱Fig.2 HPLC fingerprint of methanol eluentA:30%甲醇洗脱液;B:80%甲醇洗脱液A:30% methanol eluent;B: 80% methanol eluent
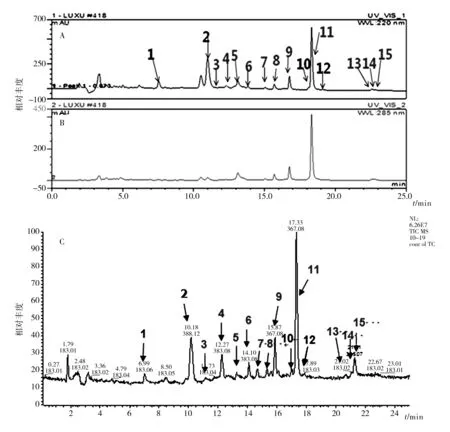
图3 米曲霉HMP-F28的HPLC代谢物指纹图谱Fig.3 HPLC metabolic profiles of the Aspergillus oryzae HMP-F28A: UV检测波长为220 nm; B: UV检测波长为285 nm; C: LC-MS总离子色谱图A: HPLC with UV detection at 220 nm; B: HPLC with UV detection at 285 nm; C: Total ion chromatogram from LC-MS
HPLC指纹图谱中主要的峰所对应的15个化合物的名称、分子式及化合物类型等如表1所示,除此之外还列出了LC-MS定性分析得到的加氢离子峰,表1中除了3种未知的化合物和1种环肽类化合物外,其他11个化合物均为CPA类代谢产物。
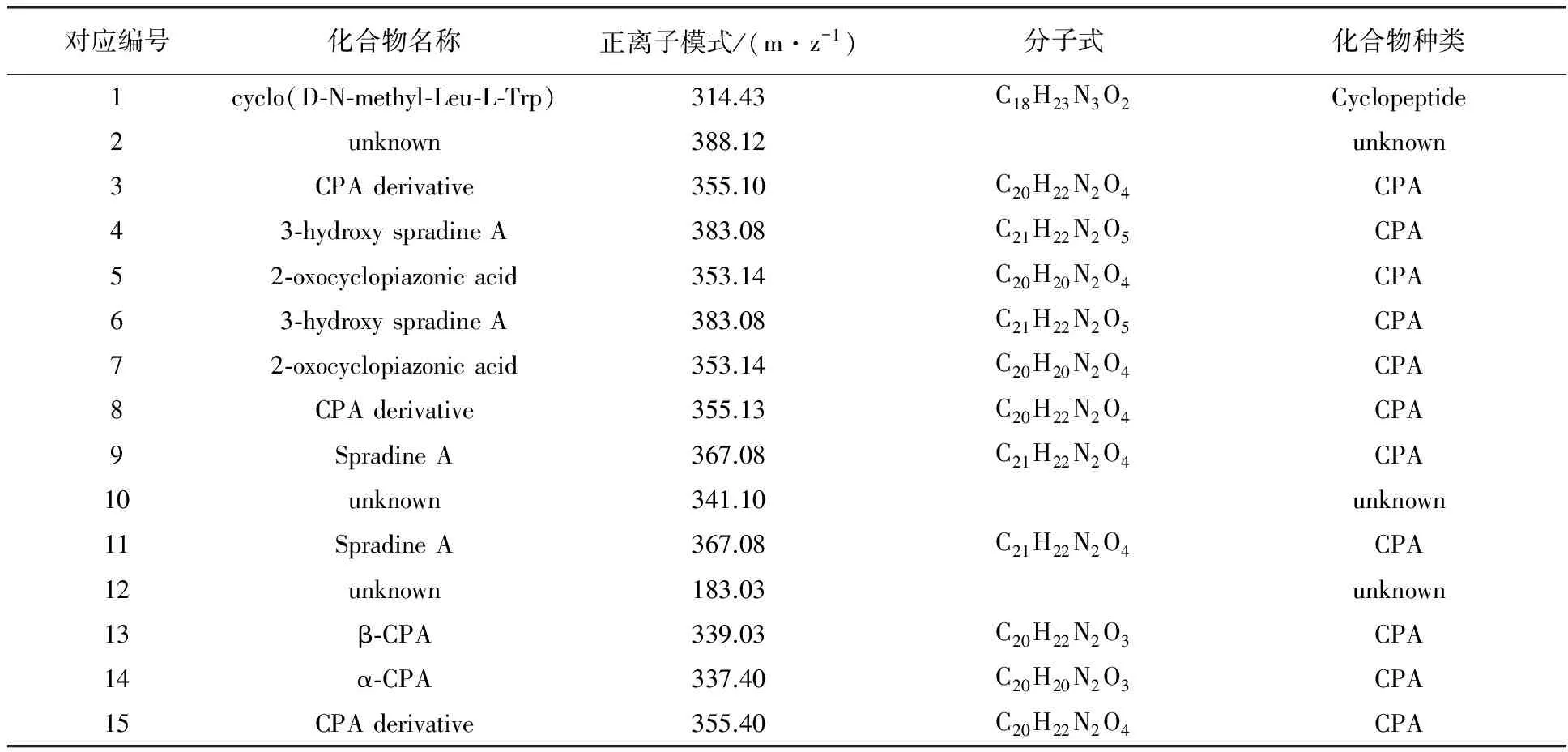
表1 基于LC-MS对米曲霉HMP-F28所产15个化合物的归属Table 1 Assignments of the 15 metabolites produced by A. oryzae HMP-F28 by LC-MS
注:3、8、15为CPA衍生物;4、6为3-hydroxy Spradine A同分异构体;5、7为2-oxocyclopiazonic acid同分异构体;9、11为Spradine A同分异构体
2.3 Mg2+ 对HMP-F28发酵液中α-CPA和β-CPA的含量的影响
通过LC-MS分析表明(图4),以改良察氏培养基培养米曲霉HMP-F28时,添加Mg2+(320 mmol/L)后可以观察到β-CPA的相对含量显著提高,与α-CPA相对比例由1∶9提高到1∶1(相对含量)。说明β-CPA含量在添加Mg2+(320 mmol/L)后明显增加了约9倍,但是相比之下α-CPA含量无显著变化。由此可见,添加Mg2+后,β-CPA的合成显著增加,但并没有显著影响α-CPA的含量。这提示我们,β-CPA的生物合成得到了促进,但β-CPA转化为生物合成终产物α-CPA的反应可能受到了抑制。
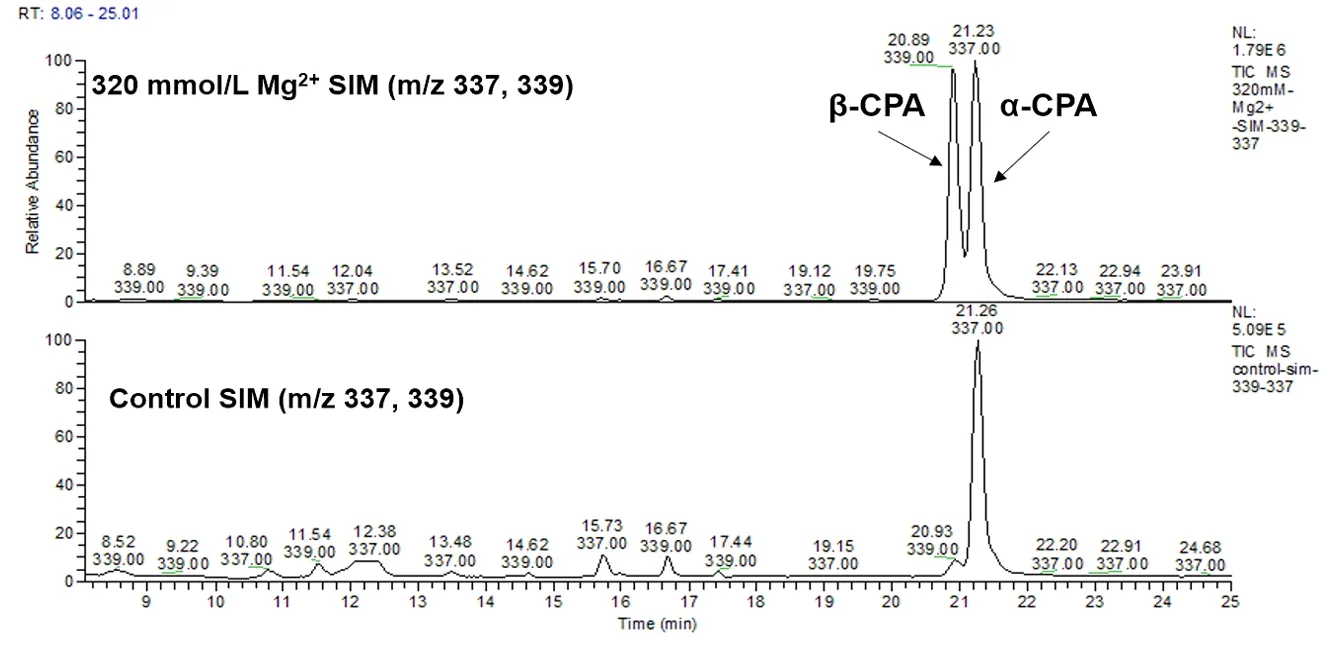
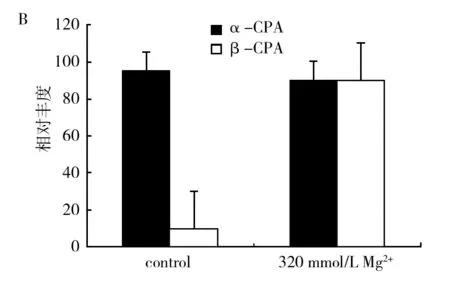
图4 添加Mg2+ (320 mmol/L)对米曲霉HMP-F28产生α-CPA及β-CPA相对含量的影响Fig.4 The effect of Mg2+ (320 mmol/L) on the relative production of α-CPA and β-CPA in Aspergillus oryzae HMP-F28 A: LC-MS选择离子扫描色谱图;B: 添加Mg2+ 前后对于α-CPA及β-CPA相对含量影响的柱状图A: LC-MS profiles in selective ion monitoring mode; B: Bar chart showing significant increase in the production of β-CPA in Aspergillus oryzae HMP-F28
3 讨 论
本研究中出发菌株Aspergillusoryzae(米曲霉)长期应用于发酵类食品的生产,为非黄曲霉素产生菌[20-21]。前期我们在通过激活氧爆发产生ROS筛选海洋微生物代谢产物作为诱导植物抗性先导化合物的过程中,从153株经抗性筛选(抗植物病原真菌等)后无活性或者弱活性的繁茂膜海绵共附生真菌中获得AspergillusoryzaeHMP-F28,其代谢产物能够诱导植物产生氧爆发。经过基于活性追踪的分离和纯化,发现该菌株的活性代谢产物为CPA类化合物,它们显示出较强的诱导植物细胞氧爆发的活性。另据报道,α-CPA能够干扰由生长素调控的根系的向地性[22]。CPA类化合物非常罕见,目前已经发现的CPAs只有10个左右[23]。这类化合物所含的吲哚结构母核使其表现出拮抗IAA的活性,是一种潜在的植物抗性诱导剂。由于β-CPA是α-CPA的前体,因此微生物所产的β-CPA的含量往往较低。又由于β-CPA具有与IAA拮抗剂hypaphorine更加类似的结构自由度,这使其成为比α-CPA更具潜力的一种IAA拮抗剂。
在CPA合成过程中,有60%的β-CPA在菌体生长对数期以后转化成α-CPA,经过HPLC分析发现,在改良察氏培养基条件下HMP-F28产生α-CPA的量远超过β-CPA,而高浓度Mg2+的添加,则产生更多的β-CPA,LC-MS-SIM检测显示出β-CPA明显多于对照。从CPA生物合成机制来看,Mg2+的这种作用可能源于两个可能的机制:①由于CpaD酶催化合成β-CPA,CpaD酶的这一催化过程类似傅-克亲电取代反应。Mg2+可促进该反应的进行,因此通过发酵HMP-F28可以使发酵液中富集更多的β-CPA。②又因高浓度的Mg2+条件下与对照相比β-CPA明显增多,但α-CPA保持不变,这表明高浓度的Mg2+也可能同时抑制了CpaO酶的活性,使β-CPA向α-CPA的转化过程受阻。因此,虽然β-CPA的合成明显增多,但α-CPA的产生并没有因此而提高。这与发现的Mg2+可影响CpaD酶的活性以及在Mg2+存在时该酶有更好的活性相符合,Gebler等[24]也证实了Mg2+在一定浓度下可以促进该酶的活性 。Nishie等[25]还发现Mg2+可以促进CPA结构母核tetramic acid的产生,并可促进tetramic acid形成更复杂的化合物。因此 CpaD酶催化β-CPA合成为典型傅-克亲电取代反应[21],Mg2+可以促进该反应的进行,从而使β-CPA合成增加。
为能够发现更多与IAA拮抗剂hypaphorine更加类似结构的化合物来作为诱导植物抗性的先导化合物,也可以添加合成前体物及代谢的调解因子来调节CPA的合成[26]。除此之外,利用分子生物学方法结合生物信息学对CPA合成基因簇进行探究,激活微生物中沉默CPA代谢物基因簇的表达来充分发掘微生物产生活性次级代谢产物作为IAA拮抗剂的潜力[27]。本研究对于进一步研究CPA生物合成的外源性调控、开展α-CPA及β-CPA的IAA拮抗作用,从而诱导植物自身的抗性来增强植物的抗病能力具有重要意义。
参考文献:
[1] Bari R, Jones JG. Role of plant hormones in plant defence responses[J]. Plant molecular biology, 2009,69(4): 473-488.
[2] Chen Z.Pseudomonassyringaetype III effector AvrRpt2 altersArabidopsisthalianaauxin physiology[J]. Proceedings of the National Academy of Sciences, 2007, 104(50): 20131-20136.
[3] Thilmony R, Underwood W, He SY. Genome-wide transcriptional analysis of theArabidopsisthalianainteraction with the plant pathogenPseudomonassyringaepv. tomato DC3000 and the human pathogenEscherichiacoli O157:H7[J]. The Plant Journal, 2006, 46(1): 34-53.
[4] Navarro L. A Plant miRNA Contributes to Antibacterial Resistance by Repressing Auxin Signaling[J]. Science, 2006, 312(5772): 436-439.
[5] Llorente F. Repression of the Auxin Response Pathway Increases Arabidopsis Susceptibility to Necrotrophic Fungi[J]. Molecular Plant, 2008, 1(3): 496-509.
[6] Pieterse CM, Does DV, Zamioudis C, et al. Hormonal modulation of plant immunity[J]. Annual review of cell and developmental biology, 2012,28:489-521.
[7] Ding X. Activation of the Indole-3-Acetic Acid-Amido Synthetase GH3-8 Suppresses Expansin Expression and Promotes Salicylate- and Jasmonate-Independent Basal Immunity in Rice[J]. The Plant Cell Online, 2008, 20(1): 228-240.
[8] Chen SX, Schopfer P. Hydroxyl-radical production in physiological reactions. A novel function of peroxidase[J]. European journal of biochemistry / FEBS, 1999, 260(3): 726-735.
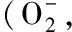
[10] Savitsky PA. Oxidation of indole-3-acetic acid by dioxygen catalysed by plant peroxidases: specificity for the enzyme structure[J]. Biochemical Journal, 1999, 340(3): 579-583.
[11] Gazarian IG.Identification of skatolyl hydroperoxide and its role in the peroxidase-catalysed oxidation of indol-3-yl acetic acid[J]. Biochemical Journal, 1998, 333(1): 223-232.
[12] Ditengou FA, Lapeyrie F. Hypaphorine from the Ectomycorrhizal FungusPisolithustinctoriusCounteracts Activities of Indole-3-Acetic Acid and Ethylene but Not Synthetic Auxins in Eucalypt Seedlings[J]. Molecular Plant-Microbe Interactions, 2000, 13(2): 151-158.
[13] Kawano T.Fungal Auxin Antagonist Hypaphorine Competitively Inhibits Indole-3-acetic Acid-Dependent Superoxide Generation by Horseradish Peroxidase[J].Biochemical and Biophysical Research Communications, 2001, 288(3): 546-551.
[14] Ditengou FA,Béguiristain T, Lapeyrie F. Root hair elongation is inhibited by hypaphorine, the indole alkaloid from the ectomycorrhizal fungusPisolithustinctorius, and restored by indole-3-acetic acid[J]. Planta, 2000, 211(5): 722-728.
[15] Schabort JC, Potgieter DJ. β-Cyclopiazonate oxidocyclase from Penicillium cyclopium. II. Studies on electron acceptors, inhibitors, enzyme kinetics, amino acid composition, flavin prosthetic group and other properties[J]. Biochimica et Biophysica Acta (BBA)-Enzymology,1971, 250(2): 329-345.
[16] Beyer C. Synthese Indolalkaloids α-Cyclopiazonic Acid[J]. Journal, 2014, 46 (2):176-182.
[17] Holzapfel C, Kruger F.The Synthesis of Optically Pure β-Cyclopiazonic Acid, an Indolic Fungal Metabolite[J]. Australian Journal of Chemistry, 1992, 45(1): 99-107.
[18] Min Zhou, Ming-Ming Miao, Gang Du. Aspergillines A-E, Highly Oxygenated Hexacyclic Indole-Tetrahydrofuran-Tetramic Acid Derivatives from Aspergillus versicolor[J]. Organic Letters, 2014,16(19):5016-5019.
[19] Chen Xiaoqi, MouYanhua, Ling Junhong,et al. Cyclic dipeptides produced by fungus Eupenicillium brefeldianum HMP-F96 induced extracellular alkalinization and H2O2production in tobacco cell suspensions[J]. World Journal of Microbiology and Biotechnology,2015,3(1):247-253.
[20] Shiwen Li, Yong Hu, Yingmin Hong. Analysis of the hydrolytic capacities of Aspergillus oryzae proteases on soybean protein using artificial neural Networks[J]. Food Processing and Preservation, 2016,5(40): 918-924.
[21] Chang PK, Ehrlich KC, Fujii I.Cyclopiazonic acid biosynthesis of Aspergillus flavus and Aspergillus oryzae[J]. Toxins, 2009, 1(2): 74-99.
[22] Sievers A, Busch M. An inhibitor of the Ca2+-ATPases in the sarcoplasmic and endoplasmic reticula inhibits transduction of the gravity stimulus in cress roots[J]. Planta, 1992, 188(4): 619-622.
[23] Ma Xinhua, Peng Jixing. Speradines B-D, oxygenated cyclopiazonic acid alkaloids from the sponge-derived fungus Aspergillus flavus MXH-X104[J]. Tetrahedron,2015,71(21): 3522-3527.
[24] Gebler JC, Poulter CD. Purification and characterization of dimethylallyl tryptophan synthase from Claviceps purpurea[J]. Archives of Biochemistry and Biophysics, 1992,296 (1):308-313.
[25] Nishie K,Cole RJ and Dorner JW. Toxicity and neuropharmacology of cyclopiazonic acid[J]. Food and Chemical Toxicology, 1985,23 (9):831-839.
[26] Zhang Q, Wang SQ,Tang HY, et al. Potential allelopathic indole diketopiperazines produced by the plant endophyticAspergillusfumigatususing the one strain-many compounds method[J]. Journal of agricultural and food chemistry,2013,61 (47):11447-11452.
[27] Hewage RT, Aree T, Mahidol C, et al. One strain-many compounds (OSMAC) method for production of polyketides, azaphilones, and an isochromanone using the endophytic fungusDothideomycetesp.[J]. Phytochemistry, 2014,108 (1):87-94.

