强直性脊柱炎患者近期感染与其疾病活动度的相关性
吴海龙,张帅,张斌,张立兴
(石家庄市第一医院骨二科,050000)
强直性脊柱炎(Ankylosing Spondylitis,AS)是以骶髂关节、脊柱附着点炎症反应为特征的慢性炎症性疾病,有学者发现,有80%左右的活动性AS患者均伴感染,且与其疾病活动度存在一定的关联[1]。肺炎衣原体(Cpn)系呼吸道感染常见病原体,属致病性衣原体,为探讨AS患者近期肺炎衣原体感染情况及其与疾病活动度的关系,现对门诊收治的70例AS患者及40例正常健康人展开了研究分析,报道如下:
1 对象与方法
1.1 研究对象 选取2013-03-2016-06医院门诊收治的70例AS患者作为AS组。纳入标准:均符合AS诊断标准[2],经影像学检查确诊;入组前4周内未服用大环内酯类抗生素治疗;类风湿因子(RF)及抗体检测阴性;获得患者及家属知情同意。排除标准:合并肺结核、类风湿关节炎、炎症性肠病、系统性红斑狼疮、银屑病关节炎者;合并恶性肿瘤者;合并心肝肾肺器质性功能障碍者;合并脑血管疾病者;合并严重精神疾病者;年龄<15岁者;无法配合研究者。其中男44例,女16例;年龄18~56岁,平均(30.2±7.1)岁;64例人类白细胞抗原(HLA)-B27阳性,30例4周内有上呼吸道感染病史,20例伴髋关节受累,32例伴外周关节炎,44例存在附着点病,10例有虹膜炎史。选择同期来医院体检的40例正常健康人作为对照组,均经体格检查身体正常,无心肝肾肺功能障碍。其中男30例,女10例;年龄19~54岁,平均(31.5±6.8)岁。AS组与对照组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 所有受试者均于抽取5 ml外周静脉血样本,分离血清,采用酶联免疫法(ELISA)测定Cpn特异性抗体免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)水平,抗肺炎衣原体抗体IgM、IgA、IgG试剂盒均购自以色列Savyon公司,严格参照试剂使用说明操作,抗体滴度(测定结果高于Cut-off值的倍数)≥1视为阳性。Cpn-IgA或Cpn-IgM阳性视为近期存在Cpn感染;同时采用Monitor 20型全自动血沉(ESR)仪测定ESR水平,采用免疫比浊法测定C反应蛋白(CRP),仪器为美国贝克曼库尔特公司Immage 800型特定蛋白分析仪,采用日本SYSMEX SE-9000型全自动血细胞仪测定白细胞计数(WBC)水平。并采用Bath强直性脊柱炎病情活动性指数(BASDAI)[3]对AS患者疾病活动度进行评价,评价内容包括疲乏、晨僵、肌腱痛、中轴及外周关节疼痛等方面,描述患者过去1周症状,除晨僵时间外,各项总分为0~10分,晨僵时间按时间0、30 min、60 min、90 min 及 120 min 分别记 0、2.5、5、7.5 及 10分,最终结果为0.2×[(总分)/2],得分越高,表示病情活动度越高,一般BASDAI>4视为疾病处于活动期。
1.3 统计学方法 研究数据采用SPSS 20.0统计学软件处理,计数资料采用构成比(%)表示,组间比较x2检验,计量资料采用(±s)表示,组间比较采用 t检验,重复测量数据进行方差分析,组内采用LSD-t检验,近期Cpn感染与AS疾病活动度的相关性采用直线相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 AS组与对照组Cpn抗体阳性率比较 AS组与对照组Cpn-IgG及总抗体阳性率均处于较高水平,但AS组Cpn-IgM、Cpn-IgM或Cpn-IgA阳性率明显高于对照组(x2=37.663、31.390,P<0.05),见表 1。
2.2 Cpn感染情况与AS实验室指标及疾病活动度情况 IgA及IgM阳性及阴性AS患者ESR、CRP、WBC、BASDAI比较差异无统计学意义(P>0.05),IgM阳性患者上述各项指标均高于阴性者,比较差异有统计学意义(P<0.05),见表 2。
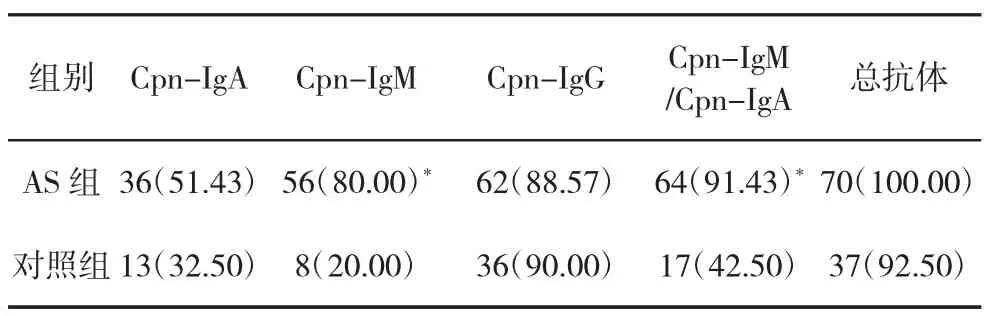
表1 AS组与对照组Cpn抗体阳性率比较[n(%)]
表2 Cpn感染情况与AS实验室指标及疾病活动度情况(±s)
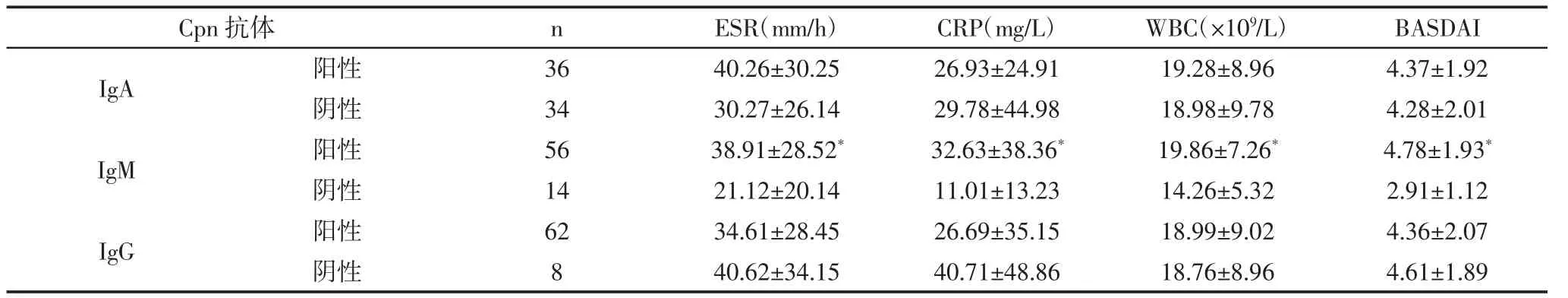
表2 Cpn感染情况与AS实验室指标及疾病活动度情况(±s)
注:与IgM阴性患者比较,*P<0.05.
Cpn 抗体 n ESR(mm/h) CRP(mg/L) WBC(×109/L) BASDAI IgA 阳性 36 40.26±30.25 26.93±24.91 19.28±8.96 4.37±1.92阴性 34 30.27±26.14 29.78±44.98 18.98±9.78 4.28±2.01 IgM 阳性 56 38.91±28.52* 32.63±38.36* 19.86±7.26* 4.78±1.93*阴性 14 21.12±20.14 11.01±13.23 14.26±5.32 2.91±1.12 IgG 阳性 62 34.61±28.45 26.69±35.15 18.99±9.02 4.36±2.07阴性 8 40.62±34.15 40.71±48.86 18.76±8.96 4.61±1.89
2.3 Cpn抗体与AS患者BASDAI相关性分析 IgM、IgA均与AS患者BASDAI呈正相关,其中IgM呈高度相关(P<0.05),见表 3与图 1。
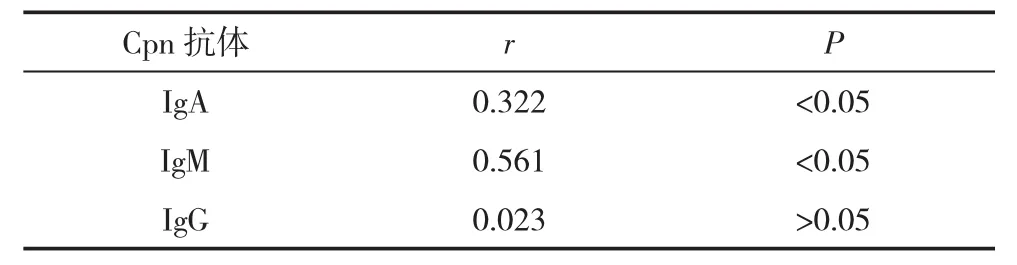
表3 Cpn抗体情况与AS患者BASDAI相关性分析
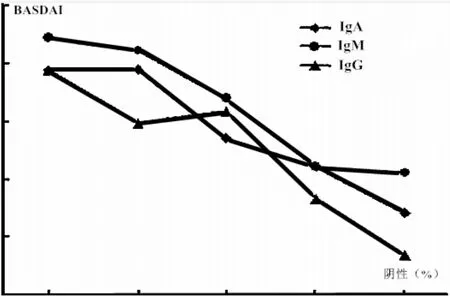
图1 Cpn抗体与AS患者BASDAI相关性分析
2.4 Cpn抗体转换与疾病活动度关系 本组62例Cpn-IgG阳性患者经常规治疗12个月Cpn-IgG仍持续阳性,疾病活动度较高,36例Cpn-IgA阳性者转阴15例,但Cpn-IgA持续阳性与转阴患者BASDAI比较差异无统计学意义(P>0.05),Cpn-IgM阳性56例,转阴20例,36例持续Cpn-IgM阳性患者BASDAI明显高于转阴患者(P<0.05),见表4。
表4 Cpn抗体转换与疾病活动度关系(±s)
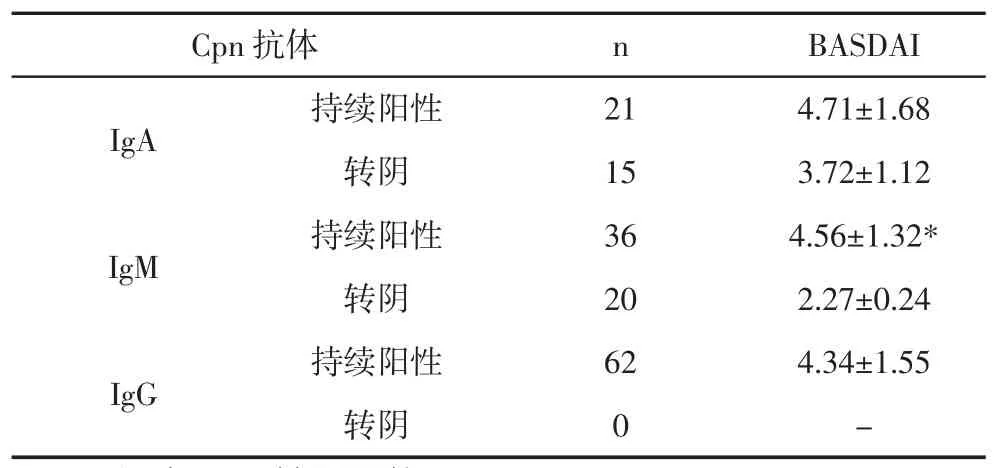
表4 Cpn抗体转换与疾病活动度关系(±s)
注:与IgM转阴比较,*P<0.05.
Cpn抗体 n BASDAI IgA 持续阳性 21 4.71±1.68转阴 15 3.72±1.12 IgM 持续阳性 36 4.56±1.32*转阴 20 2.27±0.24 IgG 持续阳性 62 4.34±1.55转阴 0 -
3 讨论
AS属慢性炎症性疾病,男性青壮年多发,归于自身免疫性疾病范畴,目前多认为AS系遗传因素与感染因素共同作用的结果,早期细菌感染已被证实为诱导关节炎发病的重要原因,有超过1/2的AS患者均有感染史,包括肠道感染、上呼吸道感染、泌尿生殖系统感染等[4]。Wright等[5]表示,肺炎克雷伯杆菌、耶尔森菌、沙门氏菌等均为与AS发病有关的病原菌。也有临床试验发现,未分化脊柱关节病患者血液及关节液内均可检出支原体或衣原体DNA[6]。Bao等[7]发现,肺炎衣原体感染后的反应性关节炎患者关节滑液均可见衣原体特异性淋巴细胞增生,且患者血清IgM、IgG抗体均为阳性,该观点认为肺炎衣原体感染可能参与反应性关节炎发病过程。也有研究者发现,关节炎患者滑膜内肺炎衣原体阳性率超过40.0%[8]。上述报道均指出肺炎衣原体感染可能与较多关节炎症疾病发病有关。但尚无报道对肺炎衣原体感染与AS发病及疾病活动度的关系展开研究。
本研究对AS患者肺炎衣原体感染情况进行检测发现,AS患者与正常健康人均可检出肺炎衣原体特异性IgG表达水平,两者特异性IgG表达阳性率均较高,提示AS与正常健康人肺炎衣原体易感性相似,与Lindstrm等[9]研究结论相近。但AS患者提示近期感染,即初次感染或慢性持续性感染的IgM/IgA抗体阳性率均高于正常健康人,且进一步研究发现,AS患者Cpn特异性抗体IgM阳性及持续阳性患者疾病活动度较高,且IgM与AS疾病活动度呈明显正相关,表明Cpn近期感染与AS发病存在密切关联。一般Cpn初次感染后IgM在3周左右产生,而在感染约7周特异性IgA、IgG出现[10],因此认为IgA、IgG对Cpn急性感染敏感度较低,且在机体清除Cpn病原体后,IgA、IgM快速消失,而IgG在体内持续时间较长,消失速度慢,因此单独IgG上调通常可能提示既往Cpn感染,而IgM与IgA阳性通常提示近期感染。而分析Cpn-IgM对AS疾病活动度影响则主要包括以下几个方面:(1)Cpn可引起细胞及体液免疫应答,在此过程中其抗原成分脂多糖可与机体过度表达B细胞Toll样受体4(TLR-4)结合产生大量Cpn-IgM,推测AS患者近期感染对AS疾病活动度的影响可能与特异性抗原成员脂多糖有关;(2)衣原体感染主要由免疫反应介导引起,其自身携带毒素少,但可诱导肺泡上皮细胞、巨噬细胞、单个核细胞等释放大量炎性细胞因子,诱导级联炎症反应,加重AS病情;(3)Cpn可在感染肺泡上皮细胞后通过单核细胞、巨噬细胞进入人体关节组织,导致特异性T淋巴细胞增生,释放大量炎症因子,引起关节炎发病。
[1]王占欣,王鸽,张彩霞,等.病毒感染与强直性脊柱炎的相关病理研究[J].中华医院感染学杂志,2014,24(1):168-170.
[2]李义凯,朱洪民,陈焕亮,等.两种强直性脊柱炎临床诊断标准的比较[J].中国康复医学杂志,2010,25(8):733-735.
[3]宋婧,周凌,陈凌,等.病情活动性指标ASDAS、RAPID3和BASDAI在判断强直性脊柱炎患者疾病活动度中的比较[J].第二军医大学学报,2015,36(8):909-913.
[4]Son C N,Jun J B,Kim J H,et al.Follow-up Testing of Interferon-Gamma Release Assays Are Useful in Ankylosing Spondylitis Patients Receiving Anti-Tumor Necrosis Factor Alpha for Latent Tuberculosis Infection[J].Journal of Korean Medical Science,2014,29(8):1090.
[5]Wright P B,Anne M E,David M C,et al.Ankylosing spondylitis patients display altered dendritic cell and T cell populations that implicate pathogenic roles for the IL-23 cytokine axis and intestinal inflammation[J].Rheumatology,2016,55(1):120.
[6]Lim D H,Ahn S M,Hong S,et al.THU0381 The Incidence of Herpes Zoster Infection in Patients with Ankylosing Spondylitis:Analysis from Korean National Health Insurance Service Cohort Sample Database[J].Annals of the Rheumatic Diseases,2016,75(Suppl 2):325-326.
[7]Bao J,Lu B,Cao Z,et al.An Asymptomatic Ankylosing Spondylitis Case With Chronic Lung Damage and Mixed Pulmonary Infection[J].Chest,2016,149(4):A460-A460.
[8]Pa-C D S,Diva Salomao M D,Kevin Moder M D,et al.Clinical images:Ocular mycobacterium infection in ankylosing spondylitis[J].Arthritis&Rheumatology,2014,60(1):102-102.
[9]Lindstrm U,Forsbladd'Elia H,Askling J,et al.OP0275?Birth Characteristics and Childhood Infections Predict Ankylosing Spondylitis.A National Register Based Nested Case-Control Study[J].Annals of the Rheumatic Diseases,2015,74(Suppl 2):176.1-176.
[10]Hong S J,Lee S H,Kim H R,et al.THU0227?Postoperative Infection Rates After Surgery with Prosthesis in Patients with Ankylosing Spondylitis Treated by TNF-Alpha Blockade Compared to Conventional Nsaids[J].Annals of the Rheumatic Diseases,2015,74(Suppl 2):278.2-278.

