紫杉醇对肝癌细胞HepG2和大鼠原代培养肝细胞增殖抑制和诱导凋亡作用的研究
徐雅玲,梁 菁
(广西科技大学医学院健康评估教研室,广西 柳州 545006)
紫杉醇作为广西特色抗肿瘤中药,已成为世界公认的强活性广谱抗癌药物。研究表明,其对多种肿瘤细胞具有抑制增殖,诱导凋亡的作用[1-3]。据报道,大多数抗癌药物在取得疗效的同时,常出现不同程度的毒副作用[4]。而本研究组在前期已经证实紫杉醇具有自身毒副作用,即在一定的质量浓度和长时间作用下,对肝细胞有细胞毒作用[5]。目前,临床上已运用紫杉醇注射液治疗肝癌。然而,这类药物对肿瘤细胞的特异性差,毒性反应较大,易产生耐药性,这些缺陷对于临床的治疗带来了极大不便[6]。为了探索紫杉醇对肝癌细胞HepG2和原代肝细胞的影响,本研究以肝癌细胞HepG2和原代肝细胞为研究对象,通过细胞形态学、细胞活性和细胞凋亡检测等来比较分析紫杉醇对这两种细胞的毒性作用。初步探讨紫杉醇对两种细胞的凋亡影响,为探索其抗肝癌作用机制提供理论依据。
1 材料与方法
1.1材料
1.1.1细胞株 肝癌细胞株HepG2购自中国科学院上海生命科学研究院细胞资源中心。
1.1.2实验动物与试剂 SD大鼠♂,3只, 体质量(50±5)g,由广西医科大学实验动物中心提供。DMEM高糖培养基(DMEM-HG)、胎牛血清(FBS)、磷酸盐缓冲溶液(phosphate buffered solution,PBS)、胶原蛋白酶,均购自美国Gibco公司;紫杉醇购自黄石李时珍药业集团武汉李时珍药业有限公司,批号:国药准字H20058368;Hoechst 33258测试剂盒购自南京凯基生物科技发展有限公司; Annexin-V-FITC/碘化丙啶(propidium iodide,PI)双染试剂盒、MTT购自碧云天公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司。
1.1.3仪器 CKX41SF型倒置相差显微镜,日本Olympus公司产品;水套式CO2恒温培养箱,Shellab(SL)公司产品;台式离心机,上海安亭科学仪器厂产品;752N紫外分光光度计,上海精密科学仪器有限公司产品;MK3 Multiskon型酶标仪,美国Thermo Labsystems公司产品;荧光倒置显微镜,德国 Leica公司产品;流式细胞仪,美国BD LSRFortessa公司产品。
1.2方法
1.2.1肝癌细胞HepG2培养 在37℃电热恒温水浴箱中快速解冻肝癌细胞HepG2,而后将肝癌细胞HepG2培养于含10% FBS的高糖DMEM培养基(含100 U·L-1青霉素、100 mg·L-1链霉素和200 mol·L-1谷氨酰胺)中,放置在37℃、5% CO2饱和湿度细胞培养箱中培养并进行细胞传代。
1.2.2原代肝细胞培养 断头处死SD大鼠,无菌分离肝组织后均在冰浴下操作,4℃ PBS充分洗涤肝组织后,剥离肝被膜,机械剪切成1 mm3左右的组织小块,加入0.1%的胶原蛋白酶消化5 min,尽可能轻柔的吹散膨松絮状组织块,充分洗涤后,加入10% FBS的高糖DMEM培养基,重悬静置3 min,弃上段1/3液体,取中下层细胞悬液种瓶,置于37℃、5% CO2饱和湿度细胞培养箱中培养。当肝细胞在培养瓶长成致密单层后,取对数生长期的细胞进行传代扩增,用于后续实验。
1.2.3紫杉醇溶液制备 紫杉醇用DMSO助溶(DMSO终体积分数为0.1%)配制为10 mg·L-1的母液,-20℃储存备用。实验前,用无血清DMEM培养基稀释至所需终浓度分别为5、10、20、40、80 μg·L-1。
1.2.4MTT法检测紫杉醇对肝癌细胞HepG2和原代肝细胞的毒性 将肝癌细胞HepG2和原代肝细胞制备成单细胞悬液,接种于96孔板,每孔200 μL (1×104细胞/孔),用200 μL PBS液填充边缘孔。待细胞生长24 h后,将两类细胞的实验分别分为3组,即空白组、阴性对照组、紫杉醇组(n=5)。空白组为含10% FBS的DMEM-HG培养液。阴性对照组为含与实验组等量细胞的细胞悬液。紫杉醇组加入终浓度为5、10、20、40、80 μg·L-1的紫杉醇。以上3组分别培养24、48、72 h后,各孔加入5 g·L-1的MTT 20 μL继续培养4 h。4 h后吸弃孔内培养液,各孔加入150 μL DMSO,放置在摇床上低速震荡10 min,待紫色结晶物充分溶解后,置于检测波长为490 nm的酶标仪上检测吸光度值(optical density,OD)。分别计算紫杉醇对以上两类细胞的抑制率和24、48、72 h的半数抑制浓度(IC50),确定药物最适作用浓度和时间。抑制率/%=(1-实验组OD/对照组OD)×100%。以上实验重复3次。
1.2.5Hoechst 33258荧光染色法观察肝癌细胞HepG2和原代肝细胞凋亡的形态学变化 取出盖玻片浸泡于75%的乙醇中,30 min后酒精灯过火灭菌。灭菌好的盖玻片置于6孔板内。将肝癌细胞HepG2和原代肝细胞分别制备成单细胞悬液,以4.5×108·L-1接种于6孔板。待细胞培养24 h后,将以上两类细胞分别分为2组:阴性对照组与紫杉醇组(n=5)。阴性对照组在含10% FBS的DMEM-HG培养液中培养;紫杉醇组加入终浓度为5、10、20、40、80 μg·L-1的紫杉醇,药物处理24 h后, 弃去各孔培养液,PBS液充分洗涤3遍,取出盖玻片放入玻璃皿,浸泡于丙酮中固定30 min。PBS液洗3遍,每次2 min,避光加入1 mL Hoechst 33258染色液,染色15 min。吸弃染色液,PBS液洗3遍,每次5 min。封片,紫外光激发波长约340 nm,发射波长约460 nm,在倒置荧光显微镜下观察细胞形态并拍照。
1.2.6流式细胞术检测紫杉醇对肝癌细胞HepG2和原代肝细胞周期的影响 取肝癌细胞HepG2和原代肝细胞分别制备成单细胞悬液,细胞浓度为4.5×108·L-1,800 r·min-1离心10 min,收集细胞。用4℃的PBS缓冲液重悬细胞,并缓滴4℃无水乙醇,PBS与无水乙醇的比例为3 ∶7,每隔15 min摇1次,固定2 h。以800 r·min-1离心10 min,收集细胞。加入4℃ PBS液重悬,洗涤离心沉淀2次,然后向细胞沉淀中加入150 μL PI染液,4℃避光染色30 min,上流式细胞仪,检测各周期的百分率。
1.2.7流式细胞术检测紫杉醇对肝癌细胞HepG2和原代肝细胞凋亡的影响 将肝癌细胞HepG2和原代肝细胞分别制备成单细胞悬液,离心收集细胞,加入Binding Buffer 100 μL重悬细胞,然后依次加入Annexin-V-FITC和PI染液各5 μL,轻柔吹打混匀,室温避光染色15 min,再加入Binding Buffer 450 μL吹打混匀,上流式细胞仪检测。

2 结果
2.1紫杉醇对肝癌细胞HepG2和原代肝细胞的增殖抑制作用Fig 1的MTT结果显示,紫杉醇(5、10、20、40、80 μg·L-1)组分别处理肝癌细胞HepG2和原代肝细胞24、48、72 h后,对肝癌细胞HepG2和原代肝细胞增殖均有抑制作用,与阴性对照组比较,差异均有统计学意义(P<0.05)。且紫杉醇对肝癌细胞HepG2的抑制效果明显高于原代肝细胞。肝癌细胞HepG2的抑制率随着紫杉醇浓度的增加和作用时间的延长而明显增高;相同紫杉醇浓度下不同时间的抑制率差异均有统计学意义(P<0.05)。紫杉醇对肝癌细胞HepG2的抑制作用具有浓度时间依赖性,对于原代肝细胞呈现出浓度依赖性,但无时间效应关系。
2.2紫杉醇对肝癌细胞HepG2和原代肝细胞凋亡形态的影响紫杉醇(5、10、20、40、80 μg·L-1)分别处理肝癌细胞HepG2和原代肝细胞24 h后,Hoechst 33258染色后,在倒置荧光显微镜下观察到对照组肝癌细胞HepG2和原代肝细胞分布均匀,呈淡蓝色;而紫杉醇分别作用两组细胞后,可见细胞核呈折光性强的亮蓝色小点、细胞核浓染、形态不规则,呈半月形或者圆形,可见到凋亡小体。随着紫杉醇浓度增高,凋亡细胞数量增多,表明紫杉醇可浓度依赖性诱导肝癌细胞HepG2和原代肝细胞凋亡。且紫杉醇诱导肝癌细胞HepG2凋亡能力高于原代肝细胞(Fig 2)。
2.3紫杉醇对肝癌细胞HepG2和原代肝细胞周期的影响紫杉醇作用肝癌细胞HepG2和原代肝细胞24 h均能改变细胞周期,与阴性对照组相比,均能提高G2/M期细胞比例(P<0.05),且阻滞作用随着药物浓度的增加而增强。紫杉醇能明显提高肝癌细胞HepG2 G2/M 期比例,G0/G1期细胞比例降低(P<0.05),S期细胞变化不大(P>0.05)。见Fig 3。
2.4紫杉醇对肝癌细胞HepG2和原代肝细胞凋亡的影响不同浓度紫杉醇分别作用肝癌细胞HepG2和原代肝细胞24 h后,均能诱导两种细胞发生凋亡。流式细胞术结果见Tab 1,两组相比较,差异均有统计学意义(P<0.05)。由此可知,紫杉醇诱导两种细胞凋亡的程度不同,紫杉醇诱导肝癌细胞HepG2凋亡率明显高于原代肝细胞,且随着紫杉醇浓度的增高,细胞的凋亡率逐渐增加。
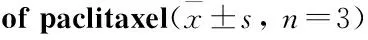
Tab 1 Comparison of apoptotic rates between HepG2 cells and hepatocytes treated by different concentrations
*P<0. 05vsHepG2 group
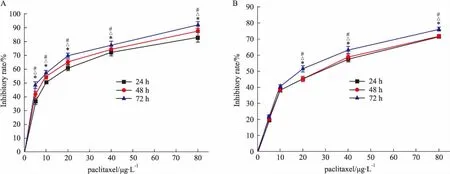
Fig 1 Inhibitory effects of paclitaxel on HepG2 cells (A) and hepatocytes(B) at 24 h, 48 h and 72
*P<0.05vscontrol group(24 h);△P<0.05vscontrol group(48 h);#P<0.05vscontrol group(72 h)
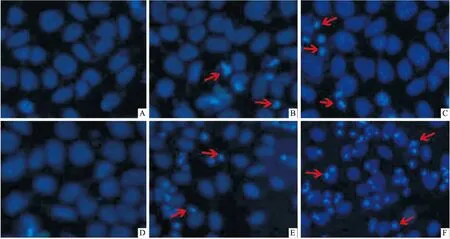
Fig 2 Effect of paclitaxel on apoptosis morphology of HepG2 cells and hepatocytes(×200)
A:Control group of hepatocytes;B:Hepatocytes injured by paclitaxel 20 μg·L-1for 24 h; C:Hepatocytes injured by paclitaxel 80 μg·L-1for 24 h;D:Control group of HepG2 cells;E:HepG2 cells injured by paclitaxel 20 μg·L-1for 24 h;F:HepG2 cells injured by paclitaxel 80 μg·L-1for 24 h.
Fig 3 Effect of paclitaxel on cell cycle of HepG2 cells and
*P<0.05,**P<0.01vscontrol group
3 讨论
紫杉醇是广西特色抗肿瘤中药,具有广谱抗癌活性。目前已广泛应用于治疗乳腺癌、肝癌、肺癌等[7-8]。周艳等[9]研究发现,紫杉醇在杀死癌细胞的同时,也会损害正常人体细胞,造成不良反应甚至死亡。本研究小组前期的实验结果与上述报道一致。由于肝细胞癌是临床常见的恶性肿瘤之一,且发病率连续攀升,已成为广西居民健康头号杀手[10-11]。为此,如何最大程度的发挥紫杉醇抗癌作用且使药物的毒副作用降到最低,是目前研究的热点问题。
本研究通过一定浓度梯度紫杉醇(5、10、20、40、80 μg·L-1) 分别培养肝癌细胞HepG2和原代肝细胞24、48、72 h,对其抑制增殖及其凋亡作用进行了对比研究。MTT结果表明,紫杉醇对肝癌细胞HepG2和原代肝细胞增殖均有抑制作用,且紫杉醇对肝癌细胞HepG2的抑制效果明显高于原代肝细胞。同时我们观察到紫杉醇对肝癌细胞HepG2的抑制作用具有浓度时间依赖性,这与吴裕文等[12]报道紫杉醇对人肝癌HepG2细胞的生长具有明显的抑制作用,且具有浓度依赖性的结果一致。孙炜等[13]也报道了紫杉醇能明显抑制人肝癌HepG2细胞的生长,呈明显量效关系。而对于原代肝细胞,随着紫杉醇质量浓度增高,抑制率逐渐增高,呈现出浓度依赖性,但无时间效应关系。
Hoechst 33258染色观察紫杉醇对两种细胞形态的影响,发现两种细胞都可出现凋亡小体,细胞核呈折光性强的亮蓝色小点、细胞核浓染、形态不规则,呈半月形或者圆形。流式细胞仪检测结果显示,紫杉醇可使肝癌细胞HepG2和原代肝细胞阻滞于G2/M期,改变了肝癌细胞HepG2和原代肝细胞的周期,且随着紫杉醇浓度的增高,G2/M期细胞所占比例也随之升高。有研究表明,紫杉醇抑制肿瘤细胞的分裂及增殖,使肿瘤细胞同步为G2/M期,从而发挥抗癌作用[14]。以上实验结果表明,紫杉醇抑制肝癌细胞HepG2和原代肝细胞的增殖是通过诱导细胞周期阻滞完成的。同时,还发现紫杉醇可以诱导肝癌细胞HepG2和原代肝细胞发生凋亡。但对两种细胞凋亡的程度不同,紫杉醇诱导肝癌细胞HepG2凋亡率明显高于原代肝细胞,且随着紫杉醇浓度的增高,细胞的凋亡率逐渐增加。由此可推测,紫杉醇对于抑制肝癌细胞HepG2和原代肝细胞的增殖抑制作用,和改变细胞周期比例及促进细胞凋亡的作用相关。有研究认为,肝癌细胞增殖的抑制和癌细胞周期的改变以及诱导癌细胞发生凋亡是目前抗肝癌的一种治疗手段[15]。另外,我们可以观察到相同浓度下,紫杉醇对肝癌细胞HepG2和原代肝细胞的凋亡率差异较大。猜测紫杉醇对肝癌细胞HepG2和原代肝细胞的作用基因或者信号途径可能存在差异性,如果可以区分紫杉醇在对这两种细胞凋亡过程中的差异,便利于在临床上更好的运用这类药物,能够最大限度发挥其作用,有效减少或者消除自身毒副反应,增加紫杉醇抗癌效果,从而提高临床疗效。这是我们后期研究的方向。
本实验证实了紫杉醇对肝癌细胞HepG2和原代肝细胞的毒性作用的确存在差异性,此差异性为紫杉醇在肿瘤防治的研究方面具有重要的意义。另外,本研究从细胞周期阻滞方面初步探索了紫杉醇抑制肝癌细胞增殖及自身毒副作用肝细胞损伤的机制,以期为紫杉醇临床用药提供可靠的理论基础和实验依据。
(致谢:本文全部实验均在广西科技大学科学实验中心完成,特此致谢!)
[1] Forner A,Llovet J M,Bruix J.Hepatocellular carcinoma[J].Lancet,2012,379( 9822):1245-55.
[2] Zhang J,Song J,Wu D,et al. Hesperetin induces the apoptosisof hepatocellular carcinoma cells via mitochondrial pathway mediated by the increased intracellular reactive oxygen species,ATP andcalcium[J].MedOncol,2015,32( 4):101.
[3] Chaveli-López B.Oral toxicity produced by chemotherapy:a systematic review[J].JClinExpDent,2014,6(1):e81-90.
[4] 宋秉智,施怀生. 肝毒性中药及其与药性和有效成分的关系[J].山西中医学院学报,2001,2(1):18-9.
[4] Song B Z, Shi H S.The relationship between herbs with hepatotoxicity and its property and active components[J].JShanxiCollTraditChinMed,2001,2(1):18-9.
[5] 徐雅玲,粱 菁,唐艳妮,等.紫杉醇对体外大鼠肝细胞影响的实验研究[J]. 暨南大学学报(自然科学与医学版),2015,36(2):146-9.
[5] Xu Y L,Liang J,Tang Y N,et al. Study of the influence of paclitaxel on hepatocytes of ratsinvitro[J].JJinanUniv(NatSciMedEd),2015,36(2):146-9.
[6] 张 清.紫杉醇注射液不良反应的预防及处理[J].临床合理用药杂志,2017,10(1):5-6.
[6] Zhang Q. Prevention and treatment analysis of adverse effects on paclitaxel injection[J].ChinJClinRationalDrugUse,2017,10(1):5-6.
[7] 蒲新霖,赵 领. 紫杉醇和姜黄素在肿瘤治疗中的联合应用[J].西南军医,2017,19(2):161-4.
[7] Pu X L,Zhao L. The application of paclitaxel combination curcumin for cancer therapy[J].JMilitarySurgeonSouthwestChina,2017,19(2):161-4.
[8] 徐雅玲,黄巨恩,粱 菁,等. 改构型酸性成纤维细胞生长因子对紫杉醇诱导体外大鼠肝细胞损伤保护作用的体外实验研究[J].暨南大学学报(自然科学与医学版),2016,37( 1) : 44-8.
[8] Xu Y L,Huang J E,Liang J,et al. Protective effects of MaFGF on the injury of hepatocytes induced by paclitaxelinvitro[J].JJinanUniv(NaturalSciMedEd),2016,37(1) :44-8.
[9] 周 艳. 抗肿瘤药紫杉醇的不良反应及临床合理用药分析[J].中国现代药物应用,2017,11(9):138-9.
[9] Zhou Y. Clinical rational drug use analysis and adverse reactions of antitumor drugs on paclitaxel[J].ChinJModDrugApplication,2017,11(9):138-9.
[10] 谢金玲,赵 川,李俊萱,等. 白花丹醌对人肝癌细胞HepG2 侵袭和凋亡的影响[J].中国药理学通报,2016,32(5):687-91.
[10] Xie J L,Zhao C,Li J X,et al. Effect of plumbagin on invasion and apoptosis of human hepatocellular carcinoma cell line HepG2[J].ChinPharmacolBull,2016,32(5):687-91.
[11] 夏丽洁,张富春. 肝癌治疗新靶点GPC3研究进展[J]. 中国药理学通报,2016,32(11):1486-9.
[11] Xia L J,Zhang F C. Research progress of a new therapeutic target in hepatocellular carcinoma glypican-3[J].ChinPharmacolBull,2016,32(11):1486-9.
[12] 吴裕文. 紫杉醇对肝癌HepG2细胞增殖及凋亡的影响[J].山东医药,2011,51(37):95-6.
[12] Wu Y W.Effect of paclitaxel on proliferation and apoptosis of human hepatocellular carcinoma cells HepG2[J].ShandongMedJ,2011,51(37):95-6.
[13] 孙 炜,宋祥和,卞勇华,等. 索拉菲尼联合紫杉醇对HepG2细胞的抑制作用及其对cyclin D1表达水平的影响[J].中国老年学杂志,2015,35(2):438-40.
[13] Sun W,Song X H,Bian Y H,et al. The effect of sorafenib and paclitaxel on inhibition of liver cancer cells and the expression levels of cyclin D1[J].ChinJGerontol,2015,35(2):438-40.
[14] 于 莹,任 耘.紫杉醇临床应用及安全性研究进展[J].天津药学,2017,29(2) :54-7.
[14] Yu Y,Ren Y. Advances in clinical application and safety of paclitaxel[J].TianjinPharm,2017,29(2) :54-7.
[15] 赵忠伟,韩 鹏. 龙胆苦苷对人肝癌 HepG2细胞的抑制作用[J].中国老年学杂志,2016,36(24):6082-3.
[15] Zhao Z W,Han P. Inhibitory effect of gentian on human hepatocellular carcinoma HepG2 cells[J].ChinJGerontol,2016,36(24):6082-3.

