甲氨蝶呤与左乙拉西坦在大鼠体内的相互作用研究
薛朝军,李 倩,支旭然,李 颖,李 宵,董占军,
(1. 河北医科大学研究生学院,河北 石家庄 050017;2. 河北省人民医院药学部,河北 石家庄 050051)
甲氨蝶呤(methotrexate,MTX)是一种叶酸拮抗剂,通过抑制二氢叶酸还原酶,阻止癌细胞分裂,用于治疗急性白血病[1]、乳腺癌、绒毛上皮癌等癌症。低剂量甲氨蝶呤用于治疗类风湿性关节炎、银屑病、硬皮病等自身免疫性疾病[2]。由于缺乏特异的毒性生物标志物,甲氨蝶呤副作用的发生往往是不可预知的,应根据患者疾病的需求选择适当剂量的氨甲喋呤并监测血药浓度。
左乙拉西坦(levetiracetam,LEV)在临床上主要用于治疗各种癫痫,其机制可能是通过选择性地抑制癫痫样放电,以及与突触囊泡白蛋白2A结合,对突触前突触囊泡释放神经递质产生影响[3],具体机制目前尚不清楚。左乙拉西坦临床用于4岁以上儿童癫痫患者部分性发作的加用治疗。左乙拉西坦副作用较小,目前临床上进行了左乙拉西坦治疗自闭症[4]、头痛[5]等疾病研究。加拿大卫生部提示,左乙拉西坦和甲氨蝶呤相互作用具有潜在风险。这两种药物合用可能会导致血液中甲氨蝶呤浓度升高,引起可能是致死性(包括突发急性肾衰竭)的严重副作用。文献报道,甲氨蝶呤和左乙拉西坦都是p-gp的底物[6-7]。由于在甲氨蝶呤和左乙拉西坦在临床上存在合用的可能性,而这两药合用后可能会发生相互作用,因此开展此研究,以期为临床合理用药提供依据。
1 材料
1.1药品与试剂甲氨蝶呤(索莱宝公司,纯度:99%);左乙拉西坦(J&K Scientific Ltd,纯度:99%);氨基蝶呤(上海源叶生物有限公司,纯度:99%);甲醇、乙腈、三蒸水等。
1.2仪器Shimadzu LC-30AD型超高效液相色谱系统(日本岛津公司);AB Sciex Triple Quad 5500型三重四级杆串联质谱仪(美国AB公司);Hettich Zentrifuge 1602型高速低温离心机(德国Hettich公司);KQ3200E 型超声波清洗器(昆山市超声仪器有限公司);AB204-S型标准型的分析天平(瑞士METTLER TOLEDO公司) ;XW-80A型旋涡混合器(上海精科实业有限公司);Milli-Q纯水仪(默克化工技术有限公司)等。
1.3实验动物健康♂ SD大鼠,体质量(250±20) g,由河北医科大学中实验动物中心提供,生产合格证号:1707095,使用许可证号:SCXK(冀)2013-10003。
2 方法
2.1色谱条件色谱柱:Waters ACQUITY®UPLC HSS T3(100 mm×2.1 mm,1.8 μm);柱温:40℃;自动进样器:4℃;流动相:乙腈(B)、含0.1%甲酸水(A),梯度洗脱(0 min,5% B; 3.5 min,95% B;4 min,95% B;4.2 min,5% B;4.5 min,stop);时间:4.5 min;流速:0.2 mL·min-1;进样量:2 μL。
2.2质谱条件离子化源:电喷雾离子源(ESI),正离检测;气帘气压力为30 kPa;碰撞气压力是8 kPa;喷雾电压是5 500 V;去溶剂温度为600℃;雾化气压力为60 kPa;辅助气压力是60 kPa;入口电压是10 V;碰撞室出口电压为14 V。MTX、LEV和氨基蝶呤(内标)的质谱参数见Tab 1。
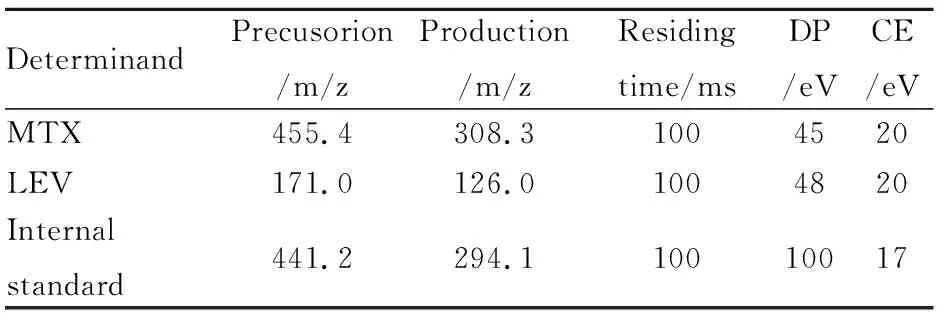
Tab 1 Patameters of mass spectrometry
2.3溶液的配制
2.3.1储备液和工作液配制 分别精密称取MTX、LEV适量,放到10 mL棕色的容量瓶中,用甲醇溶解定容,配制成MTX、LEV浓度分别是2.2 mmol·L-1和5.9 mmol·L-1的贮备液,于4℃冰箱储存。用移液枪分别精密吸取MTX、LEV标准品贮备液适量,用50%甲醇水溶液逐级稀释,配制成MTX浓度为11、4.4、2.2、1.1、0.22、0.11、0.022、0.011 μmol·L-1的工作液和LEV浓度为58.8、29.4、11.8、5.88、2.94、0.588、0.294、0.0588 μmol·L-1工作液,备用。精密称取氨基蝶呤(内标)适量置于10 mL容量瓶中,用甲醇溶解至刻度线均匀,配制成浓度为0.227 mmol·L-1的内标贮备液,置于4℃冰箱保存。精密吸取氨基蝶呤500 μL,置于50 mL的容量瓶中,加甲醇稀释至刻度,摇匀,配制成质量浓度为2.27 μmol·L-1的内标,4℃冷藏,备用。
2.3.2标准曲线和质控样品配制 用移液枪量取5 μL上述配好的工作液,加入45 μL空白大鼠血浆配制MTX和LEV的血浆标准曲线,使得终浓度分别为1.1、2.2、11、22、110、220、440、1 100 nmol·L-1;5.88、29.4、58.8、294、588、1 180、2 940、5 880 nmol·L-1。精密称取MTX和LEV各10.0 mg,按照上述方法配制低、中、高3个质控制(QC)样品,MTX、LEV浓度分别为2.2、110、880 nmol·L-1;11.8、588、4 700 nmol·L-1。
2.4给药方案、样品采集与处理大鼠随机分为3组:1 mg·kg-1MTX组、180 mg·kg-1LEV组、合用组,每组5只。在0、0.16、0.5、1、1.5、2、3、4、6、8、10、24、48 h眼底静脉丛取血,离心取血浆用于检测;将大鼠饲养于代谢笼,并按分组灌胃给药,于8、24、48 h收集尿液用于检测;按上述分组给药后在1、2、4 h取大鼠肝、肾标本进行HE染色。取血浆、稀释尿液样品50 μL,加入10 μL内标和150 μL甲醇沉淀剂,涡旋2 min,离心(12 000×g,10 min),取上清液100 μL用于UPLC/MS/MS的测定。血浆和尿液于-20℃冰箱保存待测。
2.5方法学验证
2.5.1专属性 按照“2.3”项下要求,用大鼠的空白血浆,配成1.1 nmol·L-1的MTX和5.88 nmol·L-1LEV血浆样品,与空白血浆经处理后一起分析,观察空白血浆中的成分是否对待测物和内标存在干扰。
2.5.2线性、最低定量限 按照“2.3”项下要求配制标准曲线,以待测物浓度(x)为横坐标,待测物与内标的峰面积比值(y)为纵坐标,用加权(W=1/x2)最小二乘法进行回归运算,并计算标准曲线的线性回归系数(r2>0.99)。最低定量(LLOQ)为标曲的最低点。
2.5.3精密度、准确度 按照“2.3”项下要求配的3个QC浓度的样品,每一浓度6个样本,1 d内同批次处理,连续检测3 d并进行分析,根据当日的标准曲线计算QC样品浓度,评价分析方法的准确度与精密度结果RSD和RE应在± 15%之内。
2.5.4提取回收率、基质效应 按照“2.3”项下要求配制3个QC浓度的血浆样品,每个浓度6个样本,并按照“2.4”项进行处理后进行分析。样本为A。分别取5只大鼠的空白血浆50 mL,加入150 mL甲醇,涡漩1 min后离心(12 000 ×g,10 min),取上清液45 mL,加入5 mL工作液(相当于甲氨蝶呤2.2、110、880 nmol·L-1;左乙拉西坦11.8、588、4 700 nmol·L-1),按照“2.4”项处理后,LC-MS/MS测定。样本为B。按照“2.3”项下要求,配的3个QC浓度的工作液,每个浓度6个工作液,并直接进样分析。样本为C。计算公式:提取回收率=A/B;基质效应=B/C。
2.5.5稳定性 稳定性考察是指甲氨蝶呤和左乙拉西坦在血浆样品室温放置4 h、经历3次冷冻、解冻循环和4℃冷藏8 h的稳定性。按照“2.3”项下要求,配制低、中、高浓度的QC血浆样品,每个浓度在每个稳定条件平行6个样本进行分析。储存的样品与新配制样品相比较来证明样品稳定性。用空白大鼠血浆稀释工作液,每一个浓度平行6个样本,考察稀释稳定。样本浓度均在配制浓度的±15%范围,则样品稳定。
2.5.6生物样品的适用性 按照“2.3”项下要求,分别制备3个浓度的QC,每浓度平行6份的稀释尿液样品进行分析。样品浓度的RSD在±15%以内,则该分析方法适用于稀释尿液样品。

3 结果
3.1方法学
3.1.1专属性 血浆样品中,甲氨蝶呤、左乙拉西坦、氨基蝶呤保留时间分别为3.02 min、3.09 min和2.95 min,空白血浆中的内源性物质不干扰测定,方法专属性高(Fig 1)。
3.1.2线性和最低定量限 左乙拉西坦:y=0.061 2x+0.2429 (r2=0.991 9);线性范围为5.88~5 880 nmol·L-1,最低定量限为5.88 nmol·L-1;甲氨蝶呤:y=0.026 6x+0.462 5 (r2=0.9936);线性范围为1.1~1 100 nmol·L-1,最低定量限1.1 nmol·L-1。
3.1.3精密度和准确度 甲氨蝶呤和左乙拉西坦的质控样品在日内精密度、日间精密度、准确度都符合生物样本要求(Tab 2),表明该分析方法的重现性比较好,可用于检测左乙拉西坦和甲氨蝶呤的浓度。
3.1.4提取回收率和基质效应 甲氨蝶呤和左乙拉西坦在3个浓度水平上的提取回收率、基质效应都符合药典规定(Tab 3)。
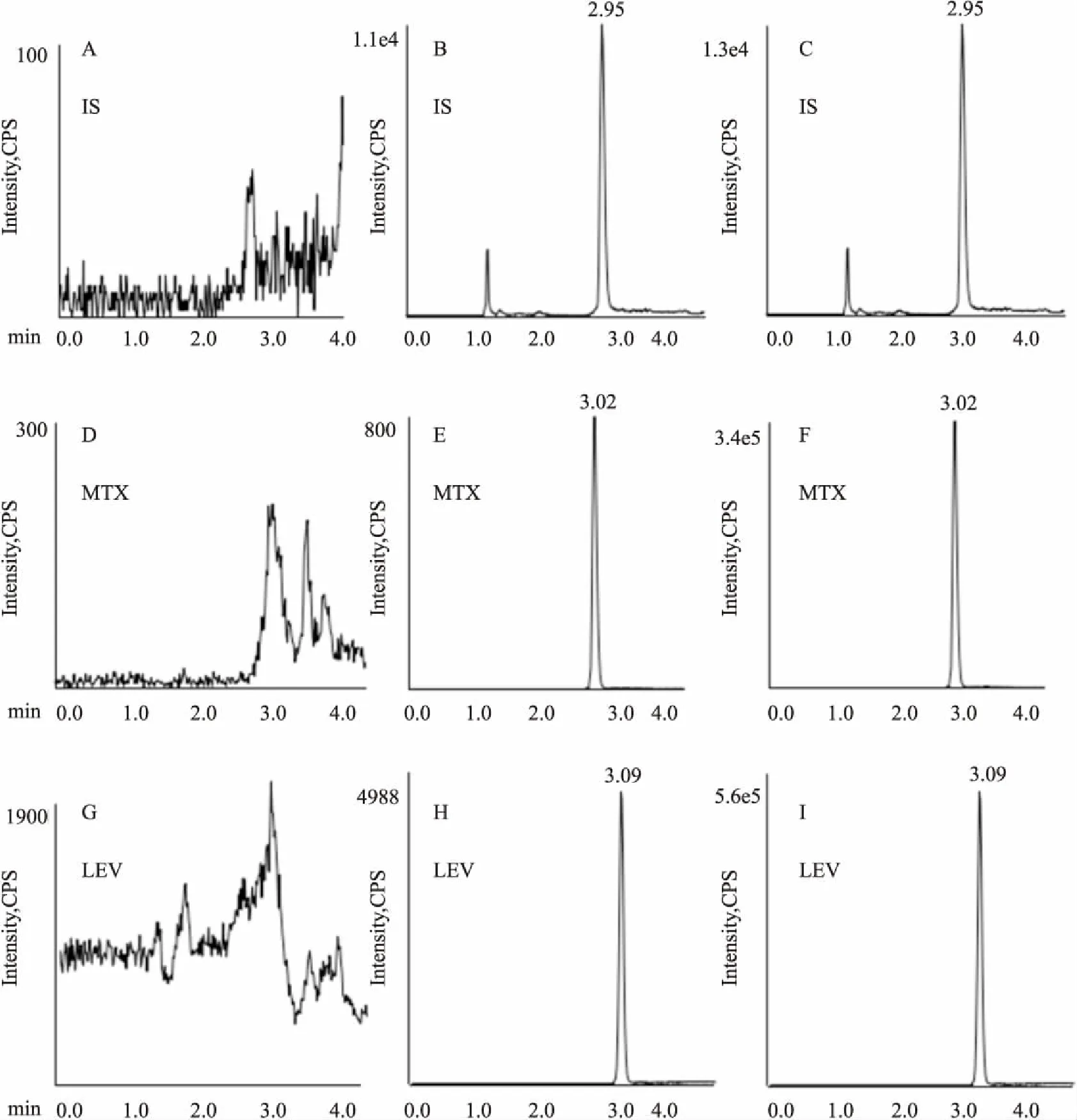
Fig 1 Representive MRM chromatograms of IS, MTX and LEV
A, D, G:Representative chromatograms blank plasma; B, E, H: Representative chromatograms of blank homogenate spiked with IS, LEV and MTX; C, F, I: Representative chromatograms of plasma sample from pharmacokinetic study after coadministration of LEV and MTX. IS: Aminopurine; MTX: Methotrexatein; LEV: Levetiracetam.
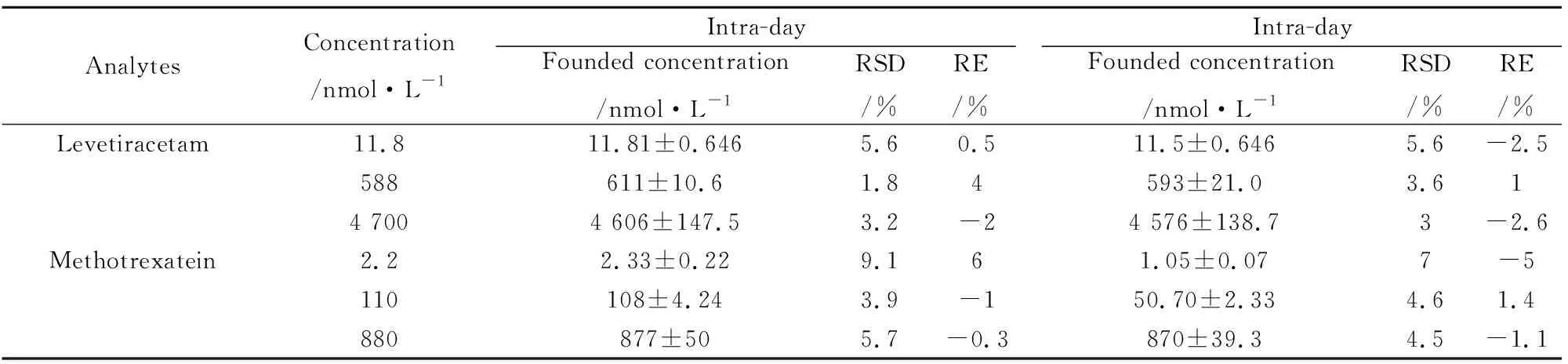
Tab 2 Accuracy and precision of methotrexate and levetiracetam in rat plasma

Tab 3 Matrix effect and extraction recovery of methotrexate and levetiracetam in rat plasma

Tab 4 Stability of levetiracetam and methotrexatein in rat plasma
aPlace 4h at room temperature(25℃);b4℃ storage for 8 h;c-20℃ refrigeration cycle three times
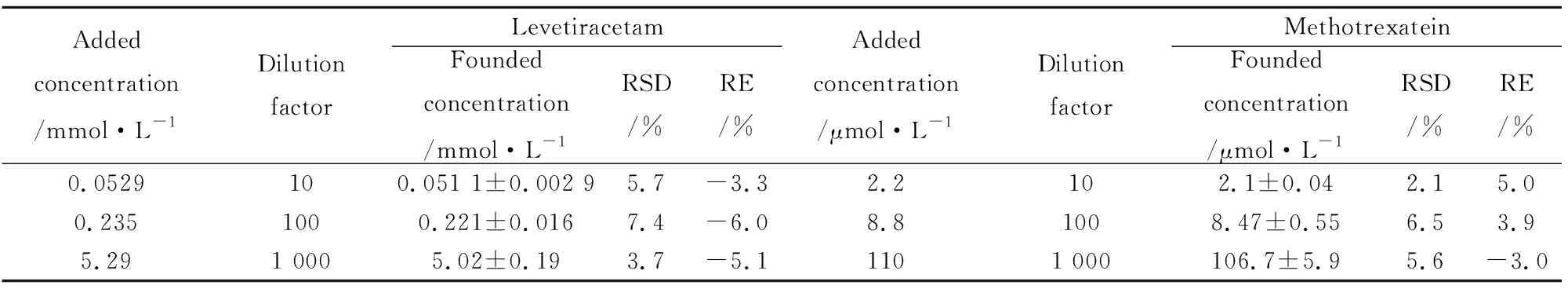
Tab 5 Dilution effect of methotrexate and levetiracetam in plasma samples
3.1.5稳定性 甲氨蝶呤和左乙拉西坦血浆样品室温放置4 h、经历3次冷冻、解冻循环和4℃冷藏8 h后,稳定性良好,见Tab 4;血浆样品稀释后,甲氨蝶呤和左乙拉西坦的精确度和准确度都满足要求(Tab 5),表明样品可被稀释。
3.1.6生物样品的适用性 为了分析该方法在稀释尿液样品中的适用性,我们分析了3个浓度的稀释尿液样品,其RSD和RE值满足要求(Tab 6)。
3.2MTX与LEV在大鼠体内相互作用研究
3.2.1药代动力学参数研究 为了探究MTX和LEV在大鼠体内的相互作用,我们进行了大鼠体内的药代动力学试验。MTX和LEV在大鼠体内的药代动力学参数见Tab 7,药时曲线见Fig 2。两药合用后,MTX的Cmax、AUC0-t、Tmax值升高,T1/2、Cl、MRT值下降,各参数差异有统计学意义;LEV的Tmax、T1/2、Cl有一定的上升趋势,AUC0-t有一定的下降趋势,各参数差异无统计学意义。结果表明LEV明显增加MTX在大鼠体内的吸收。
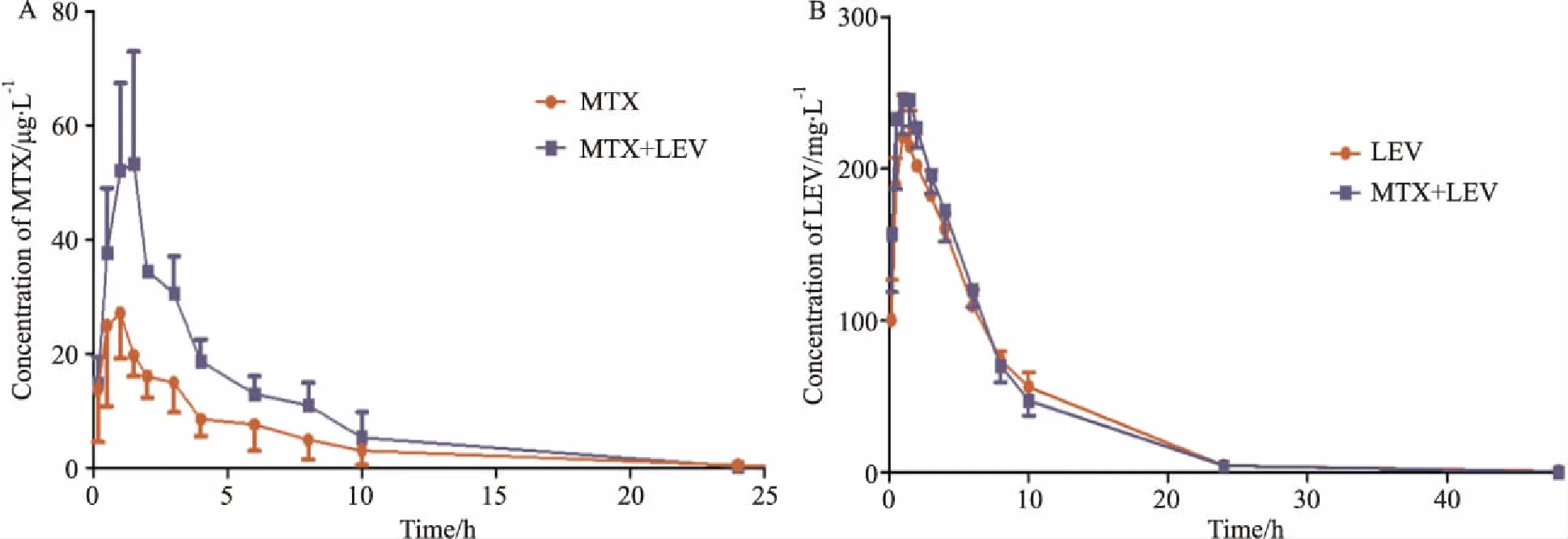
Fig 2 Mean plasma concentration-time curves of MTX and LEV in rats
A: Mean plasma concentration-time curves of MTX after oral administration MTX and MEX plus LEV; B: Mean plasma concentration-time curves of LEV after oral administration MTX and MEX plus LEV.
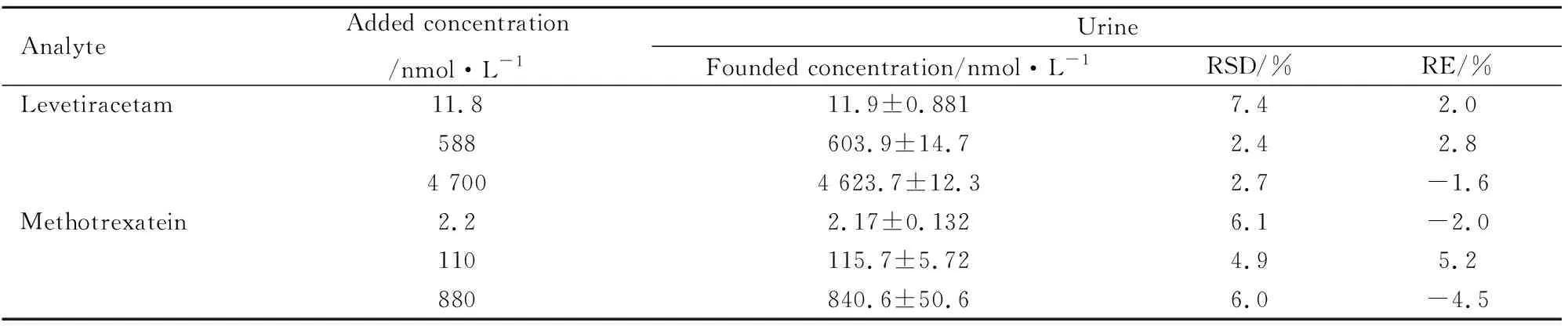
Tab 6 Application of analytical methods in the Urine samples
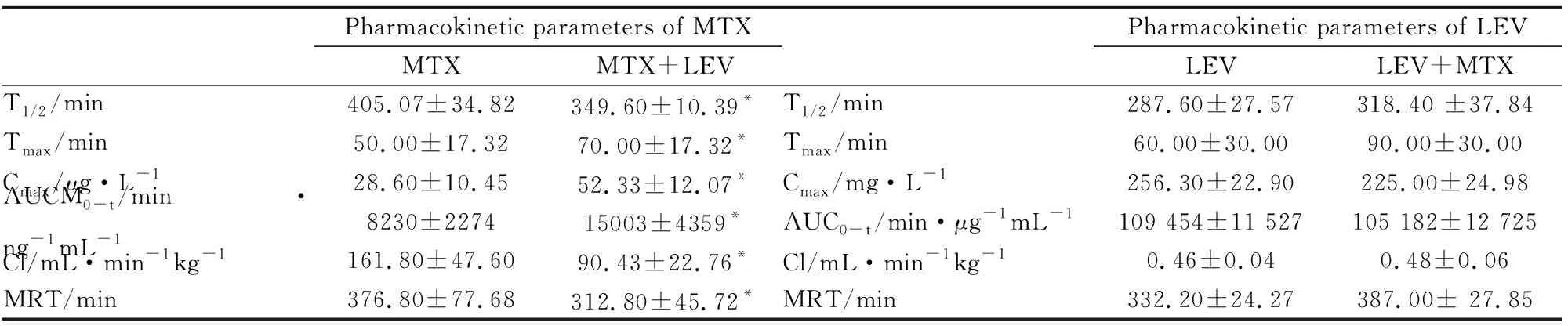
Tab 7 Pharmacokinetic parameters of methotrexatein and levetiracetam
*P<0.05vsMTX group
3.2.2肾脏排泄研究 为了探究MTX血药浓度升高对肾脏排泄的影响,我们通过代谢笼验证了MTX和LEV单用及合用后大鼠的肾脏排泄水平。在8、24、48及48 h总量4个水平上,与口服单用MTX和LEV组相比,MTX肾脏排泄量在合用组明显增多,而LEV的肾脏排泄量在合用组减少,差异均有统计学意义(Fig 3)。结果表明,LEV明显增加MTX在大鼠体内的吸收,使其血药浓度升高、肾排泄增加。
3.2.3肝肾毒性研究 为了探究MTX血药浓度及尿排泄的增加对肝肾急性毒性的影响,选取给药后1、2、4 h 3个时间点,取老鼠肝、肾组织,经福尔马林溶液固定24 h后,经石蜡切片进行HE染色后。肝脏病理切片结果显示,与对照组相比,MTX组、LEV组肝脏均无明显的病理变化,MTX和LEV合用组肝损伤也不明显,仅在4 h组在肝门静脉附近肝细胞有少量的空泡样变性(红色箭头所示部位,Fig 4)。肾脏病理切片结果显示,与对照组相比,LEV组大鼠肾脏无病理学改变,MTX组大鼠肾脏在肾小球附近部分肾小管可见轻微损伤,表现为颗粒空泡样变性、管腔轻度扩张(红色箭头所示部位),MTX和LEV合用组肾小管损伤明显增加,表现为肾小管大量的颗粒空泡样变性、部分刷毛缘脱落、部分管腔可见细胞碎片(红色箭头、红色方框所示部位,Fig 5)。结果表明,合用MTX和LEV后大鼠肝肾毒性都明显增加,且肾脏毒性的增加远高于肝毒性。

Fig 3 Renal excretion of MEX and LEV in rats
A: Renal excretion of MEX after oral administration MTX and MEX plus LEV at 8 h, 12 h, 24 h.*P<0.05vsMTX group; B: Renal excretion of LEV after oral administration MTX and MEX plus LEV at 8 h, 12 h, 24 h.*P<0.05,**P<0.01vsLEV group.

Fig 4 Rats liver pathological slices(HE×200)
Rat liver was taken after oral administration LEV, MTX and MTX plus LEV at 1 h, 2 h and 4 h. The red arrow marks the place where the damage occurred. Compared to LEV and MTX group, MTX plus LEV group increased liver damage significantly.
4 讨论
由于MTX具有抗炎和免疫抑制双重作用[8],因此在临床应用比较广泛,但其毒副作用也比较明显。2017年3月23日,国家药品不良反应监测中心发布的药物警戒快讯中提到,加拿大卫生部提示LEV和MTX合用可能会导致血液中MTX浓度升高,引起可能是致死性(包括突发急性肾衰竭)的严重副作用[8]。我们的实验证明,LEV明显增加MTX在大鼠体内的吸收,使其血药浓度升高,肾排泄增加,造成明显的肝肾损伤,且对肾脏毒性的影响要明显大于肝脏毒性。有文献报道[9],LEV可以延长MTX的排泄。本实验结果表明,口服合用LEV与MTX后,MTX的排泄明显增加,而LEV的排泄明显减少。MTX的排泄明显增加可能是因为MTX血药浓度增加的原因,但也不排除LEV与MTX在肾脏发生相互作用的可能。考虑到合用LEV与MTX后,LEV在血药浓度变化无统计学意义的情况下肾脏排泄明显减少,MTX与LEV以肾脏为靶点发生相互作用的可能性是很大的,需要进一步实验来验证两药在肾脏相互作用的机制。本实验结果提示,临床上联合使用LEV与MTX时需要进行剂量调整。

Fig 5 Rats kidney pathological slices(HE×400)
Rat kidney was taken after oral administration LEV, MTX and MTX plus LEV at 1 h, 2 h and 4 h. The red arrow marks the place where the damage occurred. Compared to LEV and MTX group, MTX plus LEV group increased kidney damage significantly.
(致谢:感谢河北省临床医学研究中心/河北省代谢病重点实验室提供大鼠实验的实验室;感谢河北省人民医院病理科康林老师对病理切片结果的指导。)
[1] 李 园,王 迎,林 冬,等.大剂量甲氨蝶呤治疗成人急性淋巴细胞白血病的药物代谢研究[J].癌症进展,2015,13(1):100-4.
[1] Li Y, Wang Y, Lin D, et al. A study on pharmacokinetics of high dose methotrexate (HD-MTX) in adults with acute lymphoblastic leukemia[J].CancerProg,2015,13(1):100-4.
[2] 黄 晶,舒晓明,王 贵,等.甲氨蝶呤治疗类风湿关节炎的作用机制[J].中华临床医师杂志(电子版),2016,10(21):3276-80.
[2] Huang J,Shu X M,Wang G, et al. Mechanism of methotrexate in treating rheumatoid arthritis [J].ChinJClin(Elect),2016,10(21):3276-80.
[3] Wang M, Jiang L,Tang X. Levetiracetam is associated with decrease in subclinical epileptiform discharges and improved cognitive functions in pediatric patients with autism spectrum disorder[J].NeuropsychDisTreat, 2017,13:2321-6.
[4] Wasserman S, Iyengar R, Chaplin W F, et al. Levetiracetam versus placebo in childhood and adolescent autism: a double-blind placebo-controlled study[J].IntClinPsychopharmacol,2006,12(6):363-7.
[5] Verma A,Srivastava D,Kumar A, et al. Levetiracetam in migraine prophylaxis: a randomized placebo-controlled study in a rural medical institute in northern India[J].ClinNeuropharmacol, 2013,36(6):193-7.
[6] Zhu Y,Meng Q,Wang C,et al. Methotrexate-bestatin interaction: involvement of P-glycoprotein and organic anion transporters in rats[J].IntJPharm,2014,465(1-2):368-77.
[7] Luna-Tortos C, Fedrowitz M, Loscher W. Several major antiepileptic drugs are substrates for human P-glycoprotein[J].Neuropharmacology, 2008,5(8):1364-75.
[8] 原琴琴,周玉敏,顾 兵,等.低剂量甲氨蝶呤的抗炎作用机制及其在脊髓损伤中应用[J].中国药理学通报,2017,33(3):312-6.
[8] Yuan Q Q,Zhou Y M,Gu B,et al. Anti inflammatory mechanism of low-dose methotrexate and its application in spinal cord injury [J].ChinPharmacolBull, 2017,33(3):312-6.
[9] Reeves D, DiDominick S, Finn S, et al. Methotrexate elimination when coadministered with levetiracetam[J].AnnPharmacother, 2016,50(12):1016-22.

