一种含有2-吡啶基噻吩的噻唑小分子的合成及其对HSO3的识别
唐定国,曾榕清,姚凯月,李襄宏
(中南民族大学 化学与材料科学学院,武汉430074)
随着化学化工、生物、医药及环境学科的迅速发展,对阴离子的高效识别与传感已成为研究的热点.HSO3-可作为食品和药品添加剂,具有防腐、抗氧化、保鲜和抑制酶促褐变等作用.HSO3-在生理过程中起到积极作用,包括血管舒张,抗高血压,调节血管平滑肌和心脏通道功能[1,2],但是过量摄入会引发哮喘、呼吸困难、荨麻疹和肠胃不适等[3].在工业排放的大量废气中,SO2作为有毒有害气体,可经呼吸系统进入人体或动物,经叶面气孔进入植物体内后,能与水结合再分解为其衍生物SO32-和HSO3-[4,5],过量的SO2极易转化为HSO3-而引起酸雨,破坏陆地生态系统和水域生态系统.因此,发展新的选择性好、方便、灵敏度高的检测阴离子的分析方法具有重要意义.
目前检测HSO3-的方法主要有化学发光法[6]、磷光色谱分析法[7]、电化学分析法[8]和离子选择性电极法[9,10]等.然而,这些方法或选择性差,或需要复杂的样品预处理,或灵敏度不足以达到样品的检测要求.相较而言,利用吸收光谱和荧光光谱设计的离子传感器无需借助昂贵的仪器设备,可通过“裸眼”观察来检测,在实际应用中更为简便、直观,具有高选择性、高灵敏度、低检测限、操作简单等优点[11,12],颇受青睐.
本文以1-乙基碘化-2-甲基苯并噻唑为原料,与5-(2-吡啶基)噻吩-2-甲醛反应制备得到目标产物1(合成路线如图1).用1H NMR和MS对该化合物进行了表征,并利用紫外-可见光谱研究了Cl-,Br-,I-,NO3-,H2PO4-,CO32-,HCO3-,ClO4-,SO42-,Ac-,HS-,HSO3-等阴离子对化合物1光谱的作用情况.该化合物在CH3CN/HEPES(pH=7.0,体积比1∶99)中与HSO3-和HS-发生亲核加成反应,打破了其共轭结构,导致紫外光谱蓝移137 nm,颜色由深黄色变为无色,裸眼即可识别.

图1 化合物1的合成路线Fig.1 The synthetic route of the compound 1
1 实验部分
1.1 仪器和试剂
紫外可见分光光度计(Shimadzu UV-2550型,日本岛津),核磁共振仪(AVAVCE III-500 MHz型,瑞士Burker),质谱仪(AB Scies MALDI-TOF-TOF, 北京柏莱斯特科技).4-(2-噻吩基)苯甲醛按文献[13]合成并通过1H NMR表征,其他所用试剂购自国药集团化学试剂有限公司,均为分析纯,除特别注明外,未进行纯化.
1.2 1-乙基碘化-2-甲基苯并噻唑的合成
根据文献[14]合成1-乙基碘化-2-甲基苯并噻唑,称取2-甲基苯并噻唑(1.0145 g,6.80 mmol)于三口烧瓶中,用真空泵抽干2-甲基苯并噻唑,加入碘化乙烷(1.2845 g,8.24 mmol),无水乙腈(15 mL),通入氩气,回流24 h,停止反应,冷却至室温,有固体析出,减压抽滤,滤渣用石油醚洗涤3次,真空干燥后,得到浅绿色固体0.8450 g,产率为37 %.1H NMR (400 MHz, Acetonitrile-d3),δ: 8.26 (d,J=8.2 Hz, 1H), 8.14 (d,J=8.5 Hz, 1H), 8.01~7.87 (m, 1H), 7.82 (t,J=7.7 Hz, 1H), 4.70(q,J=7.4 Hz, 2H), 3.13 (s, 3H), 1.55 (t,J=7.4 Hz, 3H).
1.3 化合物1的合成
依次加入1-乙基碘化-2-甲基苯并噻唑(0.0510 g,0.17 mmol)、5-(2-吡啶基)噻吩-2-甲醛(0.0394 g,0.21 mmol),无水乙醇(10 mL)于三口烧瓶中,通入氩气,搅拌,于80 ℃回流24 h.停止反应,冷却至室温,有大量橘红色固体析出,减压抽滤,固体用V(石油醚)∶V(乙酸乙酯)=3∶1的混溶液洗涤3次.真空干燥后,得到0.050 g红色固体1,产率为57%.1H NMR (CD3CN, 400 MHz),δ: 8.58 (s, 1H), 8.25(q,J=8.30 Hz, 2H), 8.04(d,J=7.72 Hz, 1H), 7.93~7.84(m, 3H), 7.77(d,J=4.68 Hz, 3H), 7.45~7.34 (m, 2H), 4.78(q,J=6.60 Hz, 2H),1.56(t,J=6.90 Hz, 3H). MS(Maldi-TOF, CHCA):m/zcalculated for 348.97(M-I--H+), found: 348.97.
1.4 阴离子与化合物1作用的滴定实验
准确称取该化合物0.0040 g,并用少量乙腈溶解后转移至10 mL容量瓶中定容得到浓度为0.9 mmol·L-1的储备液.移取储备液33 μL,用CH3CN/HEPES缓冲液[20 mmol·L-1,pH=7.0,V(CH3CN)∶V(HEPES)=1∶99]稀释得到浓度为10 μmol·L-1的溶液,在光谱仪上测试得到其紫外-可见吸收光谱.
用移液枪移取3 mL化合物1溶液[10 μmol·L-1,V(CH3CN)∶V(HEPES)=1∶99]于1 cm光程长的石英槽中,以微量注射器取定量的阴离子储备液逐步加入到石英槽内,静置3 min充分混合,再测定其紫外-可见吸收光谱.阴离子的总加入量不超过150 μL,以保证溶液体积无明显变化.
2 结果与讨论
2.1 紫外-可见吸收光谱研究化合物1对不同阴离子及氨基酸的识别
在HEPES缓冲体系中,研究了化合物1(10 μmol·L-1)与不同阴离子作用的紫外-可见光谱变化情况并作出其在437 nm处吸光度的柱形图,结果见图2.如图2所示:当分别加入500 μmol·L-1的Cl-,Br-,I-,NO3-,H2PO4-,CO32-,HCO3-,ClO4-,SO42-,Ac-,gly,Cys,Hcys等阴离子及氨基酸时,其位于437 nm的吸收峰强度无明显变化;而加入HSO3-之后,其位于437 nm处的最大吸收峰强度几乎降为0. 值得一提的是,当加入HS-时,437 nm处的吸收峰强度明显降低,但未完全消失.由此可见,在常见阴离子中,仅HSO3-和HS-对化合物1的UV-Vis吸收光谱有显著作用.

1~15)Cl-,Br-,I-,Ac-,ClO4-,CO32-,H2PO4-,HCO3-,NO3-,SO42-,gly,Cys,Hcys,HSO3-,HS-图2 化合物1与500 μmol·L-1不同阴离子混合后的吸光度图Fig.2 Absorption spectra of compound 1 in the presence of 500 μmol·L-1 of different anions
2.2 紫外-可见吸收光谱研究化合物1对HSO3-的识别
化合物1与不同浓度的HSO3-作用的紫外-可见吸收光谱滴定结果见图3.如图3所示:向化合物1溶液中加入HSO3-后,它在437 nm处的吸光值逐渐降低,300 nm处的吸光值逐渐增强.当加入HSO3-的浓度达到2 μmol·L-1,最大吸收峰强度降至最低,再继续加入HSO3-时,溶液的吸收光谱则不再发生明显变化(见图3插图).此时,吸收光谱蓝移了137 nm,溶液颜色由黄色褪为无色.这种吸收光谱和溶液颜色的变化是由于化合物1提供了与HSO3-进行1,4-加成反应的位点,导致二者反应后,化合物1中的共轭结构被破坏,引起吸收光谱蓝移.
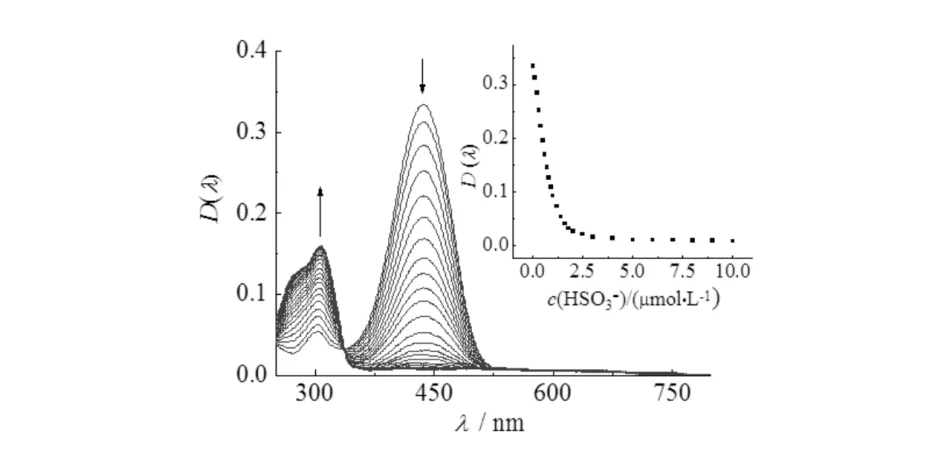
插图:化合物1与HSO3-的滴定曲线图图3 化合物1 (10 μmol·L-1)在不同浓度HSO3-溶液(0~10 μmol·L-1)中的紫外-可见光谱图Fig.3 UV-Vis spectra of compound 1 (10 μmol·L-1) in the presence of HSO3- (0-10 μmol·L-1)
化合物1在437 nm处的吸光度值与HSO3-浓度的线性相关曲线结果见图4.从图4可见:化合物1与HSO3-(0~8 μmol·L-1)有较好的线性关系(线性相关系数R2=0.998),表明化合物1可用来定量检测HSO3-的浓度.根据文献计算方法[15], 化合物1对HSO3-的检出限为0.21 μmol·L-1.

图4 化合物1在437 nm处的吸光度值与HSO3-浓度的线性相关曲线Fig.4 Linear relation between absorption of compound 1 at 437 nm and concentration of HSO3-
2.3 紫外-可见吸收光谱研究化合物1对HS-的识别
图5为不同浓度的HS-与化合物1(10 μmol·L-1)反应的紫外-可见吸收光谱变化图.由图5可知:加入HS-后,其紫外-可见光谱图的峰位变化与HSO3-基本一致.与HSO3-相比,尽管二者变化趋势和峰位十分相近,但HS-需要的反应浓度明显增加,且437 nm处的吸收峰不能完全消失.图5插图a为1与HS-反应的滴定曲线,要使二者反应完全,即吸光度不再变化时所需要的HS-达到化合物1本身浓度的20倍以上,大大高于HSO3-的量.如图5插图b所示,化合物1与HS-(0~90 μmol·L-1)有较好的线性关系(线性相关系数R2=0.994),表明化合物1可以用来定量检测HS-的浓度.经计算,化合物1对HS-的检出限为2.5 μmol·L-1.

插图:a)化合物1与HS-的滴定曲线图;b)化合物1在437 nm处的吸光度值与HS-浓度(0 ~ 90 μmol·L-1)的线性相关曲线图5 化合物1在不同浓度HS-溶液(0~400 μmol·L-1)中的紫外-可见光谱图Fig.5 UV-Vis spectra of compound 1 in the presence of HS- solution (0-400 μmol·L-1)
2.4 化合物1对HSO3-和HS-响应的动力学研究
图6为化合物1(10 μmol·L-1)溶液中分别加入不同浓度的HSO3-和HS-后,其吸收光谱随时间变化的情况.可以看出,化合物1与 HSO3-的反应速度快,且需要的浓度低.尤为值得一提的是,在加入相同浓度(100 μmol·L-1)的HSO3-和HS-后,HSO3-可引起437 nm处的吸光度值迅速下降,在1 min 时即可达到平衡,吸光度值接近0;而在1 min时,HS-仅引起吸光度下降了10%,在7 min时,溶液在437 nm 处的吸光度仍然为初始值的65%.这一结果表明,在离子浓度较低的情况下,HSO3-反应速度更快,短时间内HS-对HSO3-的识别无明显干扰.因此,化合物1可用于快速选择性检测HSO3-.
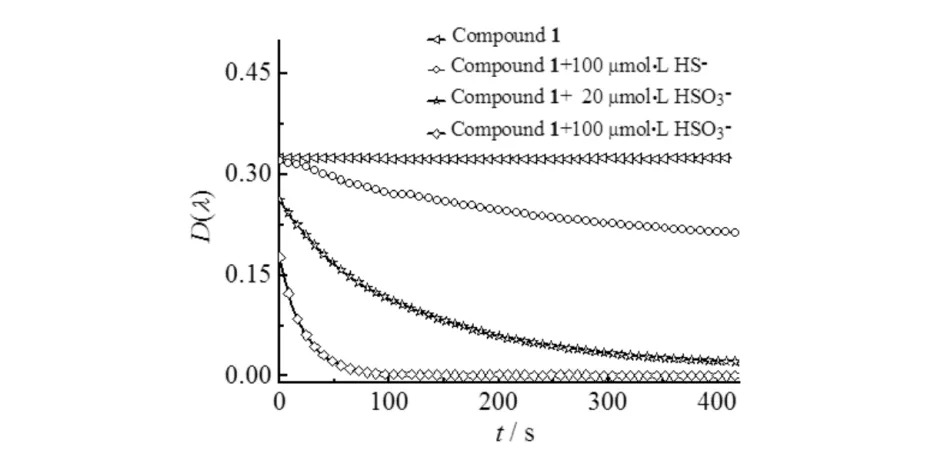
图6 化合物1在不同浓度的HSO3-和HS-溶液中紫外光谱随时间变化曲线Fig.6 Time-dependence of UV-Vis absorption changes of compound 1 in the presence of HSO3- and HS- with different concentrations
3 结语
合成了结构新颖,肉眼可识别HSO3-的化合物1,该化合物在CH3CN/HEPES [pH=7.0,V(CH3CN)∶V(HEPES)=1∶99] 中与HSO3-发生亲核加成反应,破坏其共轭结构,导致其吸收光谱发生显著蓝移,颜色由黄色变为无色,裸眼即可识别,具有很强的实用性.此外,化合物1对HSO3-具有响应时间快、检测限低(0.21 μmol·L-1)、操作简便且检测迅速的特点.尽管HS-的存在可能会对化合物1识别HSO3-造成一定干扰,但因其反应需要较高浓度和较长时间,化合物1仍然可在离子浓度较低的情况下,短时间内快速地选择性识别HSO3-.
参 考 文 献
[1] Xu J, Pan J, Jiang X, et al. A mitochondria-targeted ratiometricfluorescent probe for rapid, sensitive and specific detection of biological SO2derivatives in living cells[J]. Biosens Bioelectron, 2016, 77:725-732.
[2] Li D P, Wang Z Y, Cao X J, et al. A mitochondria-targeted fluorescent probe for ratiometricdetection of endogenous sulfur dioxide derivatives in cancer cells[J]. Chem Commun, 2016,52(13):2760-2763.
[3] Zhang Y, Guan L, Yu H, et al. Reversible fluorescent
probe for selective detection and cell imaging of oxidative stress indicatorbisulfite[J]. Anal Chem, 2016, 88(8): 4426-4431.
[4] Xu X, Ray R, Gu Y, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. J Am Chem Soc, 2004, 126(40): 12736-12737.
[5] Sun Y P, Zhou B, Lin Y, et al. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. J Am Chem Soc, 2006, 128(24): 7756-7757.
[6] 王 刚. 检测亚硫酸氢根和硫离子的荧光探针的合成及性质研究[D]. 西安:西北大学, 2012.
[7] Geng L, Yang X F, Zhong Y, et al. “Quinone-phenol” transduction activated excited-state intramolecular proton transfer: a new strategy toward ratiometric fluorescent probe for sulfite in living cells[J]. Dyes Pigments, 2015, 120: 213-219.
[8] Cardwell T J,Christophersen M J. Determination of sulfur dioxide and ascorbic acid in beverages using a dual channel flow injection electrochemical detection system[J]. Anal Chim Acta, 2000, 416(1): 105-110.
[9] Bramanti E, D′Ulivo L, Lomonte C, et al. Determination of hydrogen sulfide and volatile thiols in air samples by mercury probe derivatizationcoupled with liquid chromatography-atomic fluorescence spectrometry[J]. Anal Chim Acta, 2006, 579(1): 38-46.
[10] Ubuka T, Abe T, Kajikawa R, et al. Determination of hydrogen sulfide and acid-labile sulfur in animal tissues by gas chromatography and ion chromatography[J]. J Chromatogr B Biomed Appl, 2001, 757(1): 31-37.
[11] 程晓红, 钟志成, 叶婷婷. 反应型化学传感器在阴离子检测中的应用[J]. 有机化学, 2016, 36(12): 2822-2842.
[12] 陈虹蓉, 伍亚男, 陈仕焰, 等. 2-羟基萘甲醛苯甲酰腙衍生物对Al3+的裸眼识别和荧光传感[J]. 应用化学, 2016, 33(5): 599-605.
[13] 李襄宏, 苏显龙, 李巧云. 新型环金属钌配合物的合成和Cu2+、Hg2+重金属离子对其吸收光谱的影响[J]. 中南民族大学学报(自然科学版),2015,34(1):23-26.
[14] Sun Y Q, Liu J, Zhang J, et al. Fluorescent probe for biological gas SO2derivatives bisulfite and sulfite[J]. Chem Commun, 2013, 49(26): 2637-2639.
[15] Paul S,Goswami S, Mukhopadhyay C D. A remarkable ratiometric fluorescent chemodosimeter for very rapid detection of hydrogen sulfide in the vapour phase and living cells[J]. New J Chem, 2015, 39(11): 8940-8947.

