2-氨基噻二唑的合成及工艺优化
王 伟,王 莉,褚明杰
(安徽农业大学理学院,安徽合肥230036)
噻二唑衍生物是一种重要的有机中间体,最早应用于医药领域[1],先锋5号、甲氮酰胺等都含有其母核[2]。在农药方面,噻二唑可合成抗菌药[3]、杀虫药[4]、植物生长调节剂[5]等;噻二唑衍生物也可作为多齿配体,因为它们具有较强配位能力的S、N杂原子,能和很多金属离子形成配合物[6]。现如今,噻二唑的应用越来越广泛。因此,对噻二唑衍生物合成的研究具有重要意义。本研究以取代苯甲酸和氨基硫脲为原料,在三氯氧磷作氯化试剂条件下合成氨基噻二唑类衍生物,通过单因素优选法确定最佳反应条件以缩短反应时间,提高产率,为该类化合物的绿色合成提供了方法。
1 实验部分
1.1 主要仪器设备
圆底烧瓶(25mL)、冷凝管、分液漏斗(250mL)、烧杯(10mL、100mL)、移液管(10mL)、布氏漏斗、抽滤瓶(100mL)、橡胶管、玻璃棒。
AUY200电子天平(SHIMADZU Corporation Japan)、SHB-B95循环水式多用真空泵(郑州长城科工贸有限公司)、85-1恒温磁力搅拌器(金坛市杰瑞尔电器有限公司)、KQ-200TDV高频数控超声波清洗器(昆山市超声仪器有限公司)、RE-5203旋转蒸发仪(上海亚荣生化仪器厂)、GW320红外灯(海南嘉和电器厂)、BCD-450ZE9N美菱冰箱(合肥美菱股份有限公司)、BI RAD FTS-40红外光谱仪、Agilent DD2600Hz核磁共振仪。
1.2 主要化学药品
无水硫酸钠(AR,天津博迪化工股份有限公司)、无水乙醇(AR,国药集团化学试剂有限公司)、NaOH(AR,西陇化工股份有限公司)、NaCl(AR,盛庆和化工有限公司)、乙酸乙酯(AR,苏州海港化工)、POCl3(天津市光复精细化工研究所)、对硝基苯甲酸(98%,阿拉丁化学有限公司)、间氟苯甲酸(98%,阿拉丁化学有限公司)、对甲氧基苯甲酸(98%,济南汇丰达化工有限公司)、对溴苯甲酸(98.0%,常州康乐化工)、氨基硫脲(AR,阿拉丁化学有限公司)。
1.3 氨基噻二唑的合成方法
将不同取代基的苯甲酸(5mmol)和氨基硫脲(5mmol)溶于三氯氧磷中(10mL),搅拌,加热至 85℃回流,反应6h,倒入冰水中,用50%的氢氧化钠溶液调节溶液pH至8~9,用乙酸乙酯萃取,再用饱和氯化钠溶液洗涤3次,无水硫酸钠干燥,抽滤,浓缩,乙醇重结晶得到白色固体。
2 结果与分析
影响氨基噻二唑类衍生物产率的因素主要有三氯氧磷用量、反应温度、反应时间等,实验以R=4-NO2为例加以讨论。
2.1 三氯氧磷的量对产率的影响
准确称取对硝基苯甲酸(5mmol)和氨基硫脲(5mmol),通过改变三氯氧磷的用量,其他反应条件恒定,探究三氯氧磷用量和产率的关系,见表1。

表1 三氯氧磷的用量对产率的影响
由表1可以得出:随着三氯氧磷用量的增加,产率增加,如三氯氧磷的用量由8mL增加至10mL,产率由68%升至83%。增加到一定程度时产率下降,如三氯氧磷的用量由10mL增加至12mL,产率由83%降至72%,主要是因为三氯氧磷过多,体系粘度增加,搅拌不匀,整个反应体系温度下降所致,因此最佳三氯氧磷用量为10mL。
2.2 反应温度对产率的影响
通过改变反应温度,其他反应条件恒定,探究反应温度和产率的关系,如表2。
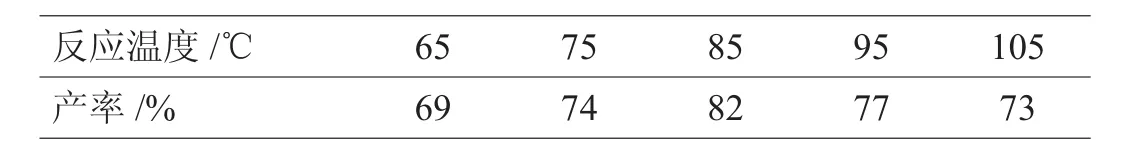
表2 反应温度对产率的影响
由表2可以得出:随着温度的升高,产率增加,如温度从65℃升至75℃,产率由69%升至74%。温度增加到一定程度产率降低,如温度从85℃升至105℃,产率由82%降至73%,因此最适反应温度为85℃,导致这一结果的主要原因是温度过低反应速度较慢,温度过高时副反应有可能增多。
2.3 反应时间对产率的影响
通过改变反应时间,其他反应条件恒定,探究反应时间和产率的关系,如表3。

表3 反应时间对产率的影响
由表3可以得出:反应时间过短时,反应物反应不充分,产率低,如反应时间为4h,产率为60%;反应时间太长,副反应增多,副产物的含量增多,也影响反应的产率,如反应时间延长至8h,产率却下降至69%,因此最佳反应时间为6h。
2.4 化合物的表征
2.4.1 化合物表征数据
采用KBr压片法测定目标化合物的IR;以CDCl3和DMSO为溶剂,TMS为内标,在600 MHz核磁共振仪进行1H NMR和13CNMR分析。
化合物 a1HNMR(600MHz,CDCl3)δ8.30(d,J=8.5Hz,2H),7.98 (d,J=8.5Hz,2H),5.27 (s,2H);IR(KBr,cm-1)1600(C=N)3200(苯环 =C-H)3350(-NH2)1680(=C-H)1540(-NO2).
化合物 b1HNMR(600MHz,CDCl3)δ7.73(d,J=8.8Hz,2H),6.94 (d,J=8.9Hz,2H),5.25 (s,2H);IR(KBr,cm-1)1600(C=N)3200(苯环 =C-H)3350(-NH2)1680(=C-H)1420(C-Br).
化合物 c1HNMR(600MHz,CDCl3)δ7.38(dd,J=11.99.3 Hz,2H),7.23(dt,J=13.8,7.0Hz,1H),6.94(dd,J=11.3,5.3Hz,1H),6.28(s,2H);IR(KBr,cm-1)1600(C=N)3200(苯环 =C-H)3350(-NH2)1680(=C-H)1300(C-F).
化合物d1HNMR(600MHz,CDCl3)δ7.73(d,J=8.4Hz,2H),6.94(d,J=8.5Hz,2H),5.25(s,2H),3.85(s,4H);IR(KBr,cm-1)1600(C=N)3200(苯环 =C-H)3350(-NH2)1680(=C-H)1200(-CH3O).
2.4.2 谱图分析
在化合物a的1HNMR谱图中,化学位移3.31和2.51分别为DMSO的水峰和残留的溶剂峰,该化合物有三种H,苯环位置靠近硝基的H由于受到硝基吸电子效应的影响,该H的质子振动信号移向低场,化学位移变大,所以8.30为靠近硝基H的吸收峰,7.98附近的双重峰为苯环上的另外两个H的吸收峰,氨基上的H由于存在共轭效应,该H的化学位移也变大,5.27为氨基H的吸收峰。
在化合物d的IR谱图中,波数在1600cm-1附近有个C=N的伸缩振动吸收峰;3200cm-1有一个苯环=C-H的伸缩振动吸收峰;3350cm-1为-NH2伸缩振动吸收峰,1680cm-1为=C-H的面内弯曲振动峰,在1200 cm-1有一强吸收峰,为C-CH3O的伸缩振动峰。
3 结论
本课题用三氯氧磷合环法[7],以一系列苯甲酸衍生物和氨基硫脲为原料,在三氯氧磷作用下合成一系列噻二唑类衍生物。通过IR及1H NMR等方法对合成的化合物进行结构表征,同时探究三氯氧磷的用量、反应温度、反应时间对收率的影响。利用单因素试验优选所得最佳合成路线为三氯氧磷10mL,反应温度85℃,反应时间6h,产率可达到80%以上。
[1]周艳芬,陈宏博.1,3,4-噻二唑及其衍生物的研究进展[J].化工中间体,2009(6):21-25.
[2]谢兵,吴富祥.1,3,4-噻二唑衍生物的合成和生物活性研究进展[J].广东化工 ,2009(7):87-89.
[3]张自义,陈新.稠杂环化合物研究——Ⅰ.3-(4′-吡啶基)-6-芳基-均-三唑并[3,4-b]-1,3,4-噻二唑的合成及其抗菌性能[J].化学学报,1991,49(5):99-106.
[4]李兴海,凌云,杨新玲.含噻二唑环苯甲酰脲化合物的合成及杀虫活性[J].化学通报,2003,66(5):333-336.
[5]车超,毛淑芬,覃兆海.2-氨基 -5-(2-氯吡啶 -4-基)-1,3,4-噻二唑衍生物的合成及生物活性 [J].应用化学,2002(8):795-797.
[6]吴腊梅,何为,李志有,等.含1,3,4-噻二唑希夫碱衍生物及其金属配合物的合成和荧光性能研究 [J].中南民族大学学报(自然科学版),2014(4):20-25.
[7]Mullick,Pooja,Khan,et al.Ozair:Synthesis,Characterization and Antimicrobial Activity of New Thiadiazole Derivatives[J].Bulletin of the Korean Chemical Society,2010,36(2):468-476.

