利拉鲁肽对动脉硬化大鼠模型的疗效评价
郭晶晶,李 娜,霍琴琴,钟 兴,潘天荣
长期高脂血症是动脉硬化发生发展的重要危险因素,脂质沉积破坏内膜的平滑性和完整性,促进血浆中自由基产生和炎症反应发生、平滑肌细胞增生及迁移,而血管内皮损伤是动脉硬化的始动因素,保护血管内皮细胞、减轻内皮损伤是防治动脉硬化的重要环节。目前动脉硬化的防治措施,一方面是饮食及生活方式干预;另一方面是药物治疗,包括扩张血管、调节血脂、抗血小板聚集、抗凝等。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是一种由肠道L细胞合成和分泌的内源性肠促胰岛素激素,呈葡萄糖依赖性的促进胰岛素的分泌,同时具有改善血管内皮功能,保护心血管系统的效应[1]。利拉鲁肽(Liraglutide)是一种GLP-1类似物,与天然GLP-1有97%的同源性,具有GLP-1的生理功能。该研究建立高脂饮食诱导的动脉硬化大鼠模型,通过比较血清学指标、血管病理及血管张力的变化,评价利拉鲁肽对动脉硬化大鼠模型的治疗效果。
1 材料与方法
1.1实验动物及干预药物清洁级雄性SD大鼠32只,约(170±10)g,购自安徽省实验动物中心。随机分为高脂组22只、对照组10只。
1.2实验药物、试剂及仪器利拉鲁肽(诺和力)购自丹麦诺和诺德公司(批号:FP51752-2);胰岛素ELISA试剂盒购自上海源叶生物科技有限公司;大鼠内皮素1(endothelin 1,ET-1)ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司;ADVIA2400全自动生化分析仪购自德国西门子公司;荧光正置显微镜(尼康80i)购自南京飞达光学仪器公司。
1.3实验方法
1.3.1动脉硬化大鼠模型的建立及干预 高脂组大鼠予高脂饲料喂养,高脂饲料配方为81.8%基础饲料+6%猪油+2%胆固醇+10%蛋黄粉+0.2%胆盐,购自江苏省协调生物工程有限责任公司,对照组给予普通饲料持续喂养,饮水均无限制。12周后从对照组和高脂组分别随机抽取两只老鼠处死,取主动脉血管,做病理切片染色观察,结果提示动脉硬化大鼠模型造模成功。将高脂组随机分为利拉鲁肽组9只,安慰剂组9只,继续予高脂饮食,且分别于皮下注射利拉鲁肽0.6 mg/(kg·d)和生理盐水0.6 mg/(kg·d)干预16周,正常对照组继续予普通饲料喂养,期间自由饮水,标准鼠笼饲养,每笼5只,温度20~25 ℃,动物室内明暗各12 h左右。
1.3.2标本采集及检测方法 称量大鼠体重,10%水合氯醛0.3 ml/100 g腹腔注射麻醉,充分暴露腹腔,腹主动脉取血,离心后取上清液负80 ℃保存待测,全自动生化分析仪检测血清三酰甘油(triglycerides,TG)、总胆固醇(cholesterol,CHO)、低密度脂蛋白(low-density lipoprotein,LDL)、空腹血糖(fasting blood glucose,FBG)含量;ELISA试剂盒检测空腹胰岛素 (fasting insulin,FINS)及ET-1水平;硝酸还原法测定血清一氧化氮(nitric oxide,NO)浓度。
1.3.3肝组织病理切片、HE染色及Masson染色 取0.5~1.0 cm腹主动脉按照固定、脱水、石蜡包埋、切片、染色、烘干、封片的顺序完成血管病理切片的制作,光镜下观察。
1.3.4血管张力测定 处死大鼠后迅速取出大鼠肠系膜上动脉,置于Kerbs液中,并持续通入混合气体(95% O2和5% CO2),在解剖显微镜下操作,小心去除血管周围的脂肪组织和结缔组织,沿血管纵轴剪成长约2 mm的血管环并固定,欲槽内预置5 ml的Kerbs液,持续通入95% O2和5% CO2的混合气体保持pH在7.4,温度维持在37 ℃。拉伸血管环,给予血管环2 mN的前负荷,利用Powerlab系统记录血管张力的变化。平衡30 min后,加入60 mmol/L的高钾溶液激活血管2次,待达到最大收缩效应时,吸出高钾溶液,用Kerbs液洗3次,每次5 min。然后加入3 μmol/L苯肾上腺素(Phe)预收缩血管,收缩达到稳定值后加入乙酰胆碱(Ach)10-8~10-5mol/L或硝普钠(SNP)10-9~10-5mol/L检测血管内皮依赖性或非依赖性舒张功能。

2 结果
2.1大鼠体重变化安慰剂组大鼠体重较对照组显著升高,差异有统计学意义(P<0.05);利拉鲁肽干预组大鼠体重较安慰剂组显著下降,差异有统计学意义(P<0.05),见表1。
2.2血清TG、CHO、LDL、FBG、FINS变化安慰剂组血清TG、CHO、LDL、FINS较对照组显著升高,差异有统计学意义(P<0.05);利拉鲁肽干预组,血清TG、CHO、LDL、 FINS较安慰剂组显著下降,差异有统计学意义(P<0.05),与对照组比较,差异无统计学意义;3组大鼠FBG差异无统计学意义(4.73±0.48vs5.05±0.47vs4.84±0.51);见表1。
2.3大鼠血管病理学改变光镜下可见正常对照组大鼠血管组织形态结构正常,内膜光滑平整,内皮细胞扁平;中膜弹性纤维及平滑肌细胞排列整齐,未见平滑肌迁移;外层为疏松结缔组织。安慰剂组血管内膜明显增厚,向腔面突起,内皮细胞排列紊乱,可见大量迁移的平滑肌细胞;中膜平滑肌细胞明显增生且排列紊乱,并向内膜迁移;外膜纤维结缔组织增生明显。利拉鲁肽干预组血管内膜向腔面呈指状突起,内皮细胞纤维化,内皮下层可见迁移的平滑肌细胞,病变程度较安慰剂组明显减轻。见图1、2。
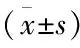
表1 大鼠体重及血清TG、CHO、LDL、FBG、FINS变化
与对照组比较:*P<0.05;**P<0.01;与安慰剂组比较:#P<0.05 ,##P<0.01
2.4血管张力检测与正常对照组相比,安慰剂组大鼠肠系膜上动脉的内皮依赖性舒张显著减弱;利拉鲁肽干预组大鼠肠系膜上动脉内皮依赖性舒张较安慰剂组有所提高,差异有统计学意义(F=5.820,P<0.05)。SNP引起的内皮非依赖性舒张各组间差异无统计学意义,见图3。
2.5血清NO、ET-1变化与对照组相比,安慰剂组NO水平显著降低,ET-1水平显著升高,差异均有统计学意义(P<0.05);利拉鲁肽干预组,NO水平较安慰剂组显著升高,ET-1水平较安慰剂组显著下降,差异均有统计学意义(P<0.05),见表2。
3 讨论
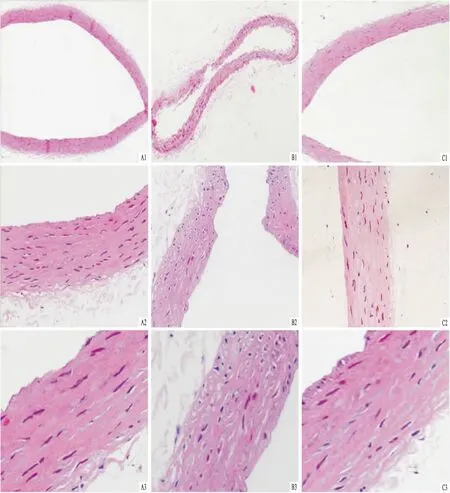
图1 HE染色观察各组大鼠腹主动脉病理学变化

图2 Masson染色观察各组大鼠腹主动脉病理变化

图3 利拉鲁肽在高脂饮食诱导的动脉硬化大鼠内皮功能障碍中的作用
A:各组小鼠腹主动脉内皮依赖性舒张变化原始图;B: 各组小鼠腹主动脉内皮依赖性舒张统计图;C: 各组小鼠腹主动脉内皮非依赖性舒张统计图;与对照组比较:*P<0.05;与安慰剂组比较:#P<0.05
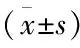
表2 血清NO、ET-1变化
与对照组比较:*P<0.05;与安慰剂组比较:#P<0.05
随着人口老龄化,心脑血管疾病已成为威胁人类健康的慢性疾病之一,而动脉硬化是心脑血管疾病发生发展的重要危险因素。长期高脂饮食可导致糖脂代谢紊乱、大量游离脂肪酸进入血液、内皮细胞功能紊乱及胰岛素抵抗,与动脉硬化的形成密切相关[2]。在内皮细胞结构紊乱和功能障碍的基础上,血管平滑肌细胞增生和移行逐步演变成动脉硬化改变。因此,保护血管内皮功能是延缓动脉硬化进展的重要一步。
荟萃分析表明,利拉鲁肽可减轻肥胖糖尿病患者的体重,且改善体质量指数及腰围。一项回顾性研究[3]显示,针对肥胖的2型糖尿病患者予利拉鲁肽治疗后患者平均体重由(120±5)kg降至(115±3)kg。本研究显示,与安慰剂组相比,利拉鲁肽干预组大鼠体重显著下降,亦提示利拉鲁肽具有减轻体重的作用。LEAD研究结果表明,利拉鲁肽干预后,血清TG、CHO、LDL均显著下降。本研究显示,高脂饮食大鼠予利拉鲁肽干预后,血清TG、CHO、LDL较安慰剂组显著下降,提示利拉鲁肽具有降低血脂、改善脂代谢紊乱的作用。
临床研究显示,糖尿病患者颈动脉厚度明显增加,伴有内膜下泡沫细胞数量增加,有早期粥样斑块形成,且与胰岛素抵抗密切相关。研究[4]表明,高胰岛素血症能诱导内皮细胞功能障碍。胰岛素是一种很强的促细胞生长因子,可增加血管内皮细胞炎症因子的表达,增强血管平滑肌细胞的分裂和增殖,促进内皮细胞炎症反应发生及动脉硬化的进展。本研究显示,高脂组大鼠血清胰岛素水平显著升高,利拉鲁肽干预组血清胰岛素水平显著降低,提示利拉鲁肽能降低血清胰岛素水平,改善胰岛素抵抗,同时利拉鲁肽的减重作用亦有助于改善胰岛素抵抗。
Goto et al[5]体外研究显示,内皮损伤的小鼠被连续注射唾液素4后,发现新生血管内膜的生成受到抑制,血管平滑肌细胞的增殖显著降低,内膜增厚减轻。本研究显示,安慰剂组动脉硬化模型大鼠血管内皮细胞结构紊乱,平滑肌细胞大量增生并迁移,伴有大量胶原纤维增生;与Goto et al[5]研究结果相似,利拉鲁肽干预组内皮排列较安慰剂组规整,平滑肌细胞增生及迁移程度较轻,胶原纤维增生不明显,提示利拉鲁肽可抑制平滑肌细胞增生和迁移,具有保护血管内皮细胞、改善动脉硬化的作用。
在生理性刺激或药物如乙酰胆碱的作用下,内皮细胞释放NO等舒张因子引起内皮依赖性舒张;在硝酸甘油、硝普钠等作用下直接释放NO引起不依赖于内皮的血管舒张。内皮功能紊乱最突出的表现是 NO 的合成减少,长期的高脂血症、高胰岛素血症可导致内皮功能不全,同时NO活性降低,加速血管病变,导致内皮功能紊乱。国内外临床研究[6-7]显示,血管内皮损伤与ET-l、NO 等血管活性物质的调节作用密切相关。利拉鲁肽可能对血管具有舒张作用,在加入一氧化氮抑制剂后,舒张幅度被抑制了75%,表明利拉鲁肽可能通过刺激内皮细胞释放NO而产生舒张血管的作用[8]。本研究亦显示,与安慰剂组相比,利拉鲁肽干预组血清NO含量明显升高,提示利拉鲁肽可能通过增加NO水平保护内皮功能。NO是作用最强的血管舒张因子,与之相反,ET-1是收缩血管能力最强的血管收缩因子,在调节血管张力方面具有重要作用。Khamaisi et al[9]研究发现,胰岛素能增加内皮素转化酶1的表达,使 ET-1的生成增加,而ET-1是引起血管收缩、代谢紊乱和细胞增殖等导致血管损伤发生的共同致病因素。本研究显示,高脂组血清NO合成减少而ET-1增多,利拉鲁肽干预后呈相反趋势,提示利拉鲁肽对内皮细胞功能具有保护作用。本研究进一步评价动脉硬化模型大鼠肠系膜上动脉内皮舒张功能,结果提示高脂组大鼠血管内皮依赖性舒张功能显著减弱,提示脂代谢紊乱可引起内皮依赖性舒张功能障碍,利拉鲁肽干预组内皮舒张功能较安慰剂组显著改善,该结果与Basu et al[10]研究结果相似,均发现GLP-1对内皮依赖性血管的舒张功能具有保护作用,可增加乙酰胆碱介导的血管舒张。
综上所述,利拉鲁肽不仅能够安全有效的降糖和减重,而且可以调节脂代谢,具有保护血管内皮细胞及内皮依赖性舒张功能的作用,提示利拉鲁肽可能参与心脑血管的保护作用,但仍需进一步的实验和临床研究,以佐证其潜在的价值。
[1] Gaspari T,Welungoda I,Widdop R E,et al.The GLP-1 receptor agonist liraglutide inhibits progression of vascular diseaseviaeffects on atherogenesis, plaque stability and endothelial function in an ApoE(-/-) mouse model[J].DiabVasc Dis Res,2013,10(4):353-60.
[2] Nahrendorf M,Swirski F K.Lifestyle effects on hematopoiesis and atherosclerosis[J]. Circ Res, 2015,116(5):884-94.
[3] Varanasi A,Patel P,Makdissi A,et al.Clinical use of liraglutide in type 2 diabetes and its effects on cardiovascular risk factors[J].Endocr Pract,2012,18(2):140-5.
[4] Del Turco S,Gaggini M,Daniele G,et al.Insulin resistance and endothelial dysfunction: a mutual relationship in cardiometabolic risk[J].Curr Pharm Des,2013,19(13):2420-31.
[5] Goto H,Nomiyama T,Mita T,et al.Exendin-4,a glucagon-like peptide-1 receptor agonist, reduces intimal thickening after vascular injury[J].Biochem Biophys Res Commun,2011,405(1):79-84.
[6] Wadden T A,Hollander P,Klein S,et al.Weight maintenance and additional weight loss with liraglutide after low-calorie-diet-induced weight loss: The SCALE Maintenance randomized study[J].Int JObes,2015,39(1):187.
[7] The potential risks of pancreatitis and pancreatic cancer with GLP-1-based therapies are far outweighed by the proven and potential (cardiovascular) benefits[J].Diabet Med,2013,30(10):1148-55.
[8] 李 宁,王 雄.利拉鲁肽对离体大鼠胸主动脉环的血管舒张效应及其机制研究[J].中国循环杂志,2015,30(1):50-3.
[9] Khamaisi M,Skarzinski G,Mekler J,et al.Hyperinsulinemia increases placenta endothelin-converting enzyme-1 expression in trophoblasts[J].Am J Hypertens,2012,25(1):109-14.
[10] Basu A,Charkoudian N,Schrage W,et al.Beneficial effects of GLP-1 on endothelial function in humans: dampening by glyburide but not by glimepiride[J]. Am J Physiol Endocrinol Metab,2007,293(5): E1289-E1295.

