miR-17-5p在动脉粥样硬化小鼠中的作用机制研究
谭力力,刘丽敏
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症性疾病,是缺血性心脑血管疾病的病理基础[1]。在世界范围内,心脑血管疾病是死亡率最高的疾病,因此,在AS发病早期的诊断和治疗对于防治心脑血管疾病显得尤为重要。近几年来,micro RNA在疾病中的作用受到了广泛的关注。一些microRNA分子已经被证实其在血浆中的表达量与疾病发生具有较为明确的相关性[2],甚至直接调控一些主要的通路影响疾病的发生发展,具有作为生物学标志的应用价值[3-4]。有研究[5]曾表明,miR-17-5p的表达水平与冠状动脉粥样硬化的严重程度具有相关性,但是miR-17-5p对AS的具体影响和机制尚不十分清楚,因此,该研究探讨miR-17-5p在动脉粥样硬化中对炎症反应和氧化应激的影响,并初步评估miR-17-5p在AS的诊断和治疗中的应用价值。
1 材料与方法
1.1主要试剂和材料
1.1.1实验动物 C57BL/6和ApoE-/-小鼠(雄性,6周,18~22 g)购自Vital River实验中心(中国北京),根据中国医科大学附属第一医院动物保护和使用委员会的标准在无病原体条件下饲养。
1.1.2主要试剂 髓过氧化物酶(myeloperoxidase, MPO)测定试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)WET法测定试剂盒、丙二醛(malondialdehyde, MDA)测定试剂盒(南京建成);小鼠肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)ELISA试剂盒、小鼠白介素-10(interleukin-10, IL-10)ELISA试剂盒、小鼠白介素-6(interleukin-6, IL-6)ELISA试剂盒(Boster);苏木精(Solarbio);署红Y,醇溶(国药);B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)抗体、活化半胱天冬酶3(cleaved-caspase-3)抗体、活化多聚ADP核糖聚合酶[cleaved poly(ADP-ribose)polymerase, cleaved-PARP]抗体(万类生物)。
1.2方法
1.2.1动物实验处理 经中国医科大学第一附属医院动物伦理委员会批准,所有实验动物共分为四组:① 对照组(NC):正常喂养的C57BL/6小鼠到第12周;② 动脉粥样硬化模型组(AS):用高脂胆固醇饮食(1.25 %胆固醇和21 %脂肪)喂养ApoE-/-小鼠到第12周);③ NC-miRNA组(NC-miRNA):同上构建AS小鼠模型后尾静脉注射miRNA抑制剂阴性对照;④ miR-17-5p抑制剂组(antagomiR-17-5p):构建AS小鼠模型后尾静脉注射miR-17-5p抑制剂。3周后处理小鼠分离胸主动脉,部分用多聚甲醛固定,部分冻存用于分子生物学检测。
1.2.2HE染色 胸主动脉固定后,常规脱水、透蜡和包埋。将蜡块标本切成5 μm左右的薄片,温水中铺展,60 ℃烘干,脱蜡至水。切片置于苏木精中染色5 min,1 %盐酸酒精分化,自来水冲洗,再将切片置于伊红染液中浸泡3 min,梯度乙醇脱水,二甲苯透明。擦干切片后封片于400×显微镜下观察拍照。
1.2.3TUNEL染色 制作胸主动脉的石蜡切片,脱蜡至水。用0.1 % Triton X-100透化,滴加3 % H2O2封闭,加入新配制的TUNEL反应液50 μl,37 ℃避光孵育60 min,漂洗后滴加Converter-POD 50 μl,37 ℃孵育30 min,加DAB底物,待颜色刚变深时终止反应。用苏木精复染,1 %盐酸酒精分化,流水反蓝,梯度乙醇脱水,二甲苯透明。中性树胶封片,400×镜下拍照。
1.2.4Western blot 将胸主动脉血管置于裂解液中裂解提取总蛋白,BCA法测定蛋白浓度。通过SDS-PAGE分离总蛋白,电泳之后转至PVDF膜。5%脱脂奶粉封闭1 h,4 ℃一抗孵育过夜,二抗37 ℃孵育45 min。二抗孵育完成后,ECL法曝光,最终得到的胶片用凝胶图像处理系统分析目标条带的光密度值。
1.2.5ELISA 收集动脉血管组织样本,组织匀浆、提取蛋白,BCA法测定蛋白浓度。采用商品化的小鼠TNF-α、IL-10和IL-6 ELISA检测试剂盒,按照说明书进行实验,最后用酶标仪于450 nm处检测各孔的光密度(OD)值。利用标准品绘制标准曲线,计算回归方程,由标准曲线得到待测样本各指标的含量。
1.2.6MDA含量测定 收集动脉血管组织样本,组织匀浆、提取蛋白,BCA法测定蛋白浓度。采用MDA测定试剂盒,按照试剂盒说明书操作,分光光度计测定532 nm处各管的吸光值。根据下列公式进行计算:组织中MDA含量(nmol/mg prot)=[(测定OD-空白管OD)-(标准OD-空白OD)]×标准品浓度÷蛋白浓度。
1.2.7SOD活性检测 收集动脉血管组织样本,组织匀浆、提取蛋白,BCA法测定蛋白浓度。采用SODWET法测定试剂盒,按照试剂盒说明书操作,酶标仪测定450 nm处的吸光值。根据下列公式进行计算:SOD抑制率(%)=[(A对照-A对照空白)-(A测定-A测定空白)]/(A对照-A对照空白)×100%。
组织中SOD活力定义:在反应体系中SOD抑制率达到50 %时所对应的酶量为一个SOD活力单位(U)。组织中SOD活力(U/mgprot)=SOD抑制率/ (50 %×蛋白浓度)×稀释倍数。


2 结果
2.1胸主动脉病理变化HE染色观察各组小鼠动脉血管内皮形态,结果如图1所示,对照组(图1A)内皮细胞排列整齐,形态完整;AS组(图1B)与NC-miRNA组(图1C)小鼠血管内皮细胞排列紊乱,内膜增生,可见明显的斑块形成;miR-17-5p抑制剂组(图1D)的小鼠病变程度有所减轻。
2.2胸主动脉细胞凋亡情况TUNEL染色观察各组小鼠动脉血管内皮细胞凋亡情况,结果如图2所示,对照组(图2A)细胞排列整齐,凋亡细胞少,而AS组(图2B)与NC miRNA组(图2C)凋亡细胞增多,细胞排列紊乱,核固缩,棕黄色颗粒增加;miR-17-5p抑制剂组(图2D)的小鼠凋亡细胞明显减少,内皮细胞排列整齐。
2.3动脉血管组织中凋亡因子的表达本研究利用Western blot检测了动脉粥样硬化过程中凋亡相关蛋白Bcl-2、Bax、cleaved-caspase-3、cleaved-PARP表达的变化,结果如图3所示,AS组、NC-miRNA组Bax、cleaved-caspase-3、cleaved-PARP表达量升高(P<0.01),而Bcl-2表达量下降(P<0.01)。而antagomiR-17-5p与NC-miRNA组相比,Bax、cleaved caspase-3和cleaved-PARP的表达量下降(P<0.01),Bcl-2的表达量上升(P<0.01)。

图1 动脉血管组织病理变化 HE×400
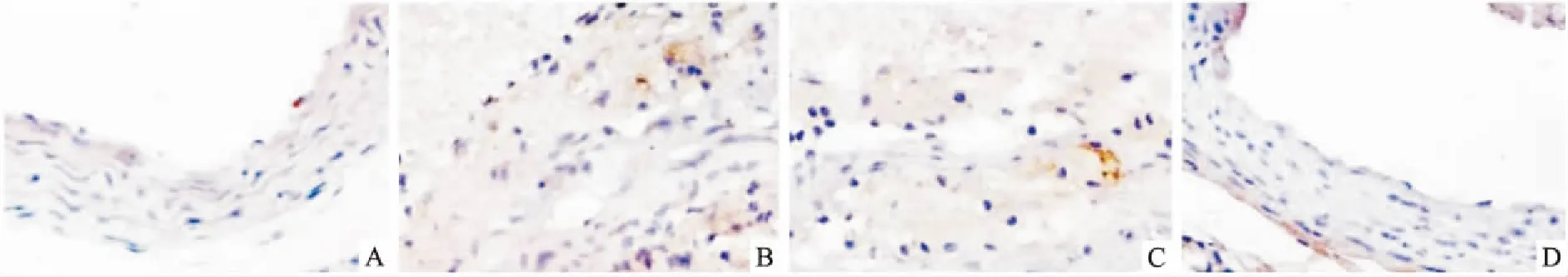
图2 动脉血管组织细胞凋亡情况 TUNEL染色×400

图3 Western blot检测BCL-2、Bax、Cleaved-caspase-3以及cleaved-PARP表达水平
2.4血管炎症因子表达变化通过ELISA检测各组小鼠动脉血管样本中炎症因子TNF-α、IL-6和IL-10水平,结果如图4所示,与对照组相比,AS组的TNF-α(352.30±90.00) ng/g prot、IL-6(131.34±31.99) ng/g prot水平显著升高(P<0.01),而IL-10(24.63±7.46) ng/g prot的水平下降(P<0.01),NC组与AS组趋势相同。antagomiR-17-5p处理组TNF-α(184.87±54.60) ng/g prot和IL-6(75.81±19.52) ng/g prot水平显著低于NC-miRNA组(P<0.01),而IL-10(56.43±18.54) ng/g prot的水平高于NC-miRNA组(P<0.01)。TNF-α、IL-6、IL-10组间比较的F值分别为34.111、31.249、71.514。

图4 ELISA法检测TNF-α、IL-6、IL-10在动脉血管组织中的水平
与NC组比较:**P<0.01;与NC-miRNA组比较:##P<0.01
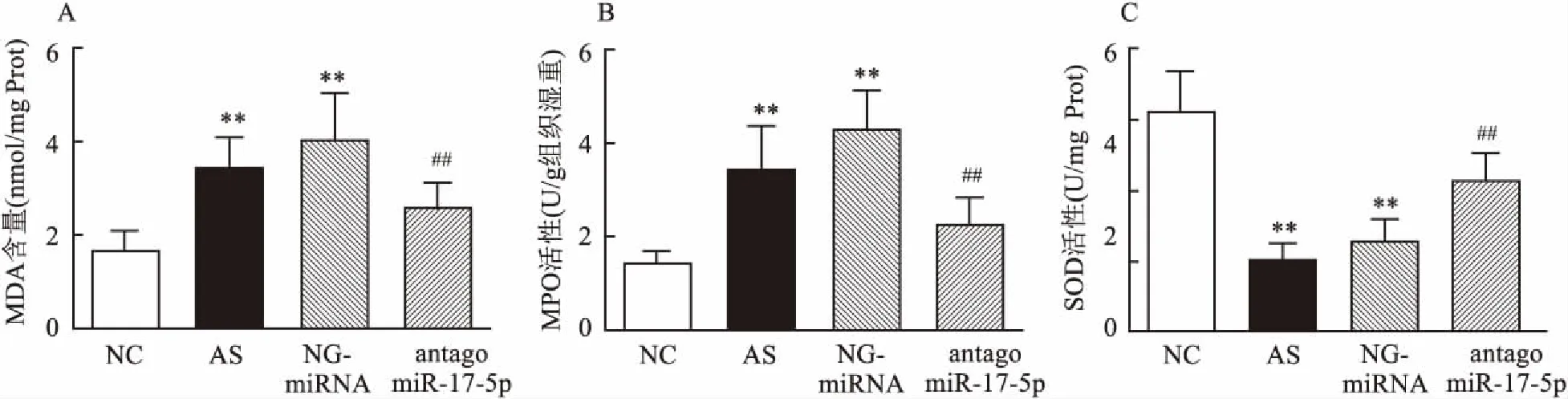
图5 各组小鼠动脉血管组织中MDA含量和MPO、SOD活性测定
2.5miR-17-5p对动脉粥样硬化过程中氧化应激的影响本研究分别检测了动脉血管组织中MDA的含量以及SOD、MPO的活性变化,结果如图5所示,AS组小鼠动脉血管组织中MDA含量(3.39±0.70) nmol/mg prot以及MPO的活性(3.461±0.927) U/g组织湿重升高(P<0.01),SOD活性(10.19±2.34) U/mg prot降低(P<0.01)。antagomiR-17-5p处理降低了AS小鼠动脉血管组织中的MDA含量(2.55±0.54) nmol/mg prot与MPO活性(2.235±0.625) U/g组织湿重(P<0.01),提高了SOD活性(21.52±3.76) U/mg prot(P<0.01)。MDA、MPO、SOD组间比较的F值分别为13.336、20.009、34.495。
3 讨论
AS是一种慢性炎性疾病,炎症反应贯穿了AS的整个发展过程。与典型的自限性急性炎症不同,AS不具有自限性,缺乏从促炎到抗炎的转换。由于白细胞在AS过程中的持续积累[6],巨噬细胞M1/M2极化不平衡[7],受损细胞清除功能下降等[8]原因,炎症细胞和炎症因子持续存在,进而导致慢性组织损伤。AS发展过程中,巨噬细胞的功能十分关键,M1型巨噬细胞与斑块的不稳定性相关,促进AS发展,而M2型巨噬细胞是抗炎症表型,促进炎症消退。研究[9]表明,IL-10、IL-13等细胞因子促进巨噬细胞M1型向M2型转化。Th1细胞能够分泌INF-γ、TNF-α等细胞因子介导巨噬细胞活化[10],同时TNF-α还能够通过活化NF-κB通路进一步刺激炎性细胞因子分泌,促进炎症发展[11]。
机体在代谢过程中会产生活性氧(reactive oxygen, ROS),包括氧自由基、过氧化氢等。正常情况下体内存在抗氧化系统可以清除过量的ROS,一旦抗氧化系统与ROS之间平衡被破坏,过量的ROS会对机体造成一定的氧化损伤。ROS能够引起内皮细胞损伤和凋亡,影响内皮细胞功能[12],同时,内皮下间隙中的LDL可以被氧化修饰形成oxLDL,oxLDL被巨噬细胞吞噬,最后形成泡沫细胞。oxLDL还可以结合细胞表面受体LOX-1[13],促进NF-κB通路活化和炎症发展[14]。
有研究[15]曾报道了miR-17-5p的表达影响内皮细胞的氧化应激水平,因此,本研究探讨了miR-17-5p在AS发展中对炎症因子表达和氧化应激的影响。对AS模型大鼠尾静脉注射miR-17-5p拮抗剂,胸主动脉血管的HE染色结果显示抑制miR-17-5p可以明显改善内皮细胞损伤,表明miR-17-5p与AS发展具有相关性,抑制miR-17-5p可以缓解AS。TUNEL染色的结果显示抑制miR-17-5p减少了主动脉细胞凋亡,凋亡相关蛋白的Western blot检测也支持了这一结果,抑制miR-17-5p后,与促凋亡相关的蛋白Bax、cleaved-caspase-3、cleaved-PARP表达量下降,抗凋亡相关蛋白Bcl-2的表达量上升。抑制miR-17-5p的作用后,AS小鼠动脉血管组织中炎症相关因子TNF-α、IL-6水平降低,IL-10水平升高,同时MDA含量及MPO活性受到抑制,SOD活性上调,说明抑制miR-17-5p减轻了AS小鼠动脉血管组织中的炎症反应和氧化应激水平,通过下调促炎因子表达,上调抗炎因子表达,可能进一步影响巨噬细胞极化、血小板聚集等过程,减轻组织炎症水平;另一方面,上调SOD活性可以清除过量的ROS,减少脂质氧化和泡沫细胞形成等,最终缓解AS的病程。本研究的结果显示出miR-17-5p作为靶点在治疗AS中的应用潜力。
[1] Sata M, Fukuda D. Chronic inflammation and atherosclerosis : A critical role for renin angiotensin system that is activated by lifestyle-related diseases[J]. Inflamm Regen, 2011,31(3):245-55.
[2] Wang Q, Ma J, Jiang Z, et al. Diagnostic value of circulating microRNA-27a/b in patients with acute pulmonary embolism[J]. Int Angiol, 2018,37(1):19-25.
[3] Olson E N. MicroRNAs as therapeutic targets and biomarkers of cardiovascular disease[J]. Sci Transl Med, 2014, 6(239): 239ps3.
[4] Dong J, Bao J, Feng R, et al. Circulating microRNAs: a novel potential biomarker for diagnosing acute aortic dissection[J]. Sci Rep, 2017, 7(1): 12784.
[5] Chen J, Xu L, Hu Q, et al. MiR-17-5p as circulating biomarkers for the severity of coronary atherosclerosis in coronary artery disease[J]. Int J Cardiol, 2015, 197: 123-4.
[6] Parks B W, Lusis A J. Macrophage accumulation in atherosclerosis[J]. N Engl J Med, 2013, 369(24): 2352.
[7] Buttari B, Profumo E, Segoni L, et al. Resveratrol counteracts inflammation in human M1 and M2 macrophages upon challenge with 7-Oxo-cholesterol: potential therapeutic implications in atherosclerosis[J]. Oxid Med Cell Longev, 2014, 2014(5): 257543.
[8] 汪海飞, 陈 开, 郑江华. 凋亡细胞清除机制在动脉粥样硬化中的研究进展[J]. 中国普外基础与临床杂志, 2012, 19(2): 224-7.
[9] 唐晓晏, 申子刚, 张志仁. 炎症消退障碍与动脉粥样硬化不稳定斑块形成[J]. 免疫学杂志, 2017, 33(4): 364-8.
[10] 刘俊田. 动脉粥样硬化发病的炎症机制的研究进展[J]. 西安交通大学学报(医学版), 2015,36(2): 141-52.
[11] Zhang Y, Yang X, Bian F, et al. TNF-α promotes early atherosclerosis by increasing transcytosis of LDL across endothelial cells: crosstalk between NF-κB and PPAR-γ[J]. J Mol Cell Cardiol, 2014,72:85-94.
[12] Perrotta I, Aquila S. The role of oxidative stress and autophagy in atherosclerosis[J]. Oxid Med Cell Longev, 2015,2015:130315.
[13] Lubrano V, Balzan S. LOX-1 and ROS, inseparable factors in the process of endothelial damage[J]. Free Radic Res, 2014, 48(8): 841.
[14] Li S, Guo Y, Zhu P, et al. Role of Ox-LDL/LOX-1/NF-κB signaling pathway in regulation of atherosclerotic plaque growth by testosterone in male rabbits[J]. Vascul Pharmacol, 2013, 59(5-6): 131-7.
[15] 杨 硕, 陈 静, 胡 琦, 等. miR-17表达对内皮细胞氧化应激作用的影响[J].疑难病杂志, 2015, 14(11): 1173-5.

