载气吹扫尼古丁长期吸入对大鼠心血管功能、氧化应激和炎症水平影响
程 攀,何 庆,张晓宇,张永学,张文欣,汪志伟,赵庆中,高 杉
尼古丁(nicotine)是一种无色的液态生物碱,最早从烟草中提取发现,故又名烟碱。烟碱性剧毒,小剂量可兴奋呼吸中枢,升高血压,而大剂量摄入将引起中枢神经系统的麻痹。研究[1]显示尼古丁在循环系统、呼吸系统、中枢神经系统、内分泌系统等中存在负性效应,其中对心血管功能的影响极为重要,通过损伤血管内皮,影响血脂代谢,诱发动脉粥样硬化的形成。同时尼古丁诱导细胞膜的损伤,干扰GSH代谢循环,影响氧化-抗氧化平衡[2]。目前,在尼古丁染毒动物模型的建立、尼古丁生物学效应实验室研究中,多采用皮下注射方法;在研究烟草危害的相关实验中,多采用香烟燃烧、电子烟烟雾暴露法。但皮下注射法对于模拟吸烟环境的真实性很差,直接燃烧香烟法对于环境存在污染,而使用电子烟暴露法除环境污染外,成本也太高。为此,该实验建立了载气吹扫尼古丁吸入暴露法观察和研究尼古丁吸入暴露对大鼠心血管功能、氧化应激状态和炎症水平的影响。
1 材料与方法
1.1药物及仪器尼古丁;一氧化氮(nitric oxide, NO)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒、PE聚乙烯塑料管、静脉穿刺套管针、气相色谱仪、BL-420S生物机能实验系统
1.2载气吹扫尼古丁吸入暴露法建立该实验结合气象色谱-串联质谱法(GC-MS)定性、定量分析技术,建立了载气吹扫尼古丁吸入暴露法,该方法采用空气气流、氧浓度稳定,尼古丁浓度恒定可控。本研究根据GC-MS结果,确定尼古丁吸入浓度为5.083 μg/ml,拟在该浓度下进行大鼠吸入暴露实验。
1.3动物模型制备及分组40只雄性SD大鼠,体重(180±10)g。随机均分为对照组、尼古丁低剂量组、尼古丁中剂量组和尼古丁高剂量组,每组10只。其中每天固定时间,低、中、高剂量尼古丁组分别暴露处理1、2、4 h,连续90 d。除烟雾暴露外,各组动物其他饲养条件相同。
1.4测量指标
1.4.1尾动脉无创测压 打开仪器预热、定标后,固定大鼠,将加压套固定至大鼠近尾根部。使鼠尾穿过脉搏传感器,插入尾部加热器中的加热管内,保持鼠尾正好处于脉搏传感器的“脉搏信号传感片”上方。调节鼠尾压迫片至传感片紧贴鼠尾下方的尾动脉,待大鼠脉搏稳定,开始测量血压。
1.4.2颈动脉插管 麻醉后,手术暴露右颈总动脉5~8 mm,游离的动脉两端用动脉夹固定。将套管穿刺针沿动脉走行刺入,拔出穿刺针,将动脉近心端动脉夹取下,仅留套管于动脉。手持针柄将套管小心送入心脏方向,至显示压力波形为左心室压力为止。
1.4.3体外血管环 设定水浴锅温度为37 ℃,调至“液温”档。打开BL-420S生物机能实验系统,定标、定张力、定零值。处死大鼠后,迅速取出胸主动脉,置于持续通有95% O2+5% CO2混合气体的Krebs液中。于解剖显微镜下,用眼科剪剔除多余的结缔组织和脂肪组织,冲净血管内余血,剪成4~5 mm的血管环后,小心穿至张力传感器的三角环上。倒入10 ml Krebs液于浴槽并持续通混合氧,给予静息张力0.5 g,孵育1 h,每15 min换液1次。放液,加入10 ml高K+溶液进行血管预收缩刺激,13 min待稳定后Krebs液洗掉高钾溶液,每10 min换一次液。加入10 ml Krebs液接着加10 μl PE(10 mmol/L),计时13 min。稳定后,由低到高依次加入浓度为0.01、0.1、1、10 mmol/L的Ach溶液,观察浓度梯度下血管内皮依赖的舒张活性。
1.4.4血清NO、MDA、GSH-Px的含量和SOD活性含量测定 麻醉后,行颈总动脉取血,于4 ℃下离心15 min(1 500 r/min)分离血清,然后按试剂盒说明测定血清中NO含量、MDA、GSH-Px的含量和SOD活性检测。
1.4.5ELISA检测 严格按试剂盒,用ELISA检测血清、心肌组织和肺组织中白介素1β(interleukin-1β, IL-1β)、白介素10(interleukin-10, IL-10)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、内皮型一氧化氮合酶(endothelial NO synthase, eNOS)水平。

2 结果
2.1长期吸入尼古丁对SD大鼠心重指数、肺重指数和肾重指数的影响SD大鼠长期吸入尼古丁后,与对照组比较,尼古丁低、中、高剂量组体重和心重有降低趋势,其中尼古丁中剂量组体重和心重降低明显,差异具有统计学意义(P<0.01)。尼古丁低剂量组心重指数(HW/BW)及尼古丁高剂量组肺重指数(LW/BW)和肾重指数(KW/BW)降低明显。见表1。
2.2长期吸入尼古丁对SD大鼠尾动脉压的影响与对照组比较,尼古丁低、中、高剂量组动脉血压都有明显的不同程度的上升趋势,差异有统计学意义(P<0.01)。见图1。
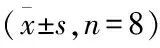
表1 长期吸入尼古丁对SD大鼠心重指数、肺重指数和肾重指数的影响
与对照组比较:**P<0.01
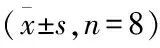
表2 长期吸入尼古丁对SD大鼠心功能的影响
HR:心率;LVSP:左心室收缩压;LVEDP:左心室终末舒张压;+dp/dtmax:左心室内压最大上升速率;-dp/dtmax:左心室内压最大下降速率;ABP:颈动脉压;与对照组比较:*P<0.05,**P<0.01
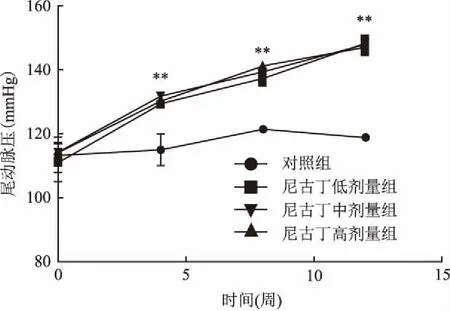
图1 长期吸入尼古丁对SD大鼠尾动脉压的影响
2.3长期吸入尼古丁对SD大鼠心功能的影响SD大鼠长期吸入尼古丁后,与对照组比较,尼古丁高剂量组左心室收缩压与舒张压明显升高,差异有统计学意义(P<0.05);与对照组比较,尼古丁低、中、高剂量组动脉血压发生不同程度的增高,差异有统计学意义(P<0.01)。见表2。
2.4长期吸入尼古丁对SD大鼠血管舒张功能的影响与对照组比较,尼古丁高剂量组对乙酰胆碱诱导的内皮依赖性舒张反应有明显的下降趋势,差异具有统计学意义(P<0.05)。见图2。
2.5长期吸入尼古丁对SD大鼠血清NO含量及心、肺、血清eNOS表达的影响与对照组比较,尼古丁低、中、高剂量组血清NO有不同程度的下降,差异具有统计学意义(P<0.05,P<0.01)。见图3。心、肺、血清eNOS含量均有明显的降低,差异具有统计学意义(P<0.01)。见图4。

图2 长期吸入尼古丁对SD大鼠血管舒张功能的影响

图3 长期吸入尼古丁对SD大鼠血清NO含量的影响
1:对照组;2:尼古丁低剂量组;3:尼古丁中剂量组;4:尼古丁高剂量组;与对照组比较:*P<0.05,**P<0.01
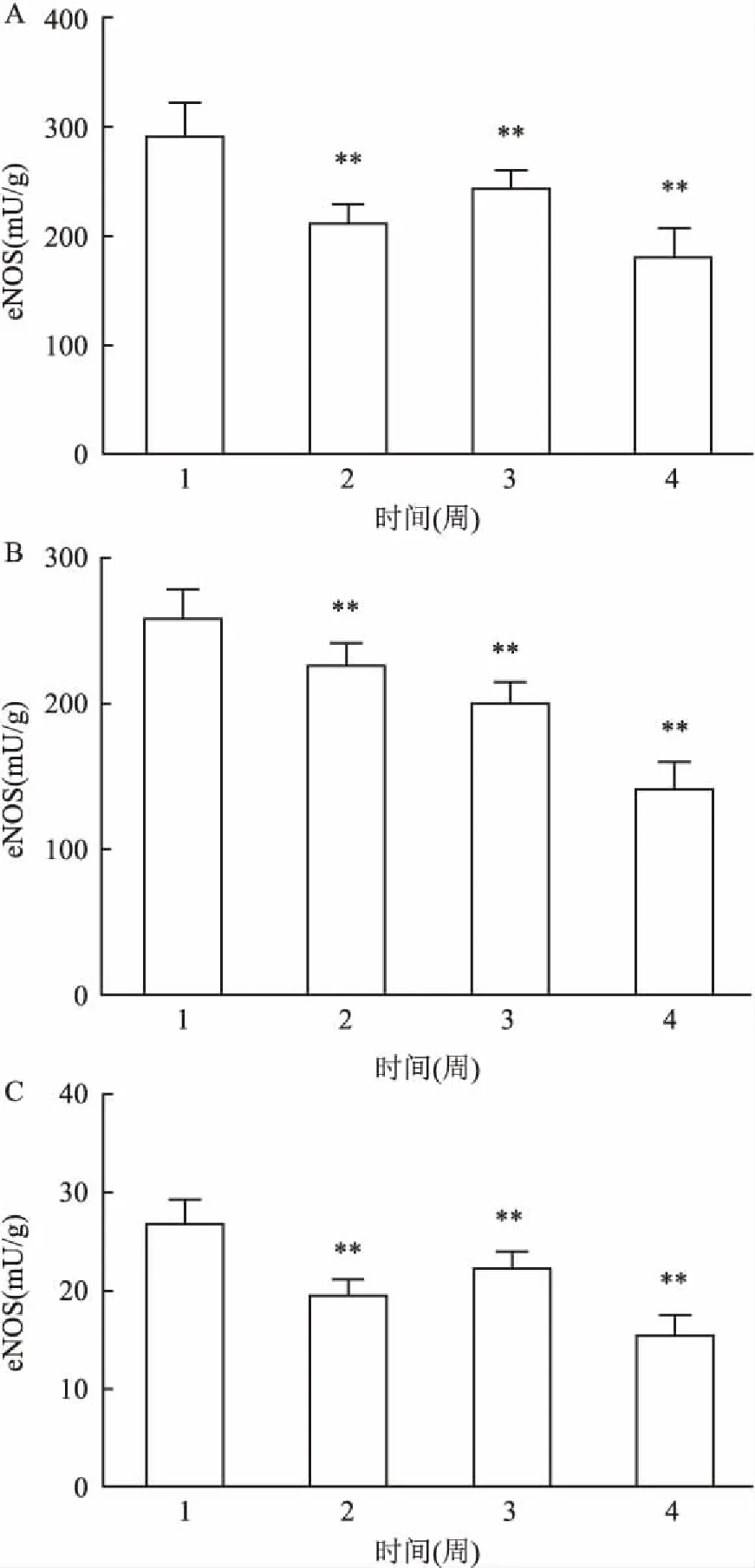
图4 长期吸入尼古丁对SD大鼠心、肺、血清eNOS表达的影响
A:心肌组织中eNOS蛋白表达;B:肺组织中eNOS蛋白表达;C:血清中eNOS蛋白表达;1:对照组;2:尼古丁低剂量组;3:尼古丁中剂量组;4:尼古丁高剂量组;与对照组比较:**P<0.01
2.6长期吸入尼古丁对SD大鼠血清MDA、GSH-Px含量及SOD活性的影响与对照组比较,尼古丁低、中、高剂量组血清MDA含量明显降低,GSH-Px含量明显升高,SOD活性增加。其中,尼古丁低剂量和中剂量组MDA含量明显下降,差异有统计学意义(P<0.05,P<0.01);尼古丁低、中剂量组GSH-Px有不同程度的增加,差异有统计学意义(P<0.01,P<0.05);尼古丁低剂量组SOD活性增加,差异有统计学意义(P<0.05)。见图5。
2.7长期吸入尼古丁对SD大鼠血清TNF-α、IL-1β、IL-10含量的影响SD大鼠长期吸入尼古丁后,与对照组比较,尼古丁低、中剂量组血清中TNF-α量显著增加,差异具有统计学意义(P<0.01)。尼古丁低、中、高剂量组血清中IL-1β量几乎无变化,差异无统计学意义;与对照组比较,尼古丁低剂量和中剂量组血清IL-10量显著增加,差异有统计学意义(P<0.01)。见图6。

图5 长期吸入尼古丁对SD大鼠血清MDA、GSH-Px含量及SOD活性的影响
A:MDA;B:GSH-Px;C:SOD活性;1:对照组;2:尼古丁低剂量组;3:尼古丁中剂量组;4:尼古丁高剂量组;与对照组比较:*P<0.05,**P<0.01
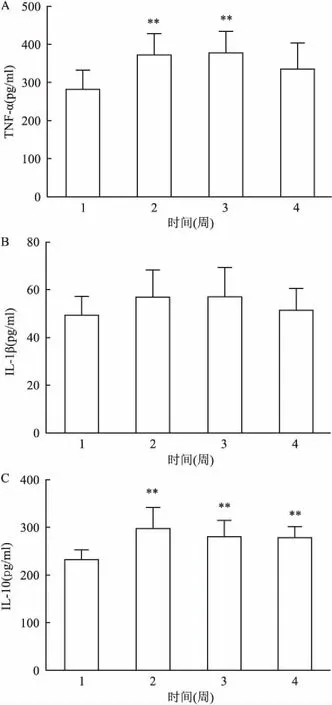
图6 长期吸入尼古丁对SD大鼠血清TNF-α、IL-1β、
A:TNF-α;B:IL-1β;C:IL-10;1:对照组;2:尼古丁低剂量组;3:尼古丁中剂量组;4:尼古丁高剂量组;与对照组比较:**P<0.01
2.8长期吸入尼古丁对SD大鼠肺TNF-α、IL-1β、IL-10含量的影响SD大鼠长期吸入尼古丁后,与对照组比较,尼古丁低、中、高剂量组肺组织TNF-α、IL-1β、IL-10 含量都有不同程度的增加,差异有统计学意义(P<0.01)。见图7。
2.9长期吸入尼古丁对SD大鼠心肌TNF-α、IL-1β、IL-10含量的影响SD大鼠长期吸入尼古丁后,与对照组比较,尼古丁低、中、高剂量组心肌组织中TNF-α、IL-1β、IL-10含量有不同程度的增加,差异有统计学意义(P<0.01)。见图8。
3 讨论
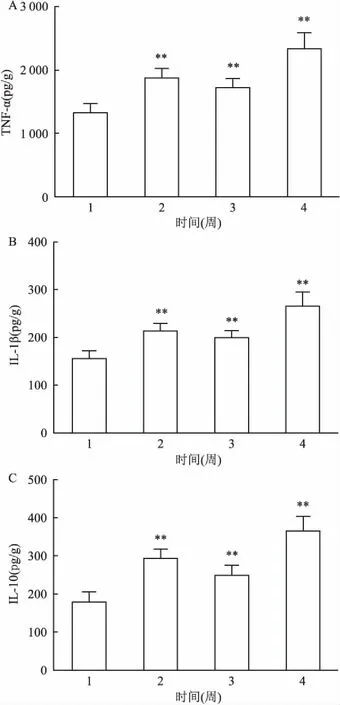
图7 长期吸入尼古丁对SD大鼠肺组织中TNF-α、IL-1β、IL-10含量的影响
A:TNF-α;B:IL-1β;C:IL-10;1:对照组;2:尼古丁低剂量组;3:尼古丁中剂量组;4:尼古丁高剂量组;与对照组比较:**P<0.01
烟草中含有多种生物活性物质,其中最重要的活性成分是尼古丁,而尼古丁是引起肺部疾病,心血管疾病和免疫功能障碍发展中的主要危险因素[3]。氧自由基的产生可抑制eNOS的活性,进而影响NO和内皮素1(endothelin-1, ET-1)的释放[4]。血管内皮细胞是一层覆盖在血管管腔的单层细胞,已证实内皮具有活跃的内分泌功能,通过释放多种介质,参与血管的收缩与舒张,血管的生成以及炎症反应[5]。各种物理化学因素、氧化应激、炎症等都可造成血管内皮的损伤,而内皮损伤是高血压、冠心病等疾病发展的重要病理学基础。尼古丁通过改变NO缓激肽,内皮素和白三烯的释放来影响血管张力,其中NO是血管内皮细胞合成和分泌最重要的血管舒张因子,作为反映血管受损程度及功能的一项指标,在调控血管张力中有着重要意义。血管内皮细胞通过eNOS生成NO,eNOS是诱导合成NO的关键性限速酶,eNOS/NO信号通路与高血压等内皮功能障碍相关疾病的发生发展密切相关。

图8 长期吸入尼古丁对SD大鼠心肌组织中TNF-α、IL-1β、IL-10含量的影响
A:TNF-α;B:IL-1β;C:IL-10;1:对照组;2:尼古丁低剂量组;3:尼古丁中剂量组;4:尼古丁高剂量组;与对照组比较:**P<0.01
活性氧(reactive oxygen species,ROS)引起细胞的毒性过程称为氧化应激,在调控血管张力和内皮功能中有着重要意义。尼古丁可增加血液ROS 的产生,且存在剂量依赖性[6]。其中,过氧化的脂质可分解产生MDA,因此MDA的含量可作为一项细胞受损程度和自由基产生情况的指标。而GSH-Px和SOD在吸烟介导的氧化应激中都有着重要的保护作用,两者可以用来评价氧化应激的影响程度[7]。本实验结果表明,大鼠血清SOD活性升高,GSH-Px含量增加,而MDA含量明显降低,其机制可能与尼古丁通过作用于烟碱型乙酰胆碱受体,同时激动交感神经系统和副交感神经系统,引起的机体氧化-抗氧化水平的失衡有关。
TNF-α作为机体创伤或感染后产生最早的炎性因子之一,TNF-α的水平是反映肺部感染及病变程度的良好指标。而IL-1β与TNF-α有十分相似的作用,在肺部炎性疾病早期,IL-1β参与肺部炎性疾病的发病过程,在急性肺损伤中,IL-1β较早生成,可诱发、放大炎症反应,临床上以其水平的高低来判断肺损伤程度[8-12]。同时IL-1β也会导致肺纤维化,主要诱导炎症反应,可通过协同TNF-α并促进其他炎性因子的表达,进而加强炎性反应程度[13]。IL-10是由Th2 细胞产生的一种细胞因子,是强有力的抗炎因子。尼古丁抑制促炎细胞因子TNF-α,IL-1β和IL-12的产生,同时刺激IL-10的分泌,通过作用于烟碱受体发挥抗炎作用[14]。本实验结果显示,尼古丁低、中、高剂量组的心、肺组织TNF-α、IL-1β、IL-10含量均明显升高,说明尼古丁的吸入可引起大鼠心、肺组织的炎症反应。
综上所述,本实验采用载气吹扫尼古丁吸入法,观察到尼古丁可引起大鼠内皮细胞功能紊乱和血压的升高,氧化应激的失衡和心、肺组织的炎症及心功能的损伤,其深入机制有待进一步探讨。
[1] Zainalabidin S, Budin S B, Ramalingam A, et al. Aortic remodelling in chronic nicotine-administered rat[J]. Korean J Physiol Pharmacol, 2014, 18(5):411-8.
[2] 王 康, 张敬军. 尼古丁的负性功效及作用机制研究进展[J].中华脑科疾病与康复杂志(电子版),2015,5(4):278-82.
[3] Hwa Jung B, Chul Chung B, Chung S J, et al. Different pharmacokinetics of nicotine following intravenous administration of nicotine base and nicotine hydrogen tartrate in rats[J]. J Control Release, 2001, 77(3):183-90.
[4] 罗宏丽, 肖顺林, 叶 云, 等. 卡托普利对尼古丁所致大鼠血管内皮功能损伤的保护作用[J].中国药房, 2008,19(25):1948-50.
[5] Cooke J P. The endothelium: a new target for therapy[J]. Vasc Med, 2000, 5(1):49-53.
[6] Jain A, Flora S J. Dose related effects of nicotine on oxidative injury in young, adult and old rats [J].J Environ Biol, 2012, 33(2):233-8.
[7] Budzynska B, Boguszewska-Czubara A, Kruk-Slomka M, et al. Effects of imperatorin on nicotine-induced anxiety- andmemory-related responses and oxidative stress in mice [J]. Physiol Behav, 2013, 122 (11):46-55.
[8] 马武华, 吴一龙, 林秋雄. 单肺通气时IL-6、IL-8、TNF-α mRNA 基因表达和乌司他汀的影响[J]. 中国病理生理杂志, 2007, 23(2):271-5.
[9] 袁德培, 丁积善. 清瘟化瘀汤对肺炎小鼠IL-8、TNF-α表达水平的影响[J]. 陕西中医, 2008, 29(4):502-3.
[10] Li L, Yu C H, Ying H Z, et al. Antiviral effects of modified Dingchuan decoction against respiratory syncytial virus infectioninvitroand in an immunosuppressive mouse model [J]. J Ethnopharmacol, 2013, 147(1):238-44.
[11] Al-Sadi R, Guo S, Ye D, et al. Mechanism of IL-1β modulation of intestinal epithelial barrier involves p38 kinase and activating transcription factor-2 activation[J]. J Immunol, 2013, 190(12):6596-606.
[12] 姚艳敏, 徐彤彤, 武 琦, 等. 兔急性肺血栓栓塞症血清TNF-α, IL-1β 和IL-4 的变化[J]. 中国实验方剂学杂志, 2012, 18(8):222-4.
[13] 徐永红, 赵 杰, 王海清, 等. 探讨TNF-α、IL-1β 在矽肺大鼠的表达及辛伐他汀的干预对其影响[J]. 临床肺科杂志, 2012, 17(7):1281-2.
[14] Stéphanie S P, Jiang W, Patrick R, et al. Nicotinic acetylcholine receptors modulate bone marrow-derived pro-inflammatory monocyte production and survival[J]. PLoS One, 2016, 11(2):e0150230.

