乳腺癌组织中EZH2、SOX4蛋白表达变化及其意义
韩福兰,毛荣军,谢乐,吴燕杏,曾敏,陈增伟
(广东省佛山市中医院,广东佛山528000)
乳腺癌致死的主要原因是癌细胞脱落后随淋巴或血液播散全身,形成转移病灶、种植肿瘤或乳腺癌复发。因此测定乳腺癌转移的生物指标,明确其转移机制,是制定合理乳腺癌临床抗肿瘤治疗方案、改善乳腺癌患者预后的一个研究热点[1,2]。果蝇zeste 基因增强子的人类同源物2(EZH2)基因编码的EZH2蛋白是转录抑制子多梳蛋白复合体2(PRC2)的组成部分[3],其主要通过催化组蛋白甲基化作用,调控胚胎干细胞的分化,促进前列腺癌、膀胱癌、肝癌等肿瘤细胞上皮-间质转化(EMT),进而促进肿瘤细胞的转移[4]。另有研究显示,转录因子Y染色体性别决定区相关高迁移率盒蛋白4(SOX4)通过激活TGF-β途径促进卵巢癌细胞EMT,进而提高卵巢癌细胞侵袭力[5,6]。但乳腺癌组织EZH2、SOX4蛋白表达变化及其临床意义尚不明确。本研究探讨了乳腺癌组织EZH2、SOX4蛋白表达变化,并分析其与乳腺癌患者临床病理参数、预后的关系,探讨乳腺癌中EZH2、SOX4作为肿瘤标记物的可能性。现报告如下。
1 资料与方法
1.1 临床资料 选择2010年10月~2015年6月于我院行手术治疗的乳腺癌患者97例。纳入标准:经病理学确诊为乳腺癌,原发且术前未行抗肿瘤治疗。排除标准:年龄≥75周岁,合并其他肿瘤,术前经放、化疗,合并其他严重疾病。纳入患者均为女性,年龄21~68(52.1±8.3)岁。肿瘤直径≤3 cm者31例,>3 cm者66例;TNM分期Ⅰ~Ⅱ期84例,Ⅲ~Ⅳ期13例;分化程度高分化28例,中低分化69例;有淋巴结转移49例,无淋巴结转移48例。留取手术切除乳腺癌组织标本为观察组,癌旁正常组织标本为对照组(均切取自距离肿瘤组织≥3 cm处,病理检查证实为正常乳腺组织)。
1.2 EZH2、SOX4蛋白检测 采用免疫组化SP法。 将保存的石蜡包埋标本4 μm层厚连续切片,常规脱蜡复水,按免疫组化SP法试剂盒(购自北京百奥莱博科技有限公司)说明操作。兔抗人SOX4多克隆抗体、兔抗磷酸化抑癌蛋白EZH2多克隆抗体均购自北京百奥莱博科技有限公司。以PBS为阴性对照,已知阳性染色切片为阳性对照。封片后镜下观察。
取4个100倍光学镜下视野,每个视野至少含有200个细胞。①染色强度:无色计0分,淡黄色计1分,黄棕色计2分,棕褐色计3分。②阳性染色细胞数量占比:<5%计0分,5~<25%计1分,25~<50%计2分,50~<75%计3分,≥75%计4分。将两项得分相乘,结果0~3分为阴性表达,≥3分为阳性表达。
1.3 统计学方法 采用SPSS22.0统计软件。计数资料比较采用χ2检验,相关性分析采用Spearman 秩相关检验。将患者术后出院视为观察起点,随访截止于2016年11月,采用Kaplan-Meier法绘制生存曲线,采用Log-Rank法比较累积生存率和总生存时间。P<0.05为差异有统计学意义。
2 结果
2.1 两组EZH2、SOX4蛋白表达比较 观察组、对照组EZH2蛋白表达阳性率分别为80.41%(78/97)、48.45%(47/97),两组相比,P<0.05;SOX4蛋白阳性表达率分别为82.47%(80/97)、57.73%(56/97),两组相比,P<0.05。
2.2 观察组乳腺癌组织EZH2、SOX4蛋白表达与乳腺癌患者临床病理参数的关系 乳腺癌组织中EZH2蛋白表达与患者的年龄、肿瘤大小、TNM分期均无关(P均>0.05),与淋巴结转移和分化程度相关(P均<0.05);乳腺癌组织中SOX4蛋白表达与患者的年龄、肿瘤大小、TNM分期、分化程度均无关(P均>0.05),与淋巴结转移相关(P<0.05)。
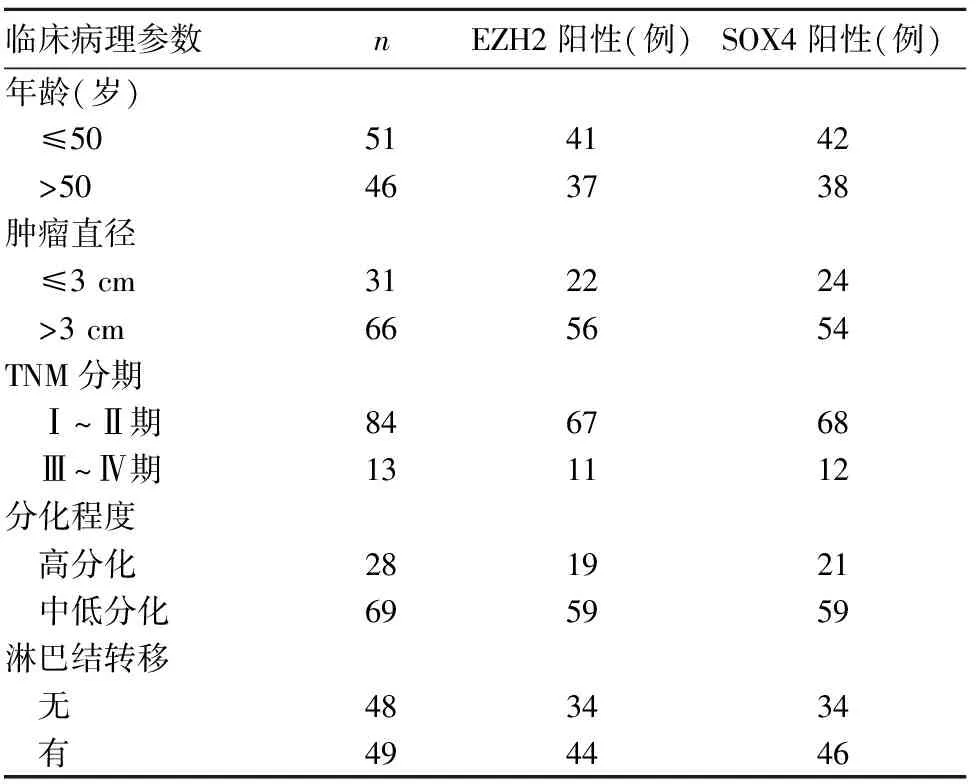
表1 乳腺癌组织EZH2、SOX4蛋白表达与乳腺癌临床病理参数的关系
2.3 乳腺癌组织EZH2、SOX4蛋白表达的相关性 Spearman 秩相关检验结果显示乳腺癌组织EZH2、SOX4蛋白表达呈显著正相关(γs=0.251,P=0.013)。
2.4 乳腺癌组织EZH2、SOX4蛋白表达与患者预后的关系 观察组患者随访13~71个月,中位随访时间44个月。EZH2蛋白表达阴性、阳性者累积生存率分别为89.47%(17/19)、65.38%(51/78),生存时间分别为(67.14±2.62)、(54.30±2.30)个月,EZH2蛋白表达阴性、阳性者累积生存率和总生存时间相比,P均<0.05。SOX4蛋白表达阴性、阳性者累积生存率分别为94.41%(16/17)、65.00%(52/80),生存时间分别为(68.75±2.15)、(54.35±2.27)个月,SOX4蛋白表达阴性、阳性者累积生存率和总生存时间相比,P均<0.05。
3 讨论
EZH2是哺乳动物体内组蛋白H3K27甲基化必须的两种催化酶之一[7]。EZH2为中心的复合物PRC2介导H3K27形成H3K27me3,沉默包括Wnt在内的多个通路相关基因的表达,从而促进细胞EMT,抑制细胞衰老[8]和细胞分化[9]。因此可以推测EZH2蛋白表达的增强往往意味着肿瘤恶性程度的提高。目前已有研究表明EZH2在多种肿瘤组织中高表达,包括前列腺癌[10]、神经胶质瘤[11]、胃癌[12]等。本研究结果表明,乳腺癌组织中EZH2阳性表达率显著高于癌旁非肿瘤组织,与推测和前人研究结果相符。同时EZH2在组织分化程度较低、发生淋巴结转移的乳腺癌患者中的阳性表达率显著高于对照组,也与EZH2抑制细胞分化、促进肿瘤细胞EMT的作用相符。
基因家族SOX调控胚胎的发育,决定细胞的命运。任何SOX基因的缺失、过表达或者突变都有可能造成心脏瓣膜缺失、腭裂等先天发育异常类疾病[13]。SOX4隶属于SOX家族C族,目前仅找到一种由其编码的蛋白产物,即SOX4蛋白,胚胎发育相关的上皮细胞与间质细胞中均已发现SOX4蛋白表达,且SOX4能够促进相关胚胎细胞的增殖[14]。研究表明,SOX4蛋白能够调控TGF-β通路[15]、PTEN/PI3K/AKT信号通路[16]、Wnt信号转导通路[17]等肿瘤相关信号通路,从而促进肿瘤细胞EMT,进而一定程度上诱导肿瘤的发生,增加肿瘤的细胞的侵袭力。因此SOX4基因的异常高表达与多种恶性肿瘤疾病的发生发展密切相关,目前已经得到证实的有肺癌[18]、白血病[19]、前列腺癌[20]等。本研究发现,SOX4在乳腺癌组织中阳性表达率显著高于癌旁正常组织,与前人研究结果相类似,这表明SOX4在乳腺癌细胞中的作用与其在其他肿瘤细胞中的相同。而SOX4对于EMT的促进作用则体现在SOX4在发生了淋巴结转移的患者组中阳性表达率显著提高。同样的,SOX4蛋白表达阳性的乳腺癌患者组累积生存率与总生存时间均显著低于阴性组,也提示SOX4蛋白表达阳性意味着患者预后较差。而与推测不同的是,本研究未发现SOX4蛋白表达在组织分化程度不同的患者组中有差异,这可能是因为SOX4调控的信号通路众多,相互作用复杂,对肿瘤细胞分化的促进与抑制作用并存,从而无法检测出明显的差异。
Pan等[21]研究发现,SOX4能够通过调控EZH2蛋白表达从而调节细胞EMT。本研究Spearman 秩相关检验结果显示EZH2与SOX4蛋白表达呈现显著正相关,提示在乳腺癌组织中SOX4对EMT的调控可能同样通过对EZH2蛋白表达的调控而实现,两者有一定程度上的协同作用。本研究结果还显示,EZH2、SOX4蛋白表达阳性的乳腺癌患者预后较差,提示检测乳腺癌组织EZH2、SOX4蛋白表达有助于临床医师判断患者预后,有一定临床意义。
参考文献:
[1] Richardson LC, Henley SJ, Miller JW, et al. Patterns and Trends in Age-Specific Black-White Differences in Breast Cancer Incidence and Mortality - United States, 1999-2014[J]. Morb Mortal Weekly Rep, 2016,65(40):1093-1098.
[2] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[3] Lund AH, van Lohuizen M. Polycomb complexes and silencing mechanisms[J]. Curr Opin Cell Biol, 2004,16(3):239-246.
[4] Otte AP, Kwaks TH. Gene repression by Polycomb group protein complexes: a distinct complex for every occasion[J]. Curr Opin Genet Dev, 2003,13(5):448-454.
[5] Xi J, Feng J, Zeng S. Long noncoding RNA lncBRM facilitates the proliferation, migration and invasion of ovarian cancer cells via upregulation of Sox4[J]. Am J Cancer Res, 2017,7(11):2180-2189.
[6] Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer, 2002,2(6):442-454.
[7] Yamagishi M, Uchimaru K. Targeting EZH2 in cancer therapy[J]. Curr Opin Oncol, 2017,29(5):375-381.
[8] Kotake Y, Cao R, Viatour P, et al. pRB family proteins are required for H3K27 trimethylation and Polycomb repression complexes binding to and silencing p16INK4alpha tumor suppressor gene[J]. Genes Dev, 2007,21(1):49-54.
[9] Wang L, Jin Q, Lee JE, et al. Histone H3K27 methyltransferase Ezh2 represses Wnt genes to facilitate adipogenesis[J]. Proc Natl Acad Sci USA, 2010,107(16):7317-7322.
[10] Xiang S, Zou P, Tang Q, et al. HOTAIR-mediated reciprocal regulation of EZH2 and DNMT1 contribute to polyphyllin I-inhibited growth of castration-resistant prostate cancer cells in vitro and in vivo[J]. Biochim Biophys Acta, 2017,1862(3):589-599.
[11] Zhi T, Yu T, Pan M, et al. EZH2 alteration driven by microRNA-524-5p and microRNA-324-5p promotes cell proliferation and temozolomide resistance in glioma[J]. Oncotarget, 2017,8(56):96239-96248.
[12] Ba MC, Long H, Cui SZ, et al. Long noncoding RNA LINC00673 epigenetically suppresses KLF4 by interacting with EZH2 and DNMT1 in gastric cancer[J]. Oncotarget, 2017,8(56):95542-95553.
[13] Lefebvre V, Dumitriu B, Penzo-Méndez A, et al. Control of cell fate and differentiation by Sry-related high-mobility-group box (Sox) transcription factors[J]. Int J Biochem Cell Biol, 2007,39(12):2195-2214.
[14] Dy P, Penzo-Méndez A, Wang H, et al. The three SoxC proteins--Sox4, Sox11 and Sox12--exhibit overlapping expression patterns and molecular properties[J]. Nucleic Acids Res, 2008,36(9):3101-3117.
[15] Vervoort SJ, Lourenuo AR, van Boxtel R, et al. SOX4 mediates TGF-β-induced expression of mesenchymal markers during mammary cell epithelial to mesenchymal transition[J].PLoS One,2013,8(1):53238.
[16] Bilir B, Osunkoya AO, Wiles WG, et al. SOX4 Is Essential for Prostate Tumorigenesis Initiated by PTEN Ablation[J]. Cancer Res, 2016,76(5):1112-1121.
[17] Zhang P, Li J, Song Y, et al. MiR-129-5p Inhibits Proliferation and Invasion of Chondrosarcoma Cells by Regulating SOX4/Wnt/β-Catenin Signaling Pathway[J].Cell Physiol Biochem,2017,42(1):242-253.
[18] Wang D, Gao ZM, Han LG, et al. Long noncoding RNA CASC2 inhibits metastasis and epithelial to mesenchymal transition of lung adenocarcinoma via suppressing SOX4[J]. Eur Rev Med Pharmacol Sci, 2017,21(20):4584-4590.
[19] Fernando TR, Contreras JR, Zampini M, et al. The lncRNA CASC15 regulates SOX4 expression in RUNX1-rearranged acute leukemia[J]. Mol Cancer, 2017,16(1):126.
[20] Liu Y, Zeng S, Jiang X, et al. SOX4 induces tumor invasion by targeting EMT-related pathway in prostate cancer[J]. Tumour Biol, 2017,39(5):1010428317694539.
[21] Pan B, Xue X, Zhang D, et al. SOX4 arrests lung development in rats with hyperoxia induced bronchopulmonary dysplasia by controlling EZH2 expression[J].Int J Mol Med, 2017,40(6):1691-1698.

