电荷翻转的pH响应型聚氨酯胶束的制备及其抗菌应用研究
赵礼礼,乔壮壮,姚 燕,罗建斌
(西南民族大学化学与环境保护工程学院,四川 成都 610041)
在日常生活以及医疗卫生中时常会发生细菌感染从而引起各种感染性疾病,这些细菌感染性疾病会给感染者带来严重的经济负担,甚至危及感染者生命[1-3].据统计,因为细菌感染引起的死亡率高达20%,一旦发生细菌感染,使用抗生素是治疗细菌感染最常用的方式.抗生素是能够杀死细菌或者抑制细菌的一类化合物,但是抗生素想要达到一定的治疗效果,需要在细菌感染部位维持一定的浓度,这就需要大量的使用抗生素[4-7].但是抗生素的大量使用会带来很多的问题,如细菌耐药性问题,药物利用效率问题.所以为了能够有效的治疗细菌感染,需要做到以下两点:(1)是将抗生素靶向的运输到细菌感染部位;(2)能使感染部位抗生素浓度维持在一个稳定的范围内,能够达到很好的治疗效果[8-10].
目前,利用两亲性聚合物胶束输送抗菌药物具有很好的发展前景.聚合物胶束是利用聚合物的亲疏水差异在水溶液中形成的具有核壳结构的球形胶体,其亲水外壳能提高胶束的血液循环,疏水空腔可以包载疏水药物,能有效的解决疏水性药物的溶解性、生物利用率、毒副作用等缺点.但是普通胶束很难靶向到达细菌感染部位,这就需要设计一种智能响应的胶束[11-13].pH敏感的胶束能响应于不同的酸碱环境,主要是利用其在不同pH条件下胶束上的响应基团的质子化和去质子化作用使胶束发生变化或者破坏,从而使药物载体释放药物.
最近,阳离子纳米颗粒已被证明可以通过与带负电荷的微生物细胞表面的强烈静电相互作用来抑制浮游,耐甲氧西林金黄色葡萄球菌和真菌的生长.但是,带正电荷的纳米载体在血液循环中短暂,其在体内应用的一个重大障碍是易被网状内皮系统的清除,这导致对身体中特定部位的低效靶向.因而,可电荷翻转的聚合物胶束成了解决胶束血液长循环及提高抗菌性能的关键[14-16].
在本文中,设计了一个三氯生包载的pH响应型的阳离子聚氨酯胶束,可以实现:1)在正常生理环境下,胶束保持电负性,在酸性环境下胶束表面电荷翻转带正电,提高其对浮游细菌的靶向;2)通过加入的-NH2的量控制胶束表面-COOH和-NH2的比例来调控胶束电荷翻转的位点.因此,在实验中首先确定了在生理pH条件下PU-COOH-NH2胶束带负电,可以保持在体内的长循环;通过调控接入的-NH2的比例使空白胶束在pH 6.0下带正电(包载三氯生的胶束电位翻转位点为5.5),易于带负点的细菌结合,一旦胶束结合到细菌表面,细菌分泌的脂肪酶降解内核聚己内酯(PCL)快速释放抗菌剂(三氯生)从而快速杀死细菌,提高了抗菌性能.

方案1 PU-COOH-NH2胶束在pH 5.5和pH 7.4下的结构示意图Scheme 1 Schematic diagram of the PU-COOH-NH2micelles under pH 5.5 and pH 7.4
1 实验部分
1.1 试剂与仪器
聚乙二醇(PEG),分析纯,中国阳光生物技术(南京)有限公司;聚(ε-己内酯)二醇(PCL),分析纯,Dow Chemical,USA;六亚甲基 -1,6 - 二异氰酸酯(HDI),分析纯,中国阿拉丁工业公司;2,2-二(羟甲基)丙酸(DMPA),分析纯,中国阿拉丁工业公司;二环己基碳二亚胺(DCC),分析纯,成都市科龙化工试剂厂;三氯生(TLS),生物试剂,中国西雅试剂有限公司;十二烷基硫酸钠,分析纯,中国科龙化学试剂厂;脂肪酶,生物试剂,中国Klamar试剂.傅立叶变换红外光谱仪,塞默 THERMO IR200;核磁共振波普仪,DD2 400-MR安捷伦.
2.2 实验过程
2.2.1 PU-COOH的合成
PU-COOH的合成通过传统的两步溶液聚合方法,投料比列于表1.将无水PEG和PCL在100℃真空环境下除水2 h,随后HDI加入到PCL和PEG的混合物中,并在0.1%辛酸亚锡(Sn(Oct)2)存在下,在90℃下搅拌4小时进行预聚.然后将预聚物在90℃下加入DMPA扩链4小时.之后,将反应混合物冷却至室温.为了除去有机溶剂和杂质,随后将粗产物倒入体积比为3:1的水和甲醇混合物中.将沉淀剂再溶解于DMAc中,并通过水和甲醇混合物沉淀.收集聚合物,在40℃,大气中干燥5小时,在60℃下减压干燥2天,得到最终产物.
2.2.2 PU-COOH-NH2的合成
为了确定胶束表面电荷翻转的位点,实验中设计了三种含不同比例的胶束(PU-COOH-NH2-1,PU-COOH -NH2-2,PU -COOH -NH2-3),三种聚合物的合成路线一致,其投料比列于表1.具体做法是将PU-COOH(5 g)在室温下搅拌溶解在DMF(15 mL)和THF(20 mL)的混合物中.加入1,6-己二胺(0.8 mmol)和1-羟基苯并三唑(HOBT,0.3 mmol),将反应溶液置于冰盐浴中15分钟.然后,在搅拌下加入二环己基碳二亚胺(DCC,2 mmol)18小时完成DCC缩合反应.使用与纯化PU-COOH相同的方法纯化聚氨酯.最终产物表示为PU-COOH-NH2.
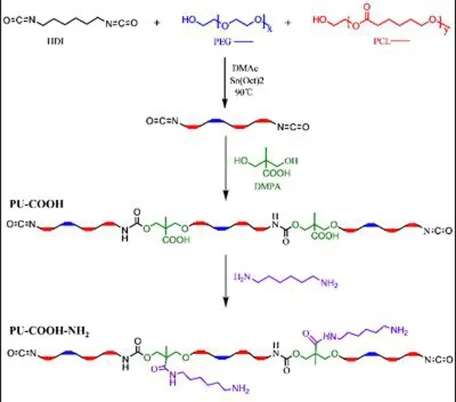
图1 PU-COOH和PU-COOH-NH2的合成路线Fig.1 The Synthesis route of PU-COOH and PU-COOH-NH2

表1 PU-COOH,PU-COOH-NH2的组成及其自组装胶束的表征Table 1 The composition of PU-COOH,PU-COOH-NH2and the characterization of their self-assembled micelles
2.2.3 聚氨酯胶束的制备
使用透析法制备聚氨酯胶束.通常,将聚氨酯(20 mg)加入到4 mL二甲基乙酰胺(DMAc)中搅拌溶解2小时.将混合溶液缓慢滴加到15 mL去离子水中.随后,将胶束溶液转移到透析袋(MWCO,3.5 kDa)中,并用蒸馏水透析72小时,在室温下除去有机溶剂.最后,将胶束溶液通过0.45 μm的注射器过滤器(Millipore,Carrigtwohill,Co.Cork,爱尔兰),并在4 ℃下储存.
2.2.4 包载三氯生的胶束的制备
首先将PU-COOH-NH2聚氨酯(20 mg)与三氯生(15 mg)溶于DMAc.然后将混合溶液加入到15 mL去离子水中,然后透析除去DMAc.将所得水溶液以10000 rpm离心5分钟,然后通过0.45 μm孔径的注射器过滤器过滤以除去未结合的三氯生.
2.2.5 胶束的载药量和包封率
胶束的载药量和包封率可加入DMAc完全破坏胶束之后,通过测量281 nm处的UV吸光度来测定,其中所得溶液为DMAc:水(9:1).校准曲线通过测量含有0~100 μg mL-1的三氯生的标准溶液(DMAc:水,9:1)在281 nm处的UV吸光度获得.其三氯生的标准曲线为Y=0.0461X-0.0074,R2=0.9992.
载药量(LC)=胶束中药物的质量/负载胶束的总质量×100%
包封率(EE)=胶束中药物的质量/初始给药量×100%
2.2.6 抗菌性能
用革兰氏阴性细菌大肠杆菌(ATCC 35218)和革兰氏阳性菌金黄色葡萄球菌(ATCC 29213)进行抗菌实验.使用红四氮唑作为指示剂的微孔板肉汤稀释法测定MIC.将原液100 μL负载三氯生的胶束悬浮液加入100 μL液体培养液混合,最后加入100 μL细菌悬浮液,使每个孔中混合液最终的细菌浓度为1×106CFU mL-1.在37℃中培养24 h后用红四氮唑显色,浓度最低的不显示红色的浓度为最低抑菌浓度(MIC).
3 结果与讨论
3.1 聚氨酯材料的表征
对于制备出来的PU-COOH和PU-COOHNH2,可以通过1H NMR和FT-IR来证明是否制备成功.图2中A为PU-COOH的核磁谱图,B为PUCOOH-NH2-3的核磁谱图.位于3.62 ppm处的共振峰(e峰)为PEG单元上质子峰;位于4.04 ppm(j峰),2.29 ppm(f峰),1.62 ppm(g峰和 i峰)和1.36 ppm(h峰)处的共振峰为PCL单元上的质子峰;位于1.1附近的的共振峰为HDI单元上的质子峰;位于4.25 ppm(l峰)处的共振峰为DMPA上亚甲基的质子峰.位于1.80 ppm(p峰)为1,6-己二胺的氨基的质子峰,表明聚氨酯PU-SS-COOH-NH2-1上有伯胺存在
图3为PU-COOH和PU-COOH-NH2-1的红外谱图,从图中可以看到羧基中的羰基υ(C=O)1760 cm-1和羟基υ(O -H)3550 cm-1的红外特征峰,证明羧基已经成功接上,但氨基的特征峰被其他峰所掩盖.所以结合PU-COOH和PU-COOH-NH2-1的核磁谱图以及红外谱图分析可以证明我们已经成功的制备出PU-COOH和PU-COOH-NH2-1.

图2 PU-COOH(A)和PU-COOH-NH2-3(B)在CDCl3-d6中的1H NMR谱Fig.2 The1H NMR spectra of PU-COOH(A)and PU-COOH-NH2-3(B)in CDCl3-d6

图3 PU-COOH和PU-COOH-NH2-1的红外光谱图.Fig.3 FT-IR spectroscopy of PU-COOH and PU-COOH-NH2-1.
3.2 包载三氯生的聚氨酯胶束的临界胶束浓度
具有疏水性的PCL内核和亲水的PEG外壳的两亲性多嵌段的聚氨酯在水溶液中可以自组装成胶束.聚氨酯胶束的核壳结构及稳定性可以通过用包载芘作为探针来证明(图4).芘是一种疏水的荧光探针可以包载于胶束内核,通过荧光分光光度计可以测得不同胶束浓度的荧光强度,以337.5 nm与333.5 nm处峰强度的比值为纵坐标,将logC为横坐标可得到一条S型曲线,切线交叉点即为临界胶束浓度见图4,经统计可以得出,PU-COOH的CMC值为9.6376×10-4mg mL-1,PU -COOH - NH2-1 的 CMC 值为1.088 ×10-3mg mL-1,其临界胶束浓度较低,说明了胶束很稳定.
3.2.1 聚氨酯胶束的粒径与电位表征
透射电镜可表征胶束的粒径及形貌,通过透射电镜图可观察到PU-COOH-NH2-3的形貌为球形(图5),还有粒径大约在100 nm左右,其数值与通过DLS测得的粒径数据(表1)相吻合.DLS和TEM测得的粒径微小差异是由于DLS测得的包含有水和半径.
PU-COOH和PU-COOH-NH2的胶束粒径和电位通过动态光散射(DLS)在25℃下测得(Malvern ZetasizerNano,Zen 3690 + MPT2,Malvern,UK).在表 1中显示,DLS测得的PU-COOH,PU-COOH-NH2-1,PU-COOH -NH2-2,PU -COOH -NH2-3胶束粒径分别为 101.30 nm,97.91 nm,102.60 nm,89.12 nm.PU-COOH-NH2-3胶束的粒径最为稳定且在pH 6.0左右电位翻转(图6),符合实验设计要求.从D图中可见包载了三氯生的PU胶束电位在5.5,这是因为三氯生是一种带负电的抗菌剂.3.2.2 包载聚合物胶束的抗菌性能
如表2所示,包载三氯生的PU-COOH-NH2-TLS胶束的载药率高达57.50%,包封率高达46.01%,载药率与包封率均高于相关文献值[16].MIC数据显示相对于游离三氯生,将三氯生包载于胶束内核能显著提高其抗菌性能.主要是由两方面的原因,第一,胶束中疏水链段PCL在细菌脂肪酶作用下导致药物的快速释放;第二,胶束表面电荷的可翻转性使得胶束在酸性条件下带正电,能够与带负电的细菌通过静电相互作用从而提高了其抗菌性能.
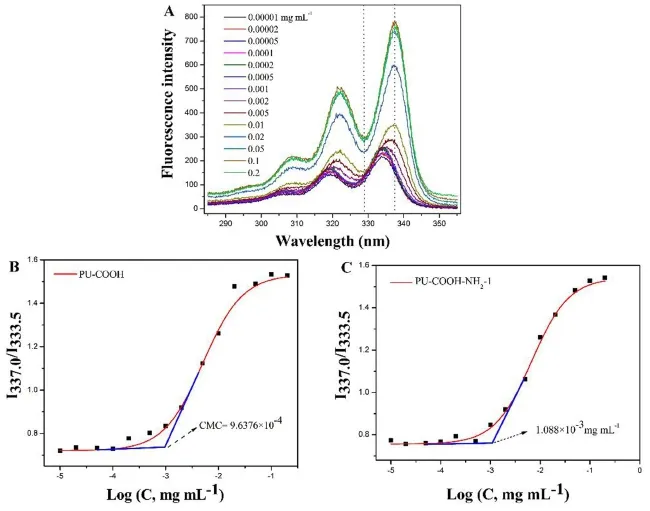
图4 PU-COOH胶束和PU-COOH-NH2-1胶束的临界胶束浓度Fig.4 The CMC of the PU-COOH micelles and PU-COOH-NH2-1 micelles
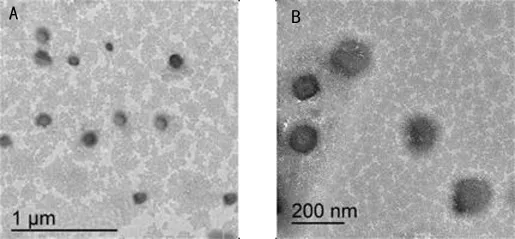
图5 PU-COOH-NH2-3胶束的透射电镜图Fig.5 TEM of PU-COOH-NH2-3 micelles
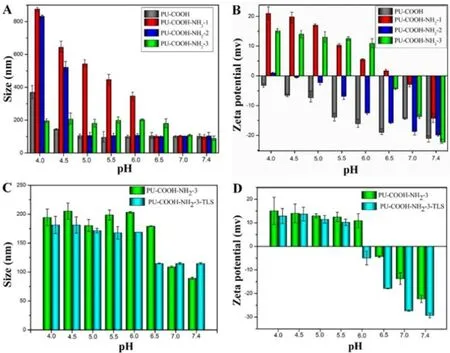
图6 空白胶束及包载三氯生的胶束在不同pH下的粒径及电位变化Fig.6 Particle size and potential changes of the emty and Triclosan-loaded PU micelles at different pH values

表2 负载聚合物胶束的载药率和包封率和PU-COOH-NH2-TLS胶束的MIC值Table 2 Loading content and encapsulation efficiency of polymer micelles and MIC values of PU-COOH-NH2-TLS micelles
4 结论
本实验成功制备了一种新型的电荷翻转的pH响应型的聚氨酯胶束PU-COOH-NH2,在pH 7.4条件下胶束呈负电保持了胶束的长循环,在酸性条件下胶束表面电荷翻转提高了抗菌性能.通过加入不同比例的1,6-己二胺控制电荷翻转位点,其中 PUCOOH-NH2-3具有稳定性好,且包载药物后形成的胶束PU-COOH-NH2-3-TLS具有较高的载药率和包封率高且在pH 5.5左右电荷翻转,其抗菌性能优于游离三氯生.
[1] WANG L S,GUPTA A,ROTELLO V M.Nanomaterials for the Treatment of Bacterial Biofilms[J].Acs Infectious Diseases,2016,2(1):3-4.
[2] 姜越,张德纯.表皮葡萄球菌生物膜形成机制及调控[J].中国微生态学杂志,2011,23(11):1056-1056.
[3] CHEOW W S,CHANG M W,HADINOTO K.Antibacterial Efficacy of Inhalable Antibiotic-Encapsulated Biodegradable Polymeric Nanoparticles Against E.coli Biofilm Cells[J].Journal of Biomedical Nanotechnology,2010,6(4):391-403.
[4] PEULEN T O,WILKINSON K J.Diffusion of Nanoparticles in a Biofilm[J].Environmental Science & Technology,2011,45(8):3367-3373.
[5] LAN H K,JUNG Y,YU H W,et al.Physicochemical Interactions between Rhamnolipids and Pseudomonas aeruginosa Biofilm Layers[J].Environmental Science & Technology,2015,49(6):3718-3726.
[6] THOMAS N,DONG D,RICHTER K,et al.Quatsomes for the treatment of Staphylococcus aureus biofilm[J].Journal of Materials Chemistry B,2015,3(14):2770-2777.
[7] 施德仕,邵海枫.细菌生物膜感染的研究进展[J].医学研究生学报,2011,24(12):1319-1323.
[8] 段高飞,韩峰,李京宝,等.细菌生物膜相关感染的防治方法研究进展[J].中国海洋大学学报(自然科学版),2010,40(5):107-111.
[9] GANEWATTA M S,MILLER K P,SINGLETON S P,et al.Antibacterial and Biofilm-Disrupting Coatings from Resin Acid-Derived Materials[J].Biomacromolecules,2015,16(10):3336-3344.
[10] LI X,YEH Y C,GIRI K,et al.Control of nanoparticle penetration into biofilms through surface design[J].Chemical Communications,2015,51(2):282-285.
[11] 唐俊妮,史贤明,王红宁,等.细菌生物膜的形成与调控机制[J].生物学杂志,2009,26(2):48-50.
[12] JAISWAL S,BHATTACHARYA K,MCHALE P,et al.Dual effects of β-cyclodextrin-stabilised silver nanoparticles:enhanced biofilm inhibition and reduced cytotoxicity[J].J Mater Sci Mater Med,2015,26(1):52-67.
[13] LIU Y,BUSSCHER H J,ZHAO B,et al.Surface - Adaptive,Antimicrobially Loaded,Micellar Nanocarriers with Enhanced Penetration and Killing Efficiency in Staphylococcal Biofilms[J].Acs Nano,2016,10(4):4779-4789.
[14] FORIER K,RAEMDONCK K,DE SMEDT S C,et al.Lipid and polymer nanoparticles for drug delivery to bacterial biofilms[J].Journal of Controlled Release,2014,190:607-623.
[15] ONAT B,BÜTÜN V,BANERJEE S,et al.Bacterial anti- adhesive and pH-induced antibacterial agent releasing ultra-thin films of zwitterionic copolymer micelles.[J].Acta Biomaterialia,2016,40:293-309.
[16] RUSSELL A D.Whither triclosan?[J].Journal of Antimicrobial Chemotherapy,2004,53(5):693-695.

