应用光学相干断层扫描成像技术分析比较急慢性中心性浆液性脉络膜视网膜病变的变化*
许发宝,周立军,巩亚军,赖坤贝,黄创新,李龙辉,吕 林,金陈进
(中山大学中山眼科中心, 眼科学国家重点实验室, 广东 广州 510060)
中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy,CSC)是一种多发于青壮年男性、常累及黄斑区以浆液性视网膜脱离为特征的自限性疾病[1],其发病机制尚不完全清楚,多认为由脉络膜循环异常所致,局部视网膜下流体静压升高进而导致视网膜色素上皮(retinal pigment epithelium,RPE)细胞外屏障功能遭到破坏[2-4]。目前,CSC诊断的金标准仍是眼底荧光素血管造影(fundus fluorescein an-giography,FFA)和吲哚菁绿血管造影(indocyanine green angiography,ICGA),但鉴于造影是一项有创性检查,其过程中需要经静脉注射造影剂,部分患者会有恶心和过敏等不良反应的发生[5]。此外,FFA和ICGA对于视网膜下积液和视网膜脉络膜结构的观察有其局限性。近年来光学相干断层扫描技术(optical coherence tomography,OCT)逐渐成为CSC重要的补充检查手段,横断面的OCT扫描类似一张活体的组织切片,用于分析视网膜脉络膜切面结构,评估病情严重程度方面有独特的优势[6-7]。OCT作为一种现代成像技术,在过去的十年里取得了很大的进步,它使用与超声波相似的技术,应用光学相干的原理可对眼组织做断层成像,谱域光学相干断层扫描技术(spectral domain optical coherence tomography,SD-OCT)分辨率可达到5 μm,无创且成像速度快[8-9]。此外,光学相干断层扫描血管成像(optical coherence tomographic angiography,OCTA)是近年来OCT技术上的又一重大突破,其中通过分光谱振幅去相关血管成像的原理,不仅可以在无造影剂的情况下获取清晰的眼底血管图像,还可以进行视网膜脉络膜不同层次横断面血管结构的分析,为我们随访并评估疾病发展阶段及严重程度提供了极大便利[10-12]。本研究的目的是通过OCTA和SD-OCT技术分析比较急慢性CSC患者脉络膜浅层毛细血管结构和视网膜外层结构完整性等结构的差异。
材 料 和 方 法
1 入组患者
2016年11月~2017年5月在中山大学中山眼科中心就诊,经详细眼科检查确诊的CSC患者56例(60眼)纳入研究。发病时间在6个月内,伴有视力下降或视物变小变暗等症状,FFA和ICGA检查存在明确渗漏点定义为急性CSC;伴有视觉症状,FFA和ICGA检查病灶呈弥散性或斑点状的渗漏,且病程超过6个月定义为慢性CSC[13-14]。
2 纳入和排除标准
纳入标准:(1)经FFA和ICGA确诊且渗漏点位于黄斑中心凹附近的CSC,B扫描存在视网膜下积液;(2)最佳矫正视力(best corrected visual acuity,BCVA)≥35字母数(early treatment diabetic retinopathy study,ETDRS视力表);(3)屈光介质清晰。排除标准:(1)合并其它影响检查的眼科疾病或诊断不明确者;(2)之前接受过眼底激光和玻璃体腔内注药等手术治疗的患者;(3)色素上皮脱离(pigment epithelial detachment,PED)区域平均直径≥400 μm的患者(横径与竖径取平均值);(4)OCTA图像质量指数低于65的患者。
3 眼科检查
对每位入组患者进行详细的眼科检查,包括BCVA、非接触式眼压和经托吡卡胺散瞳后的裂隙灯显微镜检查。此外,还有FFA(Spectralis; Heidelberg Engineering GmbH)、ICGA(Spectralis; Heidelberg Engineering GmbH)、OCTA(RTVue XR Avanti with AngioVue; Optovue Inc.)和SD-OCT(Spectralis; Heidelberg Engineering GmbH)检查。所有的检查都是在上午9:00~11:00之间进行的,尽量避免时间对脉络膜毛细血管结构的影响。
4 光学相干断层扫描检查
OCTA是一种新的非侵入性血管成像技术,通过分光谱振幅去相关原理成像,可以进行视网膜脉络膜不同层次横断面组织切片的数据分析[15-17]。为了获得质量较高的数据,我们采用其3×3模式图像及其系统默认分层进行分析,横断面组织毛细血管切片的数据包括视网膜表层毛细血管(capillary of superficial retina, SR)、视网膜深层毛细血管(capillary of deep retina, DR)和脉络膜浅层毛细血管(capillary of superficial choroid, SC)。SR定义为在内界膜(inner limiting membrane,ILM)下的3 μm到内丛状层(inner plexiform layer,IPL)下15 μm;DR定义为IPL下15~70 μm;SC定义为RPE参考面下30~60 μm。因CSC病因可能出现在脉络膜毛细血管层,我们重点分析SC的结构特征。
SD-OCT是目前眼底病检查分辨率最高的影像学技术,其精度可达到5 μm左右,其发展也促进了人们对于视网膜解剖结构的认识[8-9]。本研究入组患者眼底图像均采用深度扫描模式(enhanced depth imaging,EDI)获得,分析视网膜外层结构(外界膜至色素上皮细胞层)结构的完整性,其中任一部分结构缺失视为外层结构不完整。包括外界膜、肌样体区、椭圆体带,光感受器外节和RPE反射带。
5 统计学分析
采用SPSS 19.0统计软件行统计学分析处理。计量资料以均值±标准差(mean±SD)表示,以Shapiro-Wilk检验分析数据的正态性及方差齐性。急慢性CSC组计量资料及亚组分析计量资料符合正态分布及方差齐性时采用t检验,不符合则采用秩和检验。急性和慢性CSC“暗区”出现率和完整性的比较采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1 基本资料
本研究纳入患者56例(60眼),其中急性CSC组28例(28眼),慢性CSC组28例(32眼),详见表1。
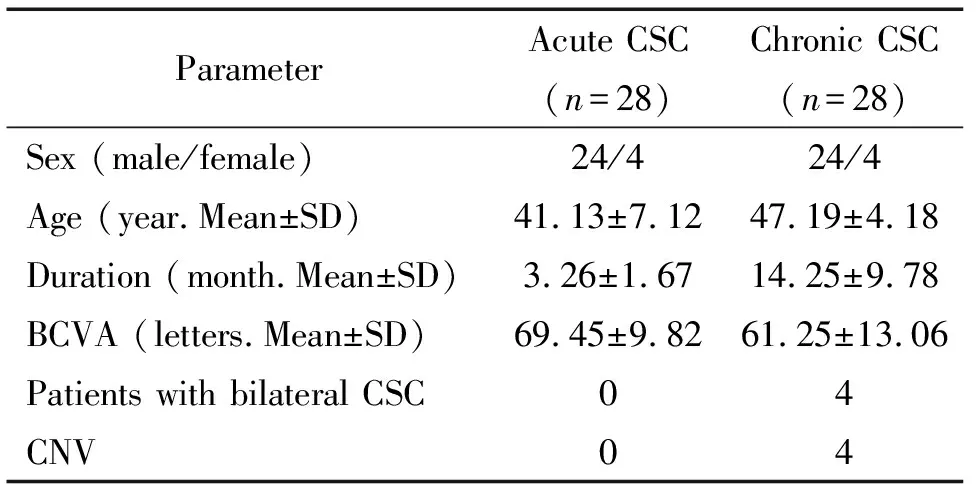
表1 CSC患者基本资料Table 1. Baseline demographic data of the CSC patients
2 脉络膜新生血管
在慢性CSC患者中,4例(4眼, 12.5%)OCTA检测脉络膜浅层毛细血管图像中发现有形态明显的脉络膜新生血管(choroidal neovascularization,CNV)形成,而ICGA中只表现为相应区域早期高灌注,该区域B扫描RPE层略粗糙,小波浪状;急性CSC组中患者在OCTA脉络膜浅层毛细血管与ICGA中均未发现CNV,见图1。
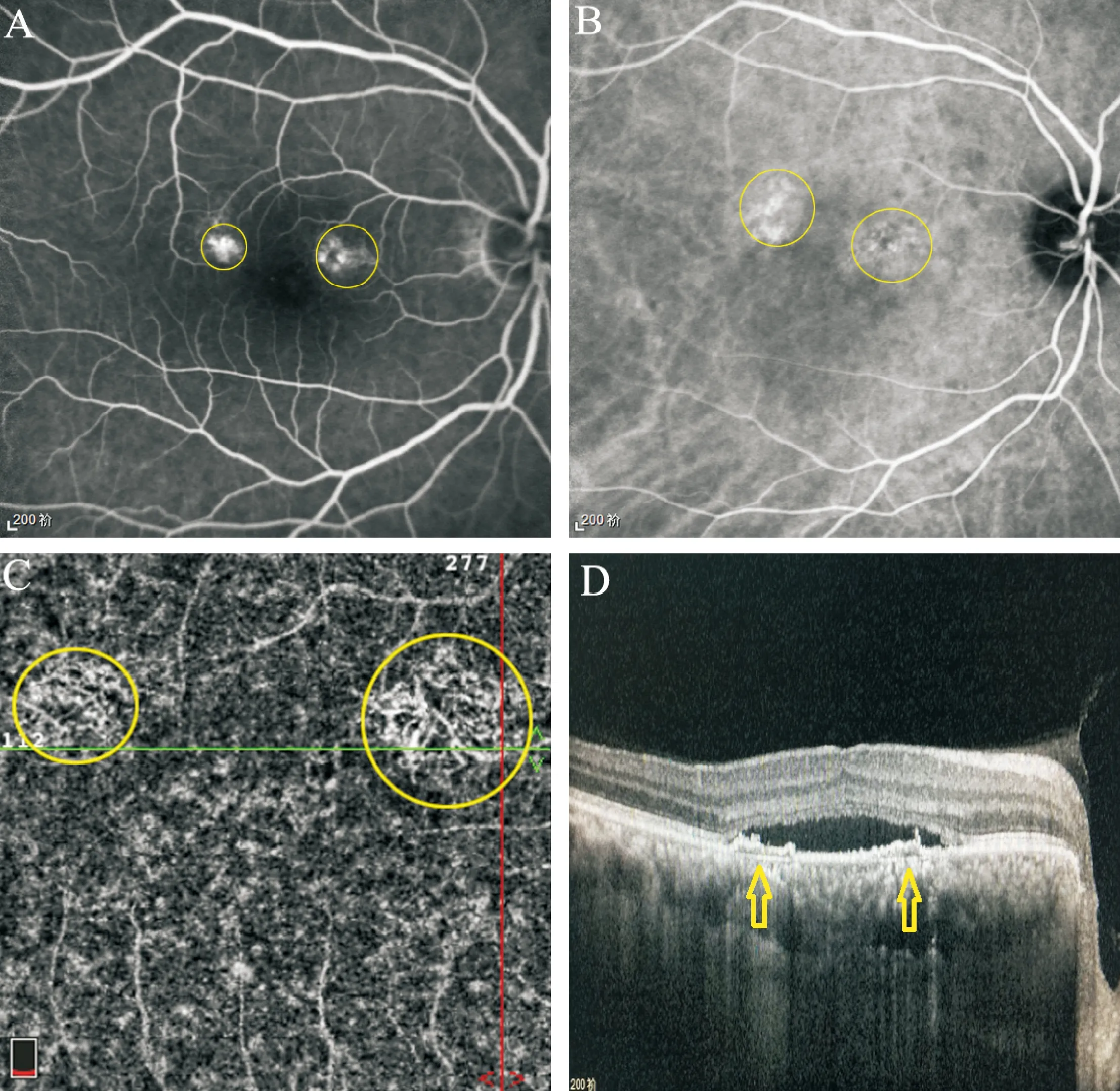
Figure 1. Choroidal neovascularization (CNV) of superficial choroidal capillaries detected by OCTA. A: middle-phase fluorescein angiography of the right eye of a 56-year-old CSC patient in chronic group. A hyperfluorescent superofoveal area was visible. B: middle-phase of indocyanine green angiography showed a hyperfluorescent area without a clear branching vascular network. C: OCTA with the split-spectrum amplitude-decorrelation angiography algorithm at the level of the superficial choroid demonstrated the presence of a distinct neovascular network in the same area as the ICGA hyperfluorescence. D: horizontal B-scan optical coherence tomography of corresponding area.
图1OCTA检测脉络膜浅层毛细血管CNV
3 OCTA脉络膜浅层毛细血管层“暗区”
OCTA脉络膜浅层毛细血管图像分析中,慢性CSC组24例(26眼)存在局部“暗区”(定义为色彩密度值在20以下),远高于急性CSC组5例(5眼)(P<0.01),见图2、表2。

Figure 2. “Dark areas” of superficial choroidal capillaries detected by OCTA. A: the en face projection slab area of the selected 3×3 pattern on OCTA; B: fundus photograph and the location of different capillary layers at all levels; C: superficial retinal layer on OCTA defines as 3 μm below the inner limiting membrane (ILM) to 15 μm below the inner plexiform layer (IPL); D: deep retinal layer on OCTA defines as 15~70 μm below the IPL; E: superficial choroid layer on OCTA defines as 30~60 μm below the RPE; F: B-scan of the selected area; G: the ‘dark areas’ in superficial choroidal layer were marked by red circles; H: superficial choroid layer of healthy subject.
图2OCTA脉络膜浅层毛细血管中的“暗区”
表2脉络膜浅层图像“暗区”出现率分析
Table 2. Occurrence of ‘dark areas’ in superficial choroidal images

GroupExistenceInexistenceChi-squarePAcute52324.031<0.01Chronic266
4 视网膜外层结构完整性分析
急性CSC组外层结构完整26眼(92.86%),明显优于慢性组(3眼,9.38%),其中,本研究纳入慢性CSC组双眼患者外层结构均不完整。经亚组分析,外层结构完整患者29例(29眼),外层结构不完整患者27例(31眼),前者BCVA明显优于后者(P<0.01),病程亦存在明显差异(P<0.01),见图3、表3。
讨 论
CSC是导致青壮年人群视力下降的常见疾病,其确切发病机理尚不清楚,目前也没有比较公认的分类方法,临床上常根据病程是否超过6个月将其分为急性CSC和慢性CSC[13-14]。FFA和ICGA可以为我们提供诊断依据,但并不能帮助我们评估视网膜外层结构的完整性及破坏程度,且造影晚期因造影剂的渗漏遮挡,病变难以准确定位,更无法确定病变部位的层次。OCT逐渐成为CSC患者随访过程中的重要影像学检查方法,其在评估病情严重程度方面优势明显。随着SD-OCT分辨率的提高和OCTA的临床应用,对视网膜脉络膜组织结构的观察更加清晰,OCTA的分层扫描可以准确定位病变发生的部位,观察不同切面的形态,使我们可以更好地判断CSC患者的病程及预后[10, 15]。
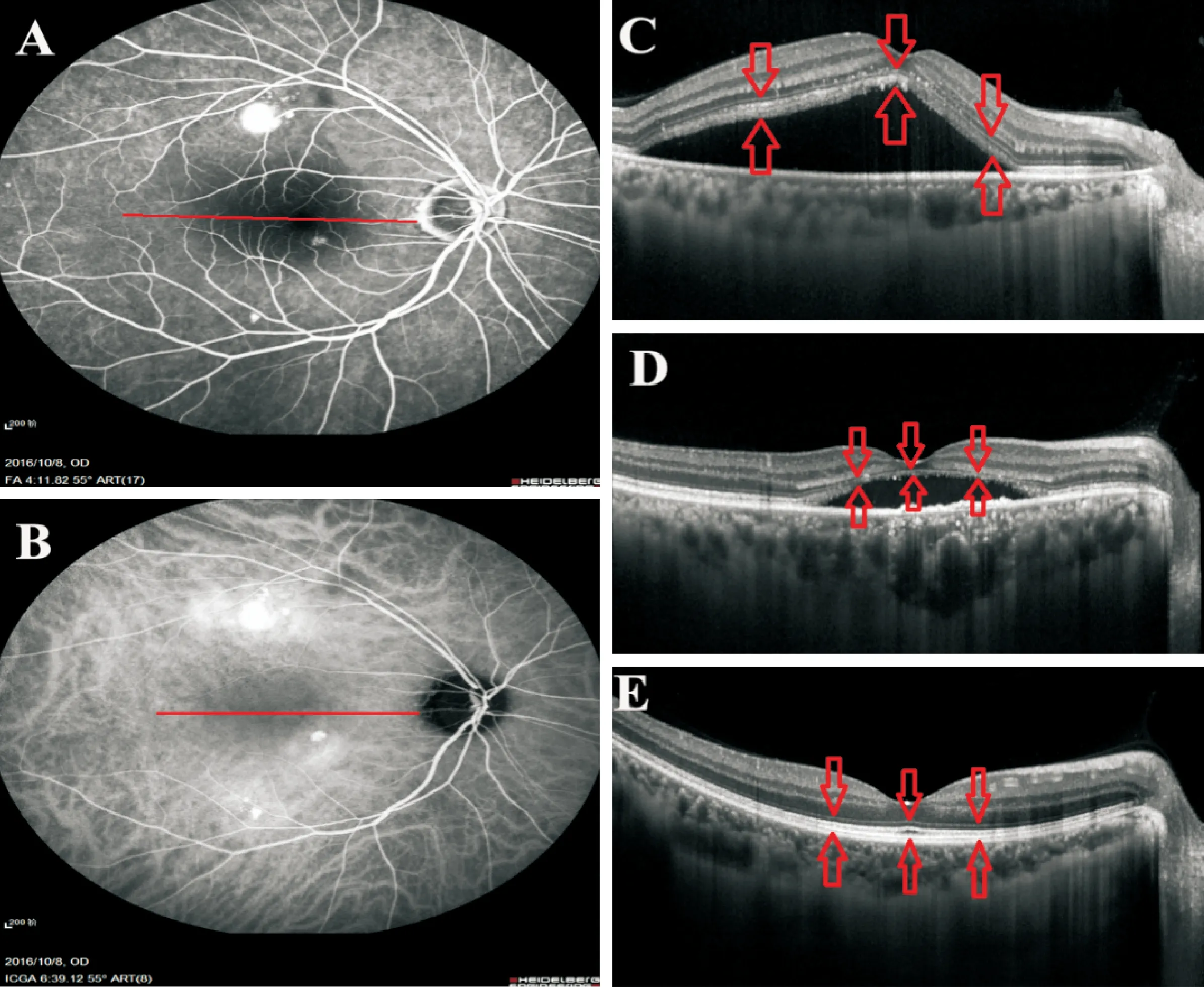
Figure 3. Comparison of outer retinal structure in acute and chronic CSC patients. A~C: a 48-year-old male patient diagnosed as acute CSC. A and B: a hyperfluorescent superofoveal area was visible in middle-phase fluorescein angiography and indocyanine green angiography. C: the structure of out retina is complete in B-scan of patient with acute CSC, including external limiting membrane, myoid zone, ellipsoid zone, outer segments of photoreceptors, and RPE cells. BCVA 1.0. D: the structure of out retina is incomplete in B-scan of patient with chronic CSC, the absent part including myoid zone, ellipsoid zone, and outer segments of photoreceptors. BCVA 0.6. E: B-scan of a healthy subject, the structure of out retina is complete and clear at all levels.
图3急慢性CSC视网膜外层结构的对比
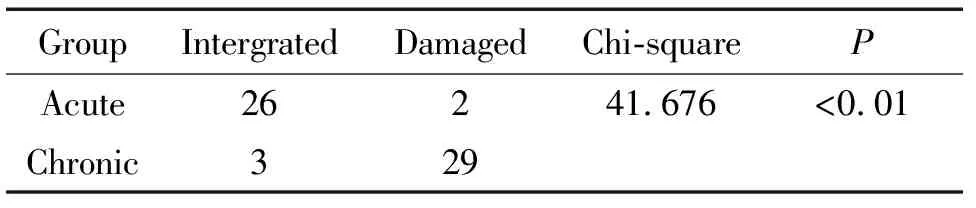
表3 视网膜外层结构完整性分析Table 3. Analysis of the structural integrity of outer retina
在慢性CSC患者,4眼(12.5%)OCTA脉络膜浅层毛细血管图像中发现形态清晰的CNV,而急性患者中未发现CNV的存在。这4例患者的首次治疗时间相比平均水平明显延长,这提示CSC患者的延迟干预可能导致更严重的并发症出现。就目前患者的影像学资料分析,我们并不能将其诊断为老年性黄斑变性或息肉样脉络膜血管病变,但CNV的出现可能会增加治疗难度[18]。由此可见,OCTA的应用使我们发现了早于FFA和ICGA出现的脉络膜浅层组织新生血管结构,这也是对于CSC病程研究的一大进步。
在OCTA 3×3模式图像系统默认分层结构观察中,脉络膜浅层毛细血管异常局部“暗区”的出现频率较高。因脉络膜血管层组织结构的复杂性和对CSC发病机制的认识局限性,很难解释局部“暗区”出现的具体原因及其临床意义,而且“暗区”位置与FFA渗漏点和ICGA高灌注区也并非一一对应的关系,据文献报道“暗区”对应的结构改变可能是:色素上皮层脱离,视网膜脱离区域感光细胞外节膜盘,视网膜下纤维素性渗出,扩张的脉络膜血管等[19-20]。因此,慢性CSC组中“暗区”多发提示我们病情长期反复可能会带来诸多视网膜脉络膜结构上的破坏,急性CSC组患者“暗区”出现率低可能因为脉络膜循环异常尚处于早期阶段。
在SD-OCT EDI模式B扫描中我们发现急性CSC患者视网膜外层结构完整性要明显好于慢性CSC患者。经亚组分析,外层结构的完整性与BCVA、病程关系密切,病史越久,外层结构损害越明显,BCVA越差,因此对于急性CSC的早期干预,防止病情反复发作转为慢性CSC是非常必要的。
综上所述,OCTA的应用和SD-OCT分辨率的提高为我们从视网膜脉络膜不同层面分析急慢性CSC的结构变化提供了新方法。本研究发现慢性CSC视网膜脉络膜结构损害比急性CSC更加严重,在国内首次报道了慢性CSC患眼可能存在血管造影无法显示的早期继发性CNV和急慢性CSC脉络膜浅层结构在OCTA中的不同特点,据此我们认为急性CSC的早期干预是至关重要的。但研究尚存在以下不足之处,如病例数较少,而且是单个时点的横断面研究,并未连续观察分析急性CSC发展至慢性CSC的过程,因此,对于CSC病程变化和形态学改变的进一步研究是非常必要的。
[参 考 文 献]
[1] Ciloglu E, Unal F, Dogan NC, et al. The relationship between the central serous chorioretinopathy, choroidal thickness, and serum hormone levels[J]. Graefes Arch Clin Exp Ophthalmol, 2018, 256(6):1111-1116.
[2] Maruko I, Iida T, Sugano Y, et al. Subfoveal choroidal thickness in fellow eyes of patients with central serous chorioretinopathy[J]. Retina, 2011, 31(8):1603-1608.
[3] Teke MY, Elgin U, Nalcacioglu-Yuksekkaya P, et al. Comparison of autofluorescence and optical coherence tomography findings in acute and chronic central serous chorioretinopathy[J]. Int J Ophthalmol, 2014, 7(2):350-354.
[4] Iacono P, Battaglia Parodi M, Falcomata B, et al. Central serous chorioretinopathy treatments: a mini review[J]. Ophthalmic Res, 2015, 55(2):76-83.
[5] Du J, Li R. Can fundus fluorescein angiography be performed for diabetic patients on oral metformin?[J]. Chin Med Sci J, 2017, 32(2):119-122.
[6] Lai WY, Tseng CL, Wu TT, et al. Correlation between baseline retinal microstructures in spectral-domain optic coherence tomography and need for early intervention in central serous chorioretinopathy[J]. BMJ Open Ophthalmol, 2017, 2(1):e000054.
[7] de Carlo TE, Romano A, Waheed NK, et al. A review of optical coherence tomography angiography (OCTA)[J]. Int J Retina Vitreous, 2015, 1:5.
[8] Ni G, Liu L, Yu X, et al. Contrast enhancement of spectral domain optical coherence tomography using spectrum correction[J]. Comput Biol Med, 2017, 89:505-511.
[9] Schmidt-Erfurth U, Klimscha S, Waldstein SM, et al. A view of the current and future role of optical coherence tomography in the management of age-related macular degeneration[J]. Eye (Lond), 2017, 31(1):26-44.
[10] Feucht N, Maier M, Lohmann CP, et al. OCT angiography findings in acute central serous chorioretinopathy[J]. Ophthalmic Surg Lasers Imaging Retina, 2016, 47(4):322-327.
[11] Agemy SA, Scripsema NK, Shah CM, et al. Retinal vascular perfusion density mapping using optical coherence tomography angiography in normals and diabetic retinopathy patients[J]. Retina, 2015, 35(11):2353-2363.
[12] Demircan A, Yesilkaya C, Alkin Z. Early choriocapillaris changes after half-fluence photodynamic therapy in chronic central serous chorioretinopathy evaluated by optical cohe-rence tomography angiography: preliminary results[J]. Photodiagnosis Photodyn Ther, 2018, 21:375-378.
[13] Yang D, Eliott D. Systemic mineralocorticoid antagonists in the treatment of central serous chorioretinopathy[J]. Semin Ophthalmol, 2017, 32(1):36-42.
[14] Sugiura A, Fujino R, Takemiya N, et al. The association between visual function and retinal structure in chronic central serous chorioretinopathy[J]. Sci Rep, 2017, 7(1):16288.
[15] Huang D, Jia Y, Gao SS, et al. Optical coherence tomography angiography using the optovue device[J]. Dev Ophthalmol, 2016, 56:6-12.
[16] Srour M, Querques G, Souied EH. Optical coherence tomography angiography of idiopathic polypoidal choroidal vasculopathy[J]. Dev Ophthalmol, 2016, 56:71-76.
[17] Quaranta-El Maftouhi M, El Maftouhi A, Eandi CM. Chronic central serous chorioretinopathy imaged by optical coherence tomographic angiography[J]. Am J Ophthalmol, 2015, 160(3):581-587.
[18] Dansingani KK, Gal-Or O, Sadda SR, et al. Understan-ding aneurysmal type 1 neovascularization (polypoidal choroidal vasculopathy): a lesson in the taxonomy of ‘expanded spectra’ -a review[J]. Clin Exp Ophthalmol, 2018, 46(2):189-200.
[19] De Bats F, Cornut PL, Wolff B, et al. Dark and white lesions observed in central serous chorioretinopathy on optical coherence tomography angiography[J]. Eur J Ophthalmol, 2018:1120672118758401.
[20] Costanzo E, Cohen SY, Miere A, et al. Optical cohe-rence tomography angiography in central serous chorioretinopathy[J]. J Ophthalmol, 2015, 2015:134783.

