肾茶总黄酮的含量测定
西双版纳州食品药品检验所,云南 景洪 666100
肾茶Clerodendranthusspicatus(Thunb.)C.Y.Wu又名猫须草,傣名“雅糯秒”,全草入药,为傣医常用药,有清火解毒,利尿排石,凉血止血之功[1]。傣药是四大民族医药之一,肾茶是傣医临床常用、疗效确切、具有解毒特色的常用品种,已开发出一些傣药产品如肾茶袋泡剂,取得了良好的经济效益和社会效益。肾茶含有橙黄酮、3′- 羟基-5,6,7,4′-四甲氧基黄酮、α-香树素、、熊果酸、6-甲氧基芫花素、5-羟基- 7 ,3′,4′-三甲氧基黄酮、鼠尾草素、5- 羟基-6 ,7,3 ,4′-四甲氧基黄酮、泽兰黄素、3′- 羟基- 5 ,7,8,4′- 四甲氧基黄酮、异橙黄酮、黄芪苷、异槲皮素、原儿茶醛、原儿茶酸、3,4 -二羟基苯酰甲醇 、迷迭香酸、迷迭香酸乙酯、秦皮乙素等化合物[2-5],其中含有的甲氧基黄酮主要是橙黄酮、半齿泽兰素、半齿泽兰素-5-甲醚(结构式见图)。文献报道[6-15]甲氧基黄酮类具有明显的抗氧化、抗肿瘤、抗炎、免疫调节及保护心血管作用,被誉为“天然抗氧化剂”。肾茶的标准收载于《湖南省中药材标准》(2009年版)、《广西壮族自治区壮药质量标准》(第二卷)(DYB45-GXZYCO111-2011),《云南省中药饮片标准》2005年版第一册。目前,未见对肾茶饮片总黄酮含量测定的报道[16],按《中国药典》2015年版四部通则[17]建立肾茶总黄酮含量测定方法,为肾茶质量标准的提高及后期产品研发奠定基础。

1 仪器与材料
1.1 仪器 UV-2550紫外可见光分光光度仪(岛津);101-EBS电热鼓风干燥箱(北京市永光明医疗仪器厂); DZKW-D-6 DIAN水浴锅(北京市永光明医疗仪器有限公司); BL310天平(德国赛多利斯集团);AE200电子天平(梅特勒-托利多仪器(上海)有限公司)。
1.2 材料 芦丁对照品(批号:100080-201610,中国食品药品检定研究院)。无水乙醇(分析纯)、氢氧化钠(优级纯)、亚硝酸钠(分析纯)、硝酸铝(分析纯)均为天津市风船化学试剂科技有限公司生产,水为蒸馏水。不同产地的22批药材分别采自云南景洪市、云南勐海县、云南勐腊县、云南普洱市、海南、云南瑞丽、云南元江、福建厦门、广西南宁。由西双版纳州食品药品检验所彭霞主任药师鉴定为唇形科植物肾茶Clerodendranthusspicatus(Thunberg) C. Y. Wu ex H. W. Li 的干燥地上部分。
2 方法与结果
2.1 对照品溶液的制备 精密称取芦丁对照品25 mg,置50 mL量瓶中,加乙醇适量,超声处理使溶解,放冷,加乙醇至刻度,摇匀。精密量取20 mL,置50 mL量瓶中,加水至刻度,摇匀,即得(每1 mL中含芦丁0.2 mg )。
2.2 标准曲线的制备 精密量取对照品溶l、2、3、4、5、6 mL,分别置25 mL量瓶中,各加水至6 mL,加5%亚硝酸钠溶液1 mL,摇匀,放置6 min,加10%硝酸铝溶液1 mL,摇匀,放置6分钟,加氢氧化钠试液10 mL,再加水至刻度,摇匀,放置15 min,以相应试剂为空白,按照紫外-可见分光光度法(通则0401),在500 nm的波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
2.3 测定法 取本品粉末约0.12 g,置具塞三角瓶中,精密称定,加入50%乙醇溶液100 mL,精密称定,置85℃水浴上回流1 h,放冷,精密称定,用50%乙醇溶液补足减失的重量,摇匀,滤过,精密量取续滤液10 mL,置25 mL量瓶中,加水稀释至刻度,摇匀,精密量取5 mL,置25 mL量瓶中,照标准曲线制备项下的方法,自“加水至6 mL”起依法测定吸光度,从标准曲线上读出供试品溶液中芦丁的重量。按干燥品计算,含总黄酮以芦丁(C27H30O16) 计的量。
2.4 吸收光谱的测定、光谱一致性检测 精密吸取芦丁对照品溶液、供试品溶液各4 mL,分别置25 mL量瓶中,照分光光度法,在200~750 nm波长范围内测定吸收光谱,结果芦丁对照品与供试品光谱吸收图谱基本一致,在500 nm波长处有最大吸收。参照肾茶胶囊中总黄酮的含量测定[18]及《中国药典》(2015年版一部)[19]收载 “山楂叶”中总黄酮的含量测定方法中芦丁的测定波长为500 nm,因此选取检测波长为500 nm。
2.5 线性关系考察 精密吸取芦丁对照品溶液0.25、0.50、0.75、1、2、3、4、5、6 mL(相当于芦丁1.98090、3.96180、5.94270、7.92360、15.84719、23.77079、31.69439、39.61798、47.54158 μg/mL),按上述测定法测定吸收度,以吸收度为纵坐标,浓度为横坐标 ,绘制标准曲线,计算得回归方程:Y= 0.01229X-0.00251,r2=0.9998,试验结果表明芦丁在2~48μg/mL范围内的线性关系良好。
2.6 精密度试验 取同一批号样品6份(产地:西双版纳勐腊县勐满农场,批号:1612312),按供试品测定方法测定,总黄酮平均含量为17.3%,RSD为0.78%。
2.7 重复性试验 精密量取2.1项下对照品溶液(31.69439μg/mL),按“2.3”项下方法操作,依次测定7次,以吸收度值计算RSD为0.060%,结果符合要求。
2.8 加样回收率试验 根据《中国药典》2015版四部(通则9101),药品质量标准分析方法验证指导原则中准确度相关规定,设计同一浓度,9份供试品溶液照2.3方法进行测定,用9个测定结果进行评价。该分析方法的回收率为95.13%~100.01%,且RSD为1.58%,结果符合要求。表明该法准确可靠,可用于肾茶总黄酮含量测定。
2.9 样品测定 取不同产地22批肾茶,按照上述方法制备供试品溶液,分别测定22批样品,按2.2确定的工作曲线,以干燥品计算总黄酮含量,结果见表1。由表2可得,F=5030.293>F0.01(21,22)=2.74,即说明不同产地肾茶中总黄酮的含量差异极显著。
2.10 样品不同部位测定 按照上述方法,分别测定了5批样品的茎和叶总黄酮的含量,按干燥品计算,结果见表3。由表4可得,F=28390.505>F0.01(9,10)=4.95,即说明不同地区肾茶不同部位总黄酮的含量差异极显著。

表1 不同产地肾茶总黄酮的含量 (n=2)

表2 不同产地肾茶总黄酮的含量方差分析结果
注:“*”表示差异达到F0.05显著水平,“**”表示差异达到F0.01极显著水平。

表3 肾茶不同部位总黄酮的含量 (n=2)
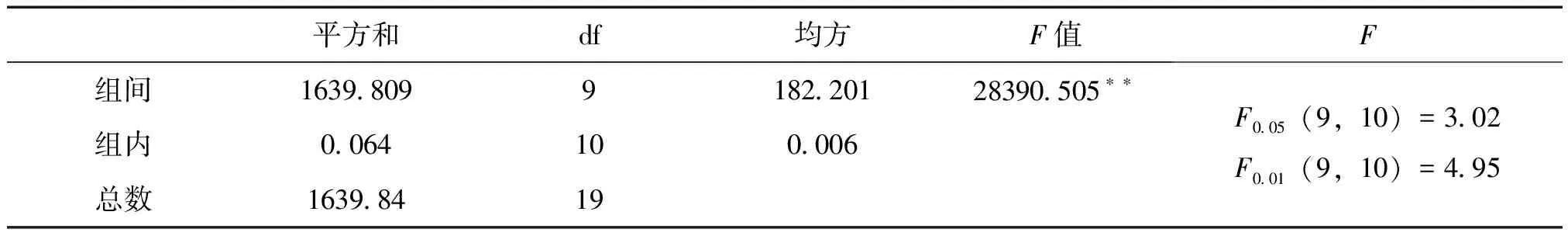
表4 肾茶不同部位总黄酮的含量方差分析结果
注:“*”表示差异达到F0.05显著水平,“**”表示差异达到F0.01极显著水平。
3 讨论
3.1 试验条件的考察 试验采用分光光度法以芦丁为对照品,以相应的试剂为空白,分别考察溶剂:甲醇、70%甲醇、50%甲醇、乙醇、70%乙醇、50%乙醇;提取方式:回流提取(提取时间分别为60 min、120 min、180 min;回流温度分别为75 ℃、85 ℃、95 ℃);超声处理(超声时间分别为30 min、45 min、60 min)、振摇提取(振摇时间为120 min温度为65 ℃)、取样量(0.12 g、0.25 g、0.50 g)制备的供试品溶液,在500 nm波长处测定吸光度,计算总黄酮的含量。结果表明,取样量为0.12 g,50%乙醇为溶剂85 ℃回流提取,肾茶中总黄酮的溶出量最大,回流时间60 min、120 min、180 min肾茶中总黄酮的溶出量变化不大,选择取样量为0.12 g,以50%乙醇为溶剂,提取温度为85 ℃回流60 min制备供试品溶液。
3.2 单因素方差分析 目的是通过分析各样本之间的差异,来检验各样本总体效应之间的差异,从而确定该因素对试验结果是否有显著性影响。由表2可得,F=5030.293>F0.01(21,22)=2.74,即说明不同产地肾茶中总黄酮的含量差异极显著。由表4可得,F=28390.505>F0.01(9,10)=4.95,即说明不同地区肾茶不同部位总黄酮的含量差异极显著。
肾茶含有的甲氧基黄酮类,药理研究表明[6-15]具有明显的抗氧化、抗肿瘤、抗炎、免疫调节及保护心血管作用,肾茶为西双版纳傣族自治州的傣族常用药物,平时代茶饮,用于治疗肾炎、肾结石等疾病,深入研究其质量控制方法显得尤为重要。本实验结果显示不同产地肾茶总黄酮含量差异极显著,不同部位(茎、叶)总黄酮含量差异极显著。本研究建立了分光光度法法测定肾茶中总黄酮的含量,此方法简便、快速、准确,经方法学验证,可作为检验肾茶中总黄酮的含量的一种手段,为肾茶药材的进一步研究提供方法依据。
[1]林艳芳.中国傣医药彩色图谱[M].昆明:云南民族出版社,2003:408.
[2]赵爱华,赵勤实,李蓉涛,等.肾茶的化学成分[J].植物分类与资源报,2004,26(5):563-568.
[3]钟纪育,邬宗实.肾茶的化学成分[J].云南植物研究,1984,6(3):344-345.
[4]李小珍, 晏永明,程永现.肾茶化学成分研究[J].天然产物研究与开发,2017,29:183-189.
[5]樊飞飞,李晓波,邱明丰,等.傣药“雅糯妙”(肾茶)正丁醇部位的化学成分研究[J].现代生物医学进展,2013,13 (32):6227-6230.
[6]李光,路娟,李学兰,等.HPLC 法测定肾茶中3种甲氧基黄酮类活性成分[J].医药导报,2015,34 (9):103-106.
[7]LYCKANDER I M,MALTERUD K E.Lipophilic flavonoidsfrom Orthosiphon spicatus prevent oxidative inactivation of15-lipoxygenase[J]. Prostaglandins Leukot Essent FattyAcids,1996,54(4) : 239-246.
[8]OLAH N K,RADU L,MOGOSAN C,et al. Phytochemicaland pharmacological studies on Orthosiphon stamineus Benth.( Lamiaceae) hydroalcoholic extracts[J].J Pharm Biomed Anal, 2003, 33(1) : 117-123.
[9]AKOWUAH G A,ZHARI I,NORHAYATI I,et al. Sinensetin,eupatorin,3 '-hydroxy-5,6,7,4 '-tetramethoxyflavoneand rosmarinic acid contents and antioxidative effect ofOrthosiphon stamineus from Malaysia[J].Food Chem, 2004,87(4) : 559-566.
[10]FARHAN M,RAZAK S A,PIN K Y,et al. Antioxidantactivity and phenolic content of different parts ofOrthosiphon stamineus grown under different lightintensities[J]. J Tropical Forest Sci,2012,24(2) : 173 -177.
[11]单杨,李高阳,李忠海.柑橘皮中多甲氧基黄酮的体外抗氧化活性研究[J].食品科学, 2007, 28(8) : 100-103.
[12]AKAO Y,OHGUCHI K, IINUMA M,et al.Interactive effectsof polymethoxy flavones from Citrus on cell growthinhibition in human neuroblastoma SH-SY5Y cells [J].Bioorg Med Chemist,2008,16(6) : 2803-2810.
[13]张金杰,陈宇峰,颜鸣,等.野菊花中的黄酮类化学成分[J].医药导报, 2013, 32( 1) : 15-18.
[14]MANTHEY J A,BENDELE P.Anti-inflammatory activity ofan orange peel polymethoxylated flavone,3',4',3,5,6,7,8-heptamethoxyflavone,in the rat carrageenan /paw edema andmouse lipopolysaccharide-challenge assays[J].J Agric Food Chem, 2008, 56(20) : 9399-9403.
[15]GREEN C O,WHEATLEY A O,HANCHARD B, et al.Histopathological alterations in organ structures ofhypercholesterolemic rats fed ortanique peelpolymethoxylated flavones[J]. Basic Appl Pathol,2011,4:97-102.
[16]云南省食品药品监督管理局. 云南省中药饮片标准 (2005年版 第一册)[M].昆明:云南美术出版社,2006.
[17]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:374-377.
[18]吕占国,路更,王立强.肾茶胶囊中总黄酮的含量测定[J].药物研究,2012,2(17):42-44.
[19]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:32.

