物质结构与性质的命题特点及应对策略
■郑州外国语学校 包 军
物质结构与性质属于选考内容,占15分左右。试题从考查内容可分为三部分:一是原子结构与性质,二是分子结构与性质,三是晶体结构与性质。该部分内容较好体现化学学科核心素养之一且为第一条的“宏观辨识与微观探析”。下面谈一下它的命题特点及应对策略。
一、命题特点
(1)从问题设置的数量看一般在10个空左右。
(2)从问题考查内容看,不回避高频考点,如基态原子的核外电子排布(价电子排布式)、轨道表达式、共价键类型、中心原子杂化方式、分子的空间构型、分子的物理性质的判断及解释、晶胞的有关计算等几乎年年考查。
(3)从区分度的角度看,高考题也会通过考查绝大多数考生在某一知识点上的短处,达到为高水平大学选拔优秀学生的目的,部分试题的难度远远超出高中课本的内容,这点在2013年之后的高考试题中皆有体现。
(4)取材来自全球科技发展中的重要化学材料,如热点石墨烯、半导体材料砷化镓、钛合金、锂材料等,尤其是中国科学家近几年在科技领域中取得的具有较强影响力的成果也会作为命题素材,以凸显中国优秀文化的强大,从而达到立德树人的目的。比如2017年新课标Ⅱ第35题“我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用 R 代表)”,这个材料选自2017年1月27日南京理工大学胡炳成团队的科研成果,题中的图片和发表的文章中的几乎一模一样。
(5)从失分点来看,依然是利用原理解释物质结构与性质,有关晶胞的识别和计算。
二、备考应对策略
(1)理解物质结构与性质内容中的每一个概念。
(2)全覆盖仔细阅读课本,对知识不遗漏。
(3)对高频考点进行重点训练。
(4)精心训练近五年全国各省份的高考真题,并进行总结。
三、高频考点
1.原子结构与性质中的高频考点。
原子核外电子的排布原理及能级分布,能用电子排布式或电子排布图表示常见元素(1~36号)原子核外电子、价电子的排布,原子核外电子的运动状态。
例1(1)基态K原子中,核外电子占据最高能层的符号是____,占据该能层电子的电子云轮廓图形状为____。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr的低,原因是____。
(2)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:氮原子价层电子对的轨道表达式(电子排布图)为____。
(3)研究发现,在CO2低压合成甲醇反应(CO2+3H2→CH3OH+H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:CO基态原子核外电子排布式为____。元素Mn与O中,第一电离能较大的是____,基态原子核外未成对电子数较多的是____。
(4)东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。镍元素基态原子的电子排布式为____,3d能级上的未成对的电子数为____。
(5)Cu+基态核外电子排布式为____。
答案:(1)N 球形 K的原子半径较大,且价电子较少,金属键较弱
(2)
(3)1s22s22p63s23p63d74s2或[Ar]3d74s2OMn
(4)1s22s22p63s23p63d84s2或[Ar]3d84s22
(5)1s22s22p63s23p63d10
2.元素的性质与电负性、电离能的关系,并能用以说明元素的某些性质。
例2(1)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____。
(2)单质铜及镍都是由____键形成的晶体。元素铜与镍的第二电离能分别为:ICu=1959kJ·Mol-1,INi=1753kJ·mol-1,ICu>INi的原因是____。
(3)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:根据元素周期律,原子半径Ga____As,第一电离能Ga____As。(填“大于”或“小于”)
(4)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为____。
(5)科学家正在研究温室气体CH4和CO2的转化和利用。CH4和CO2所含的三种元素电负性从小到大的顺序为____。
答案:(1)O>Ge>Zn(2)金属铜失去的是全充满的3d10电子,镍失去的是4s1电子 (3)大于 小于 (4)O1s22s22p63s23p3(或[Ne]3s23p3) (5)H、C、O
3.化学键与物质的性质。
理解离子键的形成、共价键的形成、配位键的形成、金属键的形成,能用化学键理论解释晶体的一些物理性质、杂化轨道理论及常见的杂化轨道类型(sp、sp2、sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构。
例3(1)用X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何构型为
____,中心原子的杂化形式为____。
(2)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图1所示。
①从结构角度分析,R中两种阳离子的相同之处为____,不同之处为____。(填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型

图1
②R中阴离子中的σ键总数为个。分子中的大π键可用符号表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为),则中的大π键应表示为____。
③图1中虚线代表氢键,其表示式为(NH4+)N—H…Cl____、 、____。
(3)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在____。
(4)HOCH2CN的结构简式为。
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O══[Zn(H2O)4]2++4HOCH2CN
①1molHCHO分子中含有σ键的数目为____mol。
②HOCH2CN分子中碳原子轨道的杂化类型是____。
③与H2O分子互为等电子体的阴离子为____。
④[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____。
解析:(1)I3+的中心原子为I,有2对σ键电子对(m=2);中心原子上的孤电子对数==2(n=2)。由价层电子对互斥理论,价层电子总对数为2+2=4,中心I原子为sp3杂化,由于孤电子对数为2,分子的空间构型为V形。
(2)①有4个H的阳离子为NH4+,有3个H的阳离子为H3O+。NH4+中心原子N含有4个σ键,其中一个是配位键,孤电子对数为(5-1-4×1)=0,价层电子对数为4,杂化类型为sp3,空间构型为正四面体;H3O+中心原子是O,含有3σ键,其中一个是配位键,孤电子对数为=1,价层电子对数为4,为sp3杂化,空间构型为三角锥形。
②方法1:根据图1可知,N5-中的σ键总数为5个,根据信息,N5-有6个电子可形成大π键,可用符号Π65表示。
方法2:也可以类比苯分子形成Π66的方法分析,先研究N5,每个N原子进行了sp2杂化,3个未成对电子中2个形成了σ键,每个N原子都剩余1个未成对电子,5个N原子共用5个电子形成Π55,N5-可以看作N5得到一个电子形成N5-,所以5个N原子共用了6个电子。
③O、N的非金属性较强,对应的O—H、N—H都可与H形成氢键,还可表示为(H3O+)O—H…N、(NH4+)N—H…N。
(3)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中N原子与3个O原子形成3个σ键,硝酸根中有一个氮氧双键,所以还存在π键。
(4)①甲醛的结构式是,由于单键都是σ键,双键中有一个σ键和一个π键,因此在一个甲醛分子中含有3个σ键和1个π键,所以在1molHCHO分子中含有σ键的数目为3mol。
②根据HOCH2CN的结构简式可知在HOCH2CN分子中,连有羟基—OH的碳原子形成4个单键,因此杂化类型是sp3杂化,含有—CN的碳原子与N原子形成三键,则其轨道的杂化轨道类型是sp杂化。
③原子数和价电子数分别都相等的是等电子体,H2O含有10个电子,则与H2O分子互为等电子体的阴离子为NH2-。
④在[Zn(CN)4]2-中Zn2+与CN-的N原子形成配位键,N原子提供一对孤对电子,Zn2+的空轨道接受电子对,因此若不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
答案:(1)V形 sp3(2)①ABDC②5Π65③(H3O+)O—H…N (NH+4)N—H…N(3)π键、离子键(4)①3②sp③NH-2④
4.分子晶体、原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别;根据晶胞确定晶体的组成并进行相关的计算;晶格能的概念及其对离子晶体性质的影响。
例4KIOO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图2所示。
(1)K与O之间的最短距离为____nm。

图2
(2)与K紧邻的O的个数为____。
(3)在KIOO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于____位置,O处于____位置。
解析:(1)最近的K和O是晶胞中顶点的K和面心的O,其距离为边长的倍。故最短距离为0.446nm×=0.315nm。
(2)从晶胞中可以看出,在一个晶胞中与顶点K紧邻的O为含有该顶点的三个面面心的O,即为3×个。由于一个顶点的K被8个晶胞共用,故与一个K紧邻的O有3××8=12(个)。
(3)KIO3晶体以K、I、O分别处于顶角、体心、面心位置的邻近4个晶胞,如图3,并对K、I作相应编号。由图3得,以I处于各顶角位置的KIO3晶胞如图4。由图4得,K处于体心位置,O处于棱心位置。
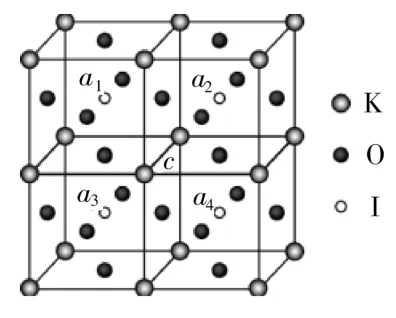
图3

图4
例5M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。单质M的晶体类型为____,晶体中原子间通过____作用形成面心立方密堆积 A1,其中M原子的配位数为____。
解析:M是金属Cu,属于金属晶体,晶体中原子间通过金属键形成面心立方密堆积,面心立方密堆积的配位数都是12。

图5
例6砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图5所示。该晶体的类型为____,Ga与As以____键结合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____。
解析:由于GaAs的熔点为1238℃,熔点较高,属于原子晶体,原子晶体中原子之间以共价键结合。GaAs晶胞中原子的体积占晶胞体积的百分率为×100%=×100%。
策略:晶胞的计算是难点,但有法可循。一是熟悉教材中各类晶体中的堆积方式,二是掌握典型模型中粒子之间的位置以及数值关系,三是注意单位换算。


